修回日期: 2009-09-26
接受日期: 2009-09-28
在线出版日期: 2009-10-18
目的: 探讨抑癌基因PTEN在食管癌及癌旁正常组织中的表达, 及其与微血管密度(MVD)和临床病理特征的关系.
方法: 选用食管鳞癌手术切除病理标本48例, 手术远端正常食管组织标本40例. 采用免疫组织化学SP法检测PTEN编码蛋白的表达水平, CD31抗体进行血管内皮染色、计算微血管密度, 分析PTEN在不同组织中的表达与MVD和食管癌组织分化程度、浸润深度、淋巴结转移的关系.
结果: 食管鳞癌组织中PTEN编码蛋白阳性表达率低于癌旁正常食管黏膜组织(52.08% vs 92.50%, P<0.01), 而其MVD值显著高于癌旁正常组织(41.72±8.67 vs 21.01±3.85, P<0.01); Ⅰ、Ⅱ、Ⅲ级鳞癌PTEN阳性表达率有显著差异(75.0% vs 55.0% vs 33.33%, 均P<0.05), MVD值差异无统计学意义; 癌组织侵及浅肌层以上与深肌层PTEN与MVD值的表达有显著差异(77.27% vs 42.31%; 35.49±5.89 vs 46.01±6.27, 均P<0.01); 淋巴结转移组与非转移组PTEN阳性表达率无显著差异, MVD值差异则有统计学意义(46.71±7.89 vs 35.92±2.54, P<0.01).
结论: 抑癌基因PTEN、MVD在食管癌中表达的高低, 与肿瘤的生长、浸润和转移相关. PTEN基因表达的突变或缺失能促进肿瘤血管的形成, 可作为临床治疗和判断预后的依据.
引文著录: 秦咏梅, 韩宇, 张超贤, 常廷民. PTEN在食管癌中的表达及其与微血管密度和临床病理特征的关系. 世界华人消化杂志 2009; 17(29): 3023-3027
Revised: September 26, 2009
Accepted: September 28, 2009
Published online: October 18, 2009
AIM: To investigate the expression of PTEN and analyze its correlation with microvessel density (MVD) and pathological parameters in esophageal squamous cell carcinoma (ESCC).
METHODS: Forty-eight ESCC specimens and 40 normal esophageal tissues closely adjacent to carcinomas were used in the study. The expression of PTEN and CD31 in these specimens was detected by immunohistochemistry using the streptavidin-peroxidase method.
RESULTS: The positive rate of PTEN expression in ESCC was significantly lower than that in normal esophageal tissue (52.08% vs 92.50%, P < 0.01). The positive rate of PTEN expression in ESCC was correlated with pathological grade (Grade I: 75.0%; Grade II; 55.0%; and Grade III: 33.33%; all P < 0.05), infiltrative deepness (superficial infiltration: 77.27%; deep infiltration: 42.31%, P < 0.01), but not with lymph node metastasis. The MVD was significantly higher in ESCC than in normal esophageal tissue (41.72 ± 8.67 vs 21.01 ± 3.85, P < 0.01). The MVD in ESCC was correlated with infiltrative deepness (superficial infiltration: 35.49 ± 5.89; deep infiltration: 46.01 ± 6.27, P < 0.01) and lymph node metastasis (46.71 ± 7.89 vs35.92 ± 2.54, P < 0.01), but not with pathological grade.
CONCLUSION: PTEN expression and MVD in esophageal carcinoma are related to tumor growth, invasion and metastasis. Loss or decreased expression of PTEN plays a critical role in tumor angiogenesis. PTEN expression can be used as a diagnostic and prognostic marker for ESCC.
- Citation: Qin YM, Han Y, Zhang CX, Chang TM. Correlation of PTEN expression with microvessel density and pathological parameters in esophageal carcinoma. Shijie Huaren Xiaohua Zazhi 2009; 17(29): 3023-3027
- URL: https://www.wjgnet.com/1009-3079/full/v17/i29/3023.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i29.3023
抑癌基因PTEN定位于人类染色体10q 23.3, 是双特异性磷酸酶, 其开放阅读框中有酪氨酸结构域及细胞骨架蛋白(tensin)和辅助蛋白(auxilin)的同源氨基酸序列. 已有研究证实PTEN在多种进展期、转移性肿瘤如脑肿瘤、乳腺癌、膀胱癌等发生高频率突变或缺失, 可能其参与细胞生长调节, 并在肿瘤细胞浸润、血管发生及肿瘤转移中起一定作用[1-3]. 本研究采用免疫组织化学方法检测食管鳞癌中PTEN的表达, 同时计算微血管密度(microvessel density, MVD), 旨在探讨PTEN表达情况及与MVD和临床病理特征的关系.
收集新乡医学院第一附属医院2005-01/2007-01临床和病理资料完整的存档组织标本, 原发性食管鳞癌48例, 手术远端正常食管组织40例. 其中男36例, 女12例, 年龄41-79(平均58)岁. 所有患者术前均未接受化疗、放疗及其他特殊治疗. 所有标本均经中性甲醛液固定, 石蜡包埋, 连续切片, 每份标本均行HE染色对照. 经组织学证实: Ⅰ级鳞癌16例, Ⅱ级鳞癌20例, Ⅲ级鳞癌12例; 浸润浅肌层以上22例, 深肌层以下26例; 有淋巴结转移16例, 无淋巴结转移32例.
1.2.1 免疫组织化学SP法: 鼠抗人PTEN mAb及SP试剂盒均为Sanata Cruz公司产品. 用PBS代替一抗作阴性对照, 以正常胃腺上皮作阳性对照. 体积分数0.3%甲醇过氧化氢阻断内源性过氧化物酶, 滴加PTEN mAb, 4℃湿盒内过夜, 滴加生物素标记二抗孵育, 滴加三抗工作液, 均以PBS冲洗, DAB显色. 鼠抗人CD31 mAb(克隆系1A10)标记内皮细胞, 免疫组织化学单染通用二步法(PV-9000)试剂盒, DAB显色, 试剂均购自北京中杉金桥生物技术有限公司.
1.2.2 结果判断: PTEN蛋白以细胞质或细胞核出现棕黄色或淡黄色颗粒判断为阳性细胞. 每张切片随机观察染色清晰的10个高倍视野(×400), 计数1000个细胞, 求阳性细胞百分率, PTEN阳性细胞数≤10%为阴性(-); 11%-50%为弱阳性(+), 51%-75%为中度阳性(++), >75%为强阳性(+++). 阳性细胞数为>50%. MVD按Weider判定法[4], 通过光镜下计数CD31染色阳性的血管内皮完成. 在高倍镜下(×400)分别计数3个视野, 取3个视野下的平均数表示MVD值. 每一个染成棕黄色的可与周围血管、肿瘤细胞和其他结缔组织分开的内皮细胞或内皮细胞簇被判定为1个微血管. 正常对照组的血管计数主要在上皮层的下方进行.
统计学处理 采用SPSS12.0分析软件包进行统计学分析, χ2检验比较各组间率的差异, 计量资料采用方差分析、t检验、q检验, PTEN与MVD的关系用Spearman相关分析. P<0.05为差异有统计学意义.
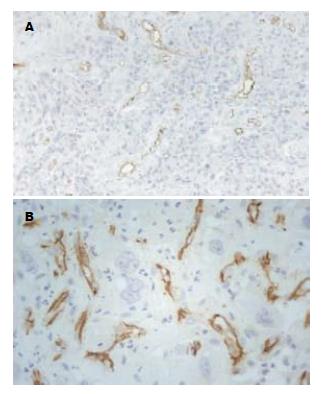
PTEN阳性颗粒呈棕黄色, 主要位于细胞核内. 48例食管鳞癌中PTEN蛋白阳性表达率为52.08%(25/48), 显著低于癌旁正常食管黏膜92.50%(37/40), 差异有统计学意义(χ2 = 15.234, P<0.01, 图1).
PTEN表达与食管癌的分化程度、浸润深度相关. 癌组织分化程度越低, PTEN阳性率越低, 在Ⅰ、Ⅱ、Ⅲ级鳞癌组织中的表达率各组间差异有统计学意义(P<0.05). 侵及深肌层的表达率低于侵及浅肌层以上者(P<0.05). 但淋巴结转移组与无淋巴结转移组表达率差异无统计学意义(P>0.05, 表1).
| 临床病理参数 | n | PTEN表达(n ) | 阳性率(%) | χ2值 | P值 | |
| 阳性 | 阴性 | |||||
| 正常食管 | 40 | 37 | 3 | 92.50 | ||
| 鳞癌 | 48 | 25 | 23 | 52.08 | 15.234 | <0.01 |
| Ⅰ | 16 | 12 | 4 | 75.00 | ||
| Ⅱ | 20 | 11 | 9 | 55.00 | ||
| Ⅲ | 12 | 4 | 8 | 33.33 | 4.8593 | <0.05 |
| 浸润程度 | ||||||
| 浅肌层以上 | 22 | 17 | 5 | 77.27 | ||
| 深肌层 | 26 | 11 | 15 | 42.31 | 4.6420 | <0.05 |
| 淋巴结转移 | ||||||
| 有 | 16 | 6 | 10 | 37.50 | ||
| 无 | 32 | 22 | 10 | 68.75 | 3.0960 | >0.05 |
CD31阳性染色呈棕黄色, 定位于血管内皮细胞膜, 癌组织中微血管呈条索状, 内皮细胞簇集, 管腔形态不完整, 癌灶边缘血管相对密集; 正常组织中血管比较规则、稀少, 分布较均匀(图2). 鳞癌组织中MVD值显著高于正常黏膜组织(P<0.01). 鳞癌组中侵及浅肌层以上组MVD显著低于侵及深肌层组(t = 5.9539, P<0.01), 无淋巴结转移组显著低于淋巴结转移组(t = 7.0989, P<0.01). Ⅰ-Ⅲ级鳞癌中MVD值依次增高, 但差异无统计学意义(表2).
| 临床病理参数 | n | MVD | χ2值 | P 值 |
| 正常食管 | 40 | 21.01±3.85 | ||
| 鳞癌 | 48 | 41.72±8.67 | 13.9900 | <0.01 |
| Ⅰ | 16 | 36.87±6.74 | 0.8582 | |
| Ⅱ 20 | 38.45±4.25 | 1.7940 | ||
| Ⅲ 12 | 41.23±9.60 | 1.4607 | >0.05 | |
| 浸润程度 | ||||
| 浅肌层以上 | 22 | 35.49±5.89 | ||
| 深肌层 | 26 | 46.01±6.27 | 5.9539 | <0.01 |
| 淋巴结转移 | ||||
| 有 | 16 | 46.71±7.89 | ||
| 无 | 32 | 35.92±2.54 | 7.0989 | <0.01 |
经Spearman相关分析, PTEN表达与MVD之间呈负相关(r = -0.522, P<0.01).
食管癌的发生、发展是个多步骤、多因素的复杂过程, 在此过程中, 抑癌基因的缺失或表达失调是食管癌发生发展的重要原因之一. PTEN是继p53、pRb、p16后又一重要抑癌基因. PTEN 基因是Li et al[1]1997年从原发性乳腺癌、前列腺癌以及胶质母细胞瘤细胞株克隆得到的, 一种迄今为止唯一具有酪氨酸、磷酸丝氨酸/苏氨酸双特异性磷酸酶活性的新型抑癌基因. 其编码蛋白即蛋白酪氨酸磷酸酶, 酪氨酸磷酸化后是细胞生长刺激途径的一部分, 蛋白酪氨酸磷酸酶能使蛋白中的酪氨酸去磷酸, 故PTEN基因的缺失、突变及表达产物的失活等均可影响肿瘤的发生发展[2-3], PTEN的抑癌功能主要依赖于脂质磷酸酶活性[5]. 同时PTEN具有与细胞张力蛋白和辅助蛋白同源的序列, 可以使其在局灶黏附点与肌动蛋白结合,与该位点的复合物(包括整合素、局灶黏附激酶FAK、Src、酪氨酸激酶及生长因子受体)相互作用, 在肿瘤细胞浸润、肿瘤转移中起到一定作用[6]. 目前发现其抑制肿瘤机制主要为: (1)通过负调控PI3K/AKT信号通路, 从而阻止细胞永生化, 维持细胞正常的生长周期, 抑制凋亡阻滞和肿瘤血管生成[7]; (2)PTEN含tensin的同源序列, 直接抑制FAK/P130Cas磷酸化, 负调控整合素信号的传导, 削弱局部黏附作用及细胞骨架的形成, 抑制肿瘤的增殖、黏附、侵袭、转移和扩散[8]; (3)PTEN促使原癌蛋白MDM2降解, 促进抑癌基因p53的转录活化; (4)PTEN突变上调内皮生长. 李异玲 et al研究表明PTEN对于增生性萎缩性胃炎向恶性转化过程中作用明显, 在胃癌的发生过程中进行性下调, 随恶性程度的增加缺失率增高[9]. Guo et al通过应用聚合酶链反应-单链构象多态性研究认为PTEN基因的突变在胃癌进展中起重要作用[10]. Tamura[11]认为启动子异常甲基化是胃癌PTEN基因失活的主要原因, PTEN在高分化胃癌检出率高于低分化胃癌. 张沛怡 et al研究发现PTEN蛋白的异常表达参与结、直肠黏膜恶性转化过程[12]. Tachibana et al临床研究报道细胞核PTEN表达与肿瘤肉眼分级、浸润深度、美国癌症联合会(AJCC)临床分期显著相关, 细胞核PTEN阳性表达者10年生存率显著高于阴性表达者[13].
PTEN基因的突变和肿瘤的血管形成具有一定的关系. Laughner et al[14]研究证实PTEN基因突变后, 可解除对PI3K-AKT-FARP途径的抑制, 进而增强缺氧诱导因子-1α的表达, 最终促使VEGF的表达以及肿瘤新生血管的形成. Tsigkos et al研究表明, PTEN基因的表达通过使Ang-1等血管因子表达水平降低从而升高Ang-2的表达水平, 因此认为PTEN对正常心血管形成和出生后血管形成包括肿瘤血管的形成都起了重要作用[15]. Gu et al[16]则发现PTEN可使FAK磷酸化, 参与细胞迁移、铺展、聚焦以及黏附活动. PTEN基因突变或蛋白表达降低可使细胞间的黏附力下降, 并能上调金属基质蛋白酶(matrix metalloproteinase, MMP)和VEGF的表达, 进而促进肿瘤细胞向间质侵袭以及肿瘤血管形成. 食管癌的发生过程中, 微血管的增加, 一方面向肿瘤组织提供更多的营养, 有利于其迅速增殖及向周围组织浸润, 另一方面也扩大了肿瘤细胞与微血管的接触面积, 有利于肿瘤细胞进入微循环, 从而促进肿瘤的淋巴结转移. 微血管形成是肿瘤细胞获取营养、肿瘤赖以存活以发生远处转移的最基本条件. 对肿瘤血管生成进行定量分析有许多生物方法, 但大多不能得到可靠的结果, 但是针对血管内皮细胞抗原的免疫组织化学技术, 使肿瘤血管的定量较为可靠. MVD被认为是能反映肿瘤血管生成的一个指标. MVD不仅与肿瘤细胞的营养和供氧有关, 而且也反映了肿瘤的浸润和转移能力[17]. 肿瘤微血管生成受到多种促进和抑制因子的共同作用. 在多种肿瘤中MVD的表达明显增高, 并且与肿瘤的恶性度成正相关[18]. 许多研究表明, 肿瘤的MVD与肿瘤转移和患者预后密切相关. 随着肿瘤MVD的增强, 肿瘤侵袭转移等恶性潜能也明显增加. MVD被认为是预测肿瘤转移、复发和预后的一项重要指标[19].
本研究显示, 食管癌组织中PTEN蛋白的表达显著低于正常食管组织(P<0.01), 食管癌中的PTEN表达与肿瘤的分化程度、浸润深度相关(P<0.05), 但在本研究中与淋巴结的转移无关, 提示PTEN阳性表达在抑制食管癌发生发展中起到一定作用. 本研究中食管癌组织MVD值明显高于食管正常组织, 有淋巴结转移者MVD值明显高于无淋巴结转移者, 差异有显著性(P<0.01). 但MVD值与食管癌组织分化程度无关(P>0.05). MVD的表达与PTEN表达呈负相关, 这说明PTEN基因在食管癌中的表达可以抑制肿瘤血管的生成, 食管癌中PTEN基因为血管生成的负性调控因子, 他表达的缺失和MVD的高表达预示着食管癌更具侵袭性, 恶性度更高, 预后更差. 因此, 同时检测食管癌中PTEN和MVD有助于判断食管癌患者的预后.
PTEN是继p53、pRb、p16后又一重要抑癌基因, 其缺失、突变及表达产物的失活等均可影响肿瘤的发生、发展, 并在肿瘤细胞浸润、肿瘤转移中起到一定作用. 而微血管密度能定量反映肿瘤血管的生成, 肿瘤微血管不仅与肿瘤细胞的营养和供氧有关, 也反映了肿瘤的浸润和转移能力.
曹秀峰, 主任医师, 南京医科大学附属南京第一医院肿瘤中心.
PTEN能否作为监测肿瘤恶性转化或判断肿瘤患者预后的一个免疫组织化学指标, 在消化系肿瘤的发生、发展、浸润及转移中的作用机制, 能否进行基因治疗等有待于进一步研究、证实.
本文证实检测PTEN与MVD, 将有助于评估食管癌患者预后, 更合理地安排个体化治疗.
本研究过程及方法正确, 结论具有一定的临床指导价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Li J, Yen C, Liaw D, Podsypanina K, Bose S, Wang SI, Puc J, Miliaresis C, Rodgers L, McCombie R. PTEN, a putative protein tyrosine phosphatase gene mutated in human brain, breast, and prostate cancer. Science. 1997;275:1943-1947. [PubMed] [DOI] |
| 2. | Li DM, Sun H. TEP1, encoded by a candidate tumor suppressor locus, is a novel protein tyrosine phosphatase regulated by transforming growth factor beta. Cancer Res. 1997;57:2124-2129. [PubMed] |
| 3. | Steck PA, Pershouse MA, Jasser SA, Yung WK, Lin H, Ligon AH, Langford LA, Baumgard ML, Hattier T, Davis T. Identification of a candidate tumour suppressor gene, MMAC1, at chromosome 10q23.3 that is mutated in multiple advanced cancers. Nat Genet. 1997;15:356-362. [PubMed] [DOI] |
| 4. | Weidner N, Carroll PR, Flax J, Blumenfeld W, Folkman J. Tumor angiogenesis correlates with metastasis in invasive prostate carcinoma. Am J Pathol. 1993;143:401-409. [PubMed] |
| 5. | Vazquez F, Matsuoka S, Sellers WR, Yanagida T, Ueda M, Devreotes PN. Tumor suppressor PTEN acts through dynamic interaction with the plasma membrane. Proc Natl Acad Sci U S A. 2006;103:3633-3638. [PubMed] [DOI] |
| 6. | Gautam A, Li ZR, Bepler G. RRM1-induced metastasis suppression through PTEN-regulated pathways. Oncogene. 2003;22:2135-2142. [PubMed] [DOI] |
| 7. | Martelli AM, Cocco L, Capitani S, Miscia S, Papa S, Manzoli FA. Nuclear phosphatidylinositol 3,4,5-trisphosphate, phosphatidylinositol 3-kinase, Akt, and PTen: emerging key regulators of anti-apoptotic signaling and carcinogenesis. Eur J Histochem. 2007;51 Suppl 1:125-131. [PubMed] |
| 8. | Leslie NR, Yang X, Downes CP, Weijer CJ. The regulation of cell migration by PTEN. Biochem Soc Trans. 2005;33:1507-1508. [PubMed] [DOI] |
| 10. | Guo CY, Xu XF, Wu JY, Liu SF. PCR-SSCP-DNA sequencing method in detecting PTEN gene mutation and its significance in human gastric cancer. World J Gastroenterol. 2008;14:3804-3811. [PubMed] [DOI] |
| 11. | Tamura G. Alterations of tumor suppressor and tumor-related genes in the development and progression of gastric cancer. World J Gastroenterol. 2006;12:192-198. [PubMed] |
| 13. | Tachibana M, Shibakita M, Ohno S, Kinugasa S, Yoshimura H, Ueda S, Fujii T, Rahman MA, Dhar DK, Nagasue N. Expression and prognostic significance of PTEN product protein in patients with esophageal squamous cell carcinoma. Cancer. 2002;94:1955-1960. [PubMed] [DOI] |
| 14. | Laughner E, Taghavi P, Chiles K, Mahon PC, Semenza GL. HER2 (neu) signaling increases the rate of hypoxia-inducible factor 1alpha (HIF-1alpha) synthesis: novel mechanism for HIF-1-mediated vascular endothelial growth factor expression. Mol Cell Biol. 2001;21:3995-4004. [PubMed] [DOI] |
| 15. | Tsigkos S, Zhou Z, Kotanidou A, Fulton D, Zakynthinos S, Roussos C, Papapetropoulos A. Regulation of Ang2 release by PTEN/PI3-kinase/Akt in lung microvascular endothelial cells. J Cell Physiol. 2006;207:506-511. [PubMed] [DOI] |
| 16. | Gu J, Tamura M, Yamada KM. Tumor suppressor PTEN inhibits integrin- and growth factor-mediated mitogen-activated protein (MAP) kinase signaling pathways. J Cell Biol. 1998;143:1375-1383. [PubMed] [DOI] |
| 19. | Zolota V, Gerokosta A, Melachrinou M, Kominea A, Aletra C, Scopa CD. Microvessel density, proliferating activity, p53 and bcl-2 expression in in situ ductal carcinoma of the breast. Anticancer Res. 1999;19:3269-3274. [PubMed] |