修回日期: 2009-09-01
接受日期: 2009-09-15
在线出版日期: 2009-10-18
目的: 探讨骨髓基质细胞(BMSCs)在诱癌小鼠模型中向肝细胞分化及癌变的可能性.
方法: ♂BALB/c小鼠BMSCs分离培养及经门静脉移植到♀BALB/c小鼠肝脏. 二乙基亚硝胺诱导肝癌. 6 mo后处死小鼠, 取肝脏标本. 用免疫组织化学检测胎盘型谷胱苷肽转移酶、甲胎蛋白和角蛋白19的表达及用荧光原位杂交(fluorescence in situ hybridisation, FISH)检测Y染色体阳性细胞.
结果: BMSCs在添加肝细胞生长因子的培养基中体外培养能分化为肝细胞样细胞. 诱癌6 mo后26%的小鼠存活并成功诱导肝细胞性肝癌. 免疫组织化学显示肝癌细胞表达胎盘型谷胱苷肽转移酶和甲胎蛋白, 而不表达角蛋白19. FISH结果显示骨髓基质细胞移植及诱癌6 mo后小鼠肝脏内有Y染色体阳性的肝细胞. 而无二乙基亚硝胺诱癌的小鼠, BMSCs移植6 mo后肝脏内未发现Y染色体阳性的肝细胞. 另外, FISH检测未发现Y染色体阳性的肝癌细胞.
结论: 在肝癌的小鼠诱癌模型中, 移植的BMSCs能分化为肝细胞, 但癌变的可能性小.
引文著录: 吴昌雄, 郑进方, 梁力建. 骨髓基质细胞在小鼠肝脏内分化及癌变的潜能. 世界华人消化杂志 2009; 17(29): 2984-2989
Revised: September 1, 2009
Accepted: September 15, 2009
Published online: October 18, 2009
AIM: To evaluate the possibility of differentiation and malignant transformation of bone marrow stromal cells (BMSCs) in a mouse model of chemical hepatocarcinogenesis.
METHODS: BMSCs were harvested from male BALB/c mice, cultured and transplanted into the liver of female syngeneic BALB/c mice via the portal vein. Diethylnitrosamine was administered to mice for six months to induce hepatocarcinogenesis. Six months later, liver samples were taken and used to evaluate the expression of placental form of glutathione-S-transferase, α-fetoprotein and cytokeratin 19 by immunohistochemistry. Y chromosome-positive hepatocytes were detected by fluorescence in situ hybridization (FISH).
RESULTS: BMSCs were shown to differentiate into hepatocyte-like phenotypes after hepatocyte growth factor treatment in vitro. Twenty-six percent of recipient mice survived and developed multiple hepatocellular carcinomas (HCCs). Immunohistochemically, HCCs expressed placental form of glutathione-S-transferase and α-fetoprotein, but did not express cytokeratin 19. Y chromosome-positive hepatocytes were detected by FISH in the liver of mice that were treated with diethylnitrosamine after BMSC transplantation while no such hepatocytes were identified in the liver of mice that were not treated with diethylnitrosamine. No hepatocellular carcinoma cells positive for Y chromosome marker were detected.
CONCLUSION: Transplanted BMSCs can differentiate into hepatocytes but have low malignant potential in the mouse model of chemical hepatocarcinogenesis.
- Citation: Wu CX, Zheng JF, Liang LJ. Possibility of differentiation and malignant transformation of bone marrow stromal cells in the liver of mice. Shijie Huaren Xiaohua Zazhi 2009; 17(29): 2984-2989
- URL: https://www.wjgnet.com/1009-3079/full/v17/i29/2984.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i29.2984
肝癌是一种常见的恶性肿瘤. 目前还不清楚肝癌是否起源于肝干细胞还是成熟肝细胞[1-2]. 有研究提示肝癌可能由肝干细胞恶性转化而来[3]. 骨髓细胞在合适的条件下能分化为肝细胞[4]. 骨髓中哪类细胞能分化为肝细胞目前不清楚, 但骨髓细胞移植能减轻CCl4引起的肝纤维化[5]. 有研究显示骨髓基质细胞(bone marrow stromal cells, BMSCs)在添加肝细胞生长因子的培养基中体外培养能分化为肝细胞样细胞[6]. 由于自身骨髓细胞容易获得, 骨髓细胞将来有望用于治疗慢性肝损害. 但骨髓细胞应用于人类疾病治疗之前需要证实其安全性和有效性. 因此, 本研究用♂BMSCs移植给♀小鼠, 持续诱导肝癌, 探讨BMSCs分化及癌变的潜能.
BALB/c小鼠, 周龄6-8 wk, 体质量20-25 g, 购于中山大学医学动物中心[合格证号: SCYK(粤)2004-0011粤监证字2004A085]. 二乙基亚硝胺购于Sigma公司. 抗甲胎蛋白多克隆抗体购于Santa Cruz公司. 抗白蛋白多克隆抗体购于Dako公司. 抗胎盘型谷胱苷肽转移酶(placental form of glutathione-S-transferase, GST-P)多克隆抗体购于Stressgen公司. 荧光原位杂交(fluorescence in situ hybridisation, FISH)试剂盒及其FITC放大试剂盒购于Cambio公司.
1.2.1 BMSCs的分离与培养: 取♂小鼠的股骨和胫骨, 注射器针头插入骨髓腔内用DMEM培养液冲出骨髓细胞制备成悬液[7]. 细胞悬液用Ficoll(密度1.077 kg/L)梯度离心(1500 r/min)10 min. 收集中间界面的BMSCs, 在DMEM培养基内培养. 培养基另外加入100 mL/L胎牛血清、2 mmol/L谷氨酰胺、100 kU/L青霉素和100 mg/L链霉素. 细胞在37℃、50 mL/L CO2培养箱中进行培养, 每3 d换液1次. 除去悬浮的细胞, 细胞长至90%汇合时进行传代培养, 取培养3-4代的BMSCs做细胞移植实验. 培养基中添加50 µg/L的肝细胞生长因子诱导分化BMSCs, 每3 d换液1次, 21 d后收集做免疫荧光检查. 用免疫荧光鉴定诱导分化细胞甲胎蛋白和白蛋白的表达. 诱导分化的细胞包埋及多聚甲醛固定. 甲醇及Triton X-100分别处理标本, 滴加5% BSA封闭液, 再滴加抗甲胎蛋白多克隆抗体和抗白蛋白多克隆抗体, 4℃孵育过夜. 滴加FITC或PE结合的二抗(Sigma-Aldrich, USA)孵育30 min. 细胞核用DAPI(Sigma-Aldrich, USA)显示为蓝色荧光.
1.2.2 BMSCs的移植: 取分离及培养3-4代的♂BMSCs制备成细胞悬液, 朌胎兰染色计数活细胞>95%. ♀小鼠麻醉后行2/3肝切除, 分离的BMSCs用胰岛素注射器经肠系膜静脉注射到肝脏[8], 每只小鼠移植1×106个细胞.
1.2.3 分组及诱癌: 60只♀小鼠随机分为3组: A: 正常对照组(n = 10), BMSCs移植及饮正常水; B: 模型组(n = 25), 饮水中加二乙基亚硝胺(Sigma-Aldrich, USA)诱导肝癌; C: 实验组(n = 25), BMSCs移植及饮含DEN的水诱癌. 术后小鼠恢复1 wk, 二乙基亚硝胺加入饮用水中, 浓度为100 μg/L, 连续饮用12 wk诱导肝细胞癌(hepatocellular carcinomas, HCC)[1]. 在诱癌6 mo后麻醉后取肝脏, 100 g/L甲醛溶液固定及石蜡包埋. 取肝癌结节及肝右叶做厚5 µm的连续切片行病理学检查.
1.2.4 肝脏病理学检查: 取肝脏标本的连续切片, 分别做HE染色及免疫荧光检测肝癌细胞中GST-P、甲胎蛋白和角蛋白19的表达. 常规处理标本, 滴加5%BSA封闭液, 再滴加抗GST-P多克隆抗体、抗甲胎蛋白多克隆抗体和抗角蛋白19单克隆抗体(Dako, Denmark), 4℃孵育过夜. 滴加FITC或PE结合的二抗(Sigma-Aldrich, USA)孵育30 min. 细胞核用DAPI显示为蓝色荧光.
1.2.5 荧光原位杂交: Y染色体荧光原位杂交显示肝脏内移植的雄性细胞, 按FISH试剂盒(Cambio, Cambridge, UK)的实验步骤操作, 用FITC放大试剂盒(Cambio, Cambridge, UK)放大荧光信号, 细胞核用DAPI显示为蓝色荧光. 切片用LSM 510 META共聚焦显微镜观察.
统计学处理 实验数据以mean±SD表示, 以Student's t检验作统计分析, 以P<0.05为有统计学意义.
本实验在培养基中添加肝细胞生长因子培养BMSCs, 免疫荧光检测甲胎蛋白和白蛋白的表达. 发现加肝细胞生长因子培养的BMSCs培养21 d后细胞表达甲胎蛋白(图1A)和白蛋白(图1B), 而未加肝细胞生长因子培养的BMSCs培养21 d后的细胞无甲胎蛋白和白蛋白表达(图1C-D). 结果提示肝细胞生长因子能诱导BMSCs向肝细胞分化.
6 mo后, 未诱癌的小鼠均存活; 诱癌的小鼠有13只存活, 成活率为26%. 诱癌模型组有6只存活, 诱癌实验组有7只成活, 2组间的存活率无显著差异(χ2 = 3.19, P>0.05).
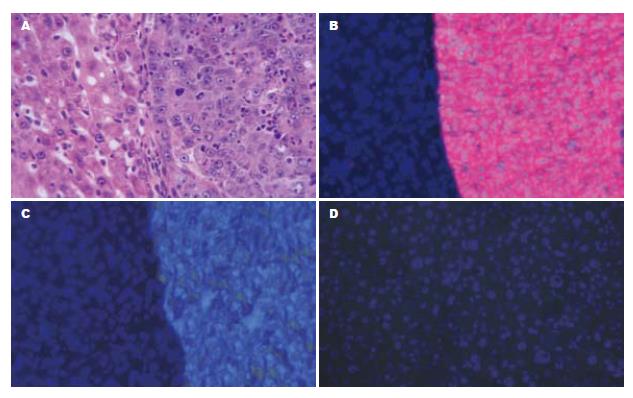
6 mo后, 诱癌成活的小鼠均检出肝癌. 肿瘤在肝脏形成多发灶, 癌结节有5-10个, 直径3-10 mm, 模型组和实验组间的肿瘤大小无显著性差异(4.8±1.5 mm vs 4.4±1.1 mm; t = 1.54, P>0.05). 病理学检查发现13只小鼠的肿瘤均为肝细胞性肝癌, 这些肿瘤表达GST-P和甲胎蛋白, 而不表达角蛋白19(图2).
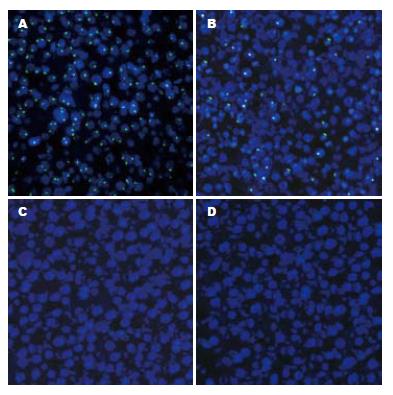
本研究用♂BMSCs移植到♀小鼠肝脏, 研究BMSCs在正常小鼠肝脏及DEN诱导小鼠肝脏内分化及癌变的情况. 用Y染色体荧光原位杂交的方法显示骨髓来源的肝细胞. ♂小鼠肝脏作为阳性对照, 肝细胞核内绿色荧光显示Y染色体(图3A). 结果发现经门静脉移植的BMSCs经二乙基亚硝胺诱导向肝细胞分化及增殖. 骨髓基质细胞移植及二乙基亚硝胺诱导6 mo后小鼠肝脏内有约15%的Y染色体阳性肝细胞(图3B). 而无二乙基亚硝胺诱导的小鼠, BMSCs移植6 mo后肝脏内未发现Y染色体阳性的肝细胞(图3C). 另外, 本研究未发现Y染色体阳性的肝癌细胞(图3D).
肝脏是一类条件性的更新组织. 在正常情况下, 肝细胞有潜在的增殖能力, 而不需要肝干细胞的增殖. 卵圆细胞位于Hering管附近, 构成成体肝脏内潜伏的干细胞[9]. 当存在严重肝损害或合并肝细胞再生受损时, 卵圆细胞将被激活增殖和分化为肝细胞和胆管细胞.
越来越多的证据显示骨髓细胞能分化为特定的细胞类型[10]. 有研究报道在FAH小鼠模型中肝脏内有30%-50%的肝细胞来源于移植的骨髓细胞的分化与增殖[11]. 转化为肝细胞的骨髓细胞可能是间充质细胞[12]. 但有部分研究报道即使存在很强转化的压力下, 骨髓细胞转变为肝细胞仅仅是一种可能性很小的事件[13]. 另外有研究报道骨髓细胞与肝细胞的细胞融合是骨髓转化为肝细胞的主要来源[14]. 主要由髓系单核细胞与肝细胞融合产生功能性的肝细胞增殖[5].
虽然骨髓中的细胞被证实有向肝细胞转化的能力, 但骨髓中何种类型的细胞能分化为肝细胞目前仍不清楚. BMSCs包含多向分化潜能的干细胞, 如分化为神经干细胞和造血干细胞[15]. 本研究证实BMSCs在添加肝细胞生长因子的培养基中培养21 d能分化为表达甲胎蛋白和白蛋白的肝细胞样细胞. BMSCs移植及二乙基亚硝胺持续诱导肝损伤后, 我们用荧光原位杂交的方法发现BMSCs在肝脏内向肝细胞分化, 而无二乙基亚硝胺诱导的肝脏内未发现骨髓来源的肝细胞. 本研究提示在持续肝损伤条件下移植的骨髓细胞在肝脏内分化为肝细胞; 而在正常情况下, 肝脏不需要骨髓细胞向肝细胞的分化和增殖. 另外, FISH显示Y染色体阳性的肝细胞核内未发现2个或更多的Y染色体, 结果提示在本实验中骨髓基质细胞通过横向分化而不是细胞融合转变为肝细胞.
二乙基亚硝胺属于强致癌物亚硝胺类, 能迅速地被代谢为反应性代谢产物, 这些代谢产物与DNA相互作用导致基因改变. GST-P是一种在癌变阶段高表达的蛋白质, 较其他酶类对发现癌变更敏感[16]. 临床上70%的肝癌患者血清甲胎蛋白阳性. 本实验中二乙基亚硝胺诱导肝细胞癌, 表达GST-P和甲胎蛋白, 而胆管细胞癌的标志物角蛋白19不表达.
本实验主要目的是研究肝癌的细胞起源. 肝癌的细胞起源有两种假说: 一种认为由肝内干细胞"成熟受阻(maturation arrest)"异常分化而来, 另一种认为由成熟肝细胞去分化(dedifferentiation)而来. 肝癌的细胞起源一直备受争议[1-2]. 基于以下事实, 作为肝干细胞的卵圆细胞可能与肝癌的起源有关: (1)肝癌的动物诱癌模型中, 肝脏内出现大量的卵圆细胞[17]; (2)致癌剂转化的卵圆细胞种植在新生鼠皮下能形成肝癌[3]; (3)临床上存在肝细胞和胆管细胞的混合性肝癌, 而卵圆细胞有向肝细胞和胆管细胞分化的双潜能特性. 本实验中未发现Y染色体阳性的肝癌细胞. 由于本实验中未标记肝脏内所有的肝干细胞, 因此肝癌的"干细胞"假说不能完全排除. 本实验仅限于移植BMSCs的研究, 结果提示来源于骨髓细胞的肝干细胞的癌变可能性较低. 下一步需要深入研究在其他动物模型和人类中, 骨髓细胞与肝脏再生和癌变的关系.
总之, 体外培养的BMSCs有向肝细胞分化的能力. 在二乙基亚硝胺诱导肝癌的模型中, 移植的BMSCs在肝脏内能分化为肝细胞, 但来源于BMSCs的肝细胞癌变的可能性小. 骨髓基质细胞是一种有希望的治疗慢性肝损害的策略, 在本实验模型中骨髓基质细胞应用是安全的.
骨髓基质细胞在合适的条件下能分化为肝细胞, 但有研究提示肝癌可能由干细胞恶性转化而来, 骨髓基质细胞在诱癌条件下能否分化为肝细胞及癌变的潜能需要研究.
张凤春, 教授, 上海交通大学医学院附属仁济医院肿瘤中心.
骨髓干细胞移植治疗肝脏疾病是目前医学领域研究的热点, 骨髓基质细胞用于治疗慢性肝损害之前需要证实其安全性和有效性.
Jang et al报道在FAH小鼠模型中肝脏内有30%-50%的肝细胞来源于移植的骨髓细胞的分化与增殖. Jiang et al证实转化为肝细胞的骨髓细胞可能是间充质细胞.
本研究证实了诱癌模型中骨髓基质细胞向肝细胞分化及癌变的可能性. 骨髓基质细胞将有望用于治疗慢性肝损害.
本研究探讨了诱癌模型中骨髓基质细胞向肝细胞分化及癌变的可能性, 内容有一定的创新性和潜在的科学价值.
编辑: 李军亮 电编:何基才
| 1. | Bralet MP, Pichard V, Ferry N. Demonstration of direct lineage between hepatocytes and hepatocellular carcinoma in diethylnitrosamine-treated rats. Hepatology. 2002;36:623-630. [PubMed] [DOI] |
| 2. | Lee JS, Heo J, Libbrecht L, Chu IS, Kaposi-Novak P, Calvisi DF, Mikaelyan A, Roberts LR, Demetris AJ, Sun Z. A novel prognostic subtype of human hepatocellular carcinoma derived from hepatic progenitor cells. Nat Med. 2006;12:410-416. [PubMed] [DOI] |
| 3. | Dumble ML, Croager EJ, Yeoh GC, Quail EA. Generation and characterization of p53 null transformed hepatic progenitor cells: oval cells give rise to hepatocellular carcinoma. Carcinogenesis. 2002;23:435-445. [PubMed] [DOI] |
| 4. | Lagasse E, Connors H, Al-Dhalimy M, Reitsma M, Dohse M, Osborne L, Wang X, Finegold M, Weissman IL, Grompe M. Purified hematopoietic stem cells can differentiate into hepatocytes in vivo. Nat Med. 2000;6:1229-1234. [PubMed] [DOI] |
| 5. | Sakaida I, Terai S, Yamamoto N, Aoyama K, Ishikawa T, Nishina H, Okita K. Transplantation of bone marrow cells reduces CCl4-induced liver fibrosis in mice. Hepatology. 2004;40:1304-1311. [PubMed] [DOI] |
| 6. | Wang PP, Wang JH, Yan ZP, Hu MY, Lau GK, Fan ST, Luk JM. Expression of hepatocyte-like phenotypes in bone marrow stromal cells after HGF induction. Biochem Biophys Res Commun. 2004;320:712-716. [PubMed] [DOI] |
| 7. | Luk JM, Wang PP, Lee CK, Wang JH, Fan ST. Hepatic potential of bone marrow stromal cells: development of in vitro co-culture and intra-portal transplantation models. J Immunol Methods. 2005;305:39-47. [PubMed] [DOI] |
| 8. | Kushida T, Inaba M, Hisha H, Ichioka N, Esumi T, Ogawa R, Iida H, Ikehara S. Crucial role of donor-derived stromal cells in successful treatment for intractable autoimmune diseases in mrl/lpr mice by bmt via portal vein. Stem Cells. 2001;19:226-235. [PubMed] [DOI] |
| 9. | Kofman AV, Morgan G, Kirschenbaum A, Osbeck J, Hussain M, Swenson S, Theise ND. Dose- and time-dependent oval cell reaction in acetaminophen-induced murine liver injury. Hepatology. 2005;41:1252-1261. [PubMed] [DOI] |
| 10. | Alison MR, Poulsom R, Jeffery R, Dhillon AP, Quaglia A, Jacob J, Novelli M, Prentice G, Williamson J, Wright NA. Hepatocytes from non-hepatic adult stem cells. Nature. 2000;406:257. [PubMed] [DOI] |
| 11. | Jang YY, Collector MI, Baylin SB, Diehl AM, Sharkis SJ. Hematopoietic stem cells convert into liver cells within days without fusion. Nat Cell Biol. 2004;6:532-539. [PubMed] [DOI] |
| 12. | Jiang Y, Jahagirdar BN, Reinhardt RL, Schwartz RE, Keene CD, Ortiz-Gonzalez XR, Reyes M, Lenvik T, Lund T, Blackstad M. Pluripotency of mesenchymal stem cells derived from adult marrow. Nature. 2002;418:41-49. [PubMed] [DOI] |
| 13. | Kanazawa Y, Verma IM. Little evidence of bone marrow-derived hepatocytes in the replacement of injured liver. Proc Natl Acad Sci U S A. 2003;100 Suppl 1:11850-11853. [PubMed] |
| 14. | Wang X, Willenbring H, Akkari Y, Torimaru Y, Foster M, Al-Dhalimy M, Lagasse E, Finegold M, Olson S, Grompe M. Cell fusion is the principal source of bone-marrow-derived hepatocytes. Nature. 2003;422:897-901. [PubMed] [DOI] |
| 15. | Mangi AA, Noiseux N, Kong D, He H, Rezvani M, Ingwall JS, Dzau VJ. Mesenchymal stem cells modified with Akt prevent remodeling and restore performance of infarcted hearts. Nat Med. 2003;9:1195-1201. [PubMed] [DOI] |
| 16. | Sakata K, Hara A, Hirose Y, Yamada Y, Kuno T, Katayama M, Yoshida K, Zheng Q, Murakami A, Ohigashi H. Dietary supplementation of the citrus antioxidant auraptene inhibits N,N- diethylnitrosamine-induced rat hepatocarcinogenesis. Oncology. 2004;66:244-252. [PubMed] [DOI] |
| 17. | Choudhury S, Zhang R, Frenkel K, Kawamori T, Chung FL, Roy R. Evidence of alterations in base excision repair of oxidative DNA damage during spontaneous hepatocarcinogenesis in Long Evans Cinnamon rats. Cancer Res. 2003;63:7704-7707. [DOI] |