修回日期: 2009-09-13
接受日期: 2009-09-21
在线出版日期: 2009-10-08
目的: 探讨基质金属蛋白酶7(MMP-7)与肝细胞癌(HCC)生物学行为及预后的关系, 试图阐明HCC的发生发展和微转移机制, 并了解其预后.
方法: 应用ElivisionTM plus二步法(AB法)免疫组织化学检测CD34和MMP-7单克隆抗体在63例HCC、10例肝硬化和10例正常肝组织标本的表达, 分析MMP-7表达与HCC临床病理因素之间的关系.
结果: MMP-7在HCC组织中的表达明显高于肝硬化和正常肝组织, 差异有显著性统计学意义(χ2 = 21.19, P<0.05); MMP-7的表达与HCC的大小、病灶数目、浸润、血管癌栓、临床分期和肿瘤血管生成具有相关性(χ2 = 7.1, 14.55, 4.24, 4.49, 7.11, t = 4.30, 均P<0.05).
结论: MMP-7可能在HCC的发生发展过程中起重要作用. MMP-7促进HCC浸润转移和血管生成, 可成为临床判定预后的良好指标.
引文著录: 饶雪峰, 刘伟中, 廖传文, 彭贵祖, 单人锋. MMP-7在肝细胞癌组织中的表达及临床意义. 世界华人消化杂志 2009; 17(28): 2903-2907
Revised: September 13, 2009
Accepted: September 21, 2009
Published online: October 8, 2009
AIM: To investigate the clinical significance of matrix metalloproteinase-7 (MMP-7) expression in hepatocellular carcinoma (HCC) and analyze the correlation of MMP-7 expression with some pathologic parameters in HCC.
METHODS: Sixty-three HCC specimens, 10 hepatic cirrhosis specimens and 10 normal liver tissue specimens were used in the study. Immunohistochemistry was used to detect MMP-7 expression and microvessel density in these specimens. The correlation of MMP-7 expression with some pathologic parameters in HCC was analyzed.
RESULTS: MMP-7 expression level was significantly higher in HCC than in hepatic cirrhosis and normal liver tissue (χ2 = 21.19, P < 0.05). MMP-7 expression was correlated with tumor size and number, vascular cancer embolus, invasion, tumor stage and angiogenesis (χ2 = 7.1, 14.55, 4.24, 4.49 and 7.11, respectively; t = 4.30, all P < 0.05), but was not correlated with serum alpha-fetoprotein, age and sex (all P > 0.05).
CONCLUSION: MMP-7 may play a critical role in the development, progression, metastasis and angiogenesis of HCC. MMP-7 expression can be used as an important prognostic factor for HCC.
- Citation: Rao XF, Liu WZ, Liao CW, Peng GZ, Shan RF. Clinical significance of matrix metalloproteinase-7 expression in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2009; 17(28): 2903-2907
- URL: https://www.wjgnet.com/1009-3079/full/v17/i28/2903.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i28.2903
基质金属蛋白酶7(matrix metalloproteinase 7, MMP-7)属于基质金属蛋白酶基因家10族的成员之一, 其基因定位于11q-22q, DNA长1.6 kb, 编码267个氨基酸[1], 在其家族中相对分子质量最小(28 kDa), 为锌依赖肽链内切酶, 具有消化特定的细胞外基质成分作用; MMP-7分子结构中缺乏与基质金属蛋白酶组织抑制剂(tissue inhibitor of metalloproteinases, TIMPs)相互作用的区域. 因此, MMP-7具有强大的基质降解活性和广泛的底物特异性, 如Ⅳ型胶原、层黏蛋白、纤维结合素、蛋白多糖、Ⅰ型明胶和可溶性弹性蛋白等底物, 而受TIMP的负调节较小. MMP-7在正常细胞或肿瘤细胞都以无活性的酶原(pro-MMP-7)形式存在, 能被多种因素所激活, 如胰蛋白酶, 白细胞弹性蛋白酶和组织蛋白酶; 同时MMPs之间也能通过相互作用调节自身活性, 降解细胞外基质(extracellular matrix, ECM). MMP-7区别于其他MMP家族成员的另一特点是在基质细胞中并不表达, 而仅表达于肿瘤细胞内和肿瘤细胞邻近的血管内皮细胞中. 实体肿瘤是一个典型的血管依赖性疾病, 他的生长和转移等生物行为与其间质的血管形成密切相关. 组织标本微血管计数(microvessel count, MVD)检测是血管形成的量化指标, 是评价肿瘤内血管生成的标准. 近年来, 国内外学者研究[2]发现MVD定量高者易发生转移或复发, 且预后较差. 随着对肿瘤血管生成的深入研究, MVD被作为肿瘤浸润、转移和预后判断的重要参考指标. CD34抗原是近年来人们发现的一种新的与小血管相关的抗原, 他在各种血管源性肿瘤及多种肿瘤间质小血管中的表达已得到证实. 故血管标志物CD34 mAb可被用于标记癌组织血管内皮细胞, 计算MVD[3].
收集2005-01/2007-12江西省人民医院和南昌大学一附医院经病理确诊为HCC的患者63例, 病例具有肿瘤原发病灶组织的蜡块, 手术前未经过放疗、化疗、微波刀等针对肿瘤的任何治疗, 并有手术前后完整的病案资料. 63例患者均有HBV感染; 其中男54例、女9例, 比例6:1; 年龄18-69(平均年龄44.8)岁; AFP≥400组29例, AFP<400组34例; 肿瘤直径>5 cm组32例, 直径≤5 cm组31例(HCC单病灶时取最大直径, 多个病灶时取直径之和); 肿瘤数单个组44例, 肿瘤数多个组19例; 有血管癌栓(门静脉、肝静脉、下腔静脉)组15例, 无血管癌栓组48例; 有远处转移5例(膈肌、壁腹膜、网膜、胃、肺的转移各1例); 采用2001年第八届全国肝癌学术会议制定的分期标准: Ⅰ期22例, Ⅱ期29例, Ⅲ期12例. 鼠抗人MMP-7 mAb(美国NEOMARKERS公司)、CD34抗体和浓缩型DAB试剂盒(福州迈新生物技术有限公司).
1.2.1 分组: 符合以上条件的63例HCC标本作为实验组; 同时取10例肝硬化(来自肝硬化门脉高压手术)和10例正常肝组织(来自肝内胆管结石行肝叶切除的肝组织)作为对照组. 实验组和对照组中每例样本均做MMP-7、CD34的免疫组织化学检测.
1.2.2 免疫组织化学染色ElivisionTM plus二步法(AB法): 采用二步法(AB法)检测MMP-7的表达. 切片脱蜡至水, PBS液(pH7.4)洗3次每次5 min. 0.3% H2O2中室温孵育10 min以阻断内源性过氧化物酶. 先将0.01 mol/L枸橼酸钠缓冲液(pH6.0)于压力锅中加热至沸腾后, 将切片置于高温塑料切片架上, 放入已沸腾的缓冲液中, 盖上锅盖扣上压力阀, 继续加热至喷气, 计时3 min. 室温冷却30 min. 滴加一滴(50 mL)一抗鼠抗人MMP-7Ab, 4℃过夜. 滴加一滴聚合物增强剂(试剂A), 37℃孵育30 min. 滴加一滴酶抗鼠聚合物(试剂B), 室温孵育30 min. 切片浸入修复液经高档微波处理10 min修复抗原. 显色液(终浓度为0.05% DAB, 0.3% H2O2, 用PBS新鲜配制)显色后用苏木精稍稍衬染、脱水、透明、封片等. 上述各步未加说明者, 皆为室温条件. 免疫组织化学检测CD34的表达, 步骤同上(CD34无需抗原修复).
1.2.3 MMP-7阳性结果判定标准: MMP-7表达以细胞质出现棕黄色颗粒、且其着色强度高于背景非特异性染色者判定为阳性, 以每例切片中阳性癌细胞占全部癌细胞的比例计算, 完全阴性或阳性率<5%者为(-), 阳性细胞占5%-35%、36%-65%、66%分别评为1、2、3分, 根据细胞内黄色的深浅将无显色、淡黄色、橘黄色和棕黄色分别评为0、1、2、3分, 以上两者之和最高为6, 0-2视为阴性, 3-6视为阳性[4].
1.2.4 MVD: 按照Weidner et al的判评标准, 计算肿瘤内着色的毛细血管和微小血管. 凡呈现棕色单个内皮细胞或细胞群者均作为一个血管计数, 但肌层较厚及管腔面积大于8个细胞直径的血管不计在内. 计数方法: 每张染色切片先在低倍镜(×100)下全面观察切片以确定肿瘤内血管密度最高处; 再在高倍镜(×400)下计算微血管密度, 以与周围肿瘤细胞和结缔组织成分明显区别的任何一个棕色的内皮细胞或细胞丛作为一个血管计数, 记录5个视野内微血管数, 取其平均数作为MVD值.
统计学处理 统计学分析采用SPSS10.0统计软件进行, 计量资料用t检验, 计数资料用χ2检验, P≤0.05认为有统计学差异.
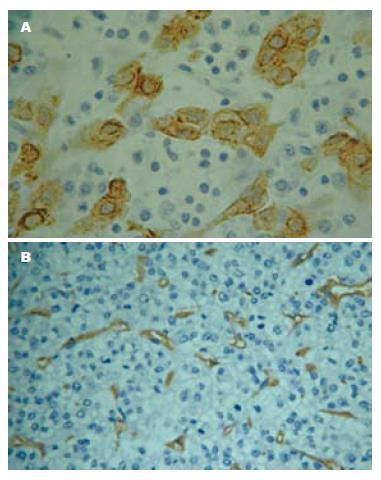
MMP-7在HCC组织中的表达阳性者光学显微镜下观察癌细胞胞质染色呈棕黄色(图1A); 63例HCC组织中MMP-7阳性表达者37例, 阴性表达者26例, 阳性率为58.7%; MMP-7在肝硬化和正常肝组织中均未表达, 阳性率为0.00%. 经χ2检验(χ2 = 21.19, P<0.05) MMP-7在HCC组织中的阳性表达率与肝硬化和正常肝组织中的阳性表达率有显著性差异(P<0.05).
HCC组织中MMP-7的表达与患者性别、年龄和AFP均无明显相关性(P>0.05). MMP-7的表达与肿瘤大小、肿瘤数为单个或多个、血管癌栓、被膜浸润及临床分期具有相关性(P<0.05); 肿瘤直径大于5 cm组MMP-7表达率(75.0%)高于肿瘤直径小于或等于5 cm组(41.9%); 肿瘤数多个组MMP-7表达率(94.7%)高于肿瘤数单个组(43.2%), 有血管癌栓组MMP-7表达率(81.3%)高于无血管癌栓组(51.1%); 有被膜浸润组MMP-7表达率(67.4%)高于无被膜浸润组(40.0%), 差异有显著性意义; MMP-7表达临床分期越晚其表达率越高, Ⅱ、Ⅲ期比Ⅰ期高,Ⅰ期为36.4%, Ⅱ期为69.0%, Ⅲ期为75.0%, 具有显著性差异(表1).
| 临床病理参数 | n | MMP-7(n) | 阳性率(%) | χ2值 | P值 | |
| + | - | |||||
| 性别 | ||||||
| 男 | 54 | 32 | 22 | 59.3 | 0.44 | >0.05 |
| 女 | 9 | 5 | 4 | 55.6 | ||
| 年龄(岁) | ||||||
| >44 | 34 | 20 | 14 | 58.8 | 0.00 | >0.05 |
| ≤44 | 29 | 17 | 12 | 58.6 | ||
| AFP | ||||||
| ≥400 | 29 | 16 | 13 | 55.2 | 0.28 | >0.05 |
| <400 | 34 | 21 | 13 | 61.8 | ||
| 肿瘤大小(cm) | ||||||
| >5 | 32 | 24 | 8 | 75.0 | 7.10 | <0.05 |
| ≤5 | 31 | 13 | 18 | 41.9 | ||
| 肿瘤数目 | ||||||
| 单个 | 44 | 19 | 25 | 43.2 | 14.55 | <0.05 |
| 多个 | 19 | 18 | 1 | 94.7 | ||
| 血管癌栓 | ||||||
| 有 | 16 | 13 | 3 | 81.3 | 4.49 | <0.05 |
| 无 | 47 | 24 | 23 | 51.1 | ||
| 被膜浸润 | ||||||
| 有 | 43 | 29 | 14 | 67.4 | 4.24 | <0.05 |
| 无 | 20 | 8 | 12 | 40.0 | ||
| 分期 | ||||||
| Ⅰ期 | 22 | 8 | 14 | 36.4 | ||
| Ⅱ期 | 29 | 20 | 9 | 69.0 | 7.11 | <0.05 |
| Ⅲ期 | 12 | 9 | 3 | 75.0 | ||
CD34在HCC毛细血管和微小血管染棕黄色(图1B); 肝硬化和正常肝组织中无染色. 63例HCC中MVD范围24.8-68.2, MVD平均值44.73±9.75. MMP-7的表达与MVD具有相关性, MMP-7阳性组MVD值高于阴性组; 63例HCC中, MMP-7阳性组MVD平均值48.63±8.81, MMP-7阴性组MVD平均值39.16±8.29. 差别具有显著性意义(t = 4.30, P<0.05).
MMP-7在肿瘤的发生发展过程起重要作用. Takeuchi et al[5]研究MMP-7 mRNA在散发性和家族性大肠腺瘤中的表达时发现, MMP-7 mRNA在散发性大肠腺瘤中表达水平与腺瘤的增生程度和大小具有相关性, 而在大部分家族性大肠腺瘤性息肉病中, MMP-7 mRNA表达水平与腺瘤的增生程度和大小无相关性. MMP-7表达于具有恶性潜能的腺瘤中, 提示MMP-7可能促进腺瘤向恶性肿瘤转变的过程, 参与大肠癌的发生过程. Crawford et al[6]在鼠模型胰腺癌细胞中发现, MMP-7不但可以裂解FasL抗凋亡, 而且可能诱导抗凋亡蛋白Bcl-2抑制凋亡, 并提出MMP-7可以通过水解蛋白激活潜在的营养因子抑制化生的细胞凋亡.
本研究结果显示: MMP-7在HCC组织中呈过表达, 63例HCC组织中MMP-7阳性表达者37例, 阳性率为58.7%; MMP-7在肝硬化和正常肝组织中均未见阳性表达, 提示MMP-7的过表达可能是HCC发生发展的重要因素, MMP-7分解细胞外基质结构促进肿瘤增生, 这与Rath et al[7]在结肠组织的研究结果一致.
MMP-7不但在肿瘤的发生发展过程起作用, 而且促进肿瘤血管形成和侵犯转移. 早期HCC常被纤维囊包裹, 因而ECM的降解是肿瘤侵犯和转移的重要一步. MMP-7可以水解ECM成分, 破坏机体防御肿瘤浸润与转移的自然屏障, 导致肿瘤细胞自身黏附能力下降, 细胞脱落, 穿过ECM侵犯正常组织, 进入淋巴管或血管, 黏附驻留在内皮细胞的适应部位, 诱导肿瘤血管形成, 最终在远隔部位形成转移灶. 同时, 在内皮细胞中MMP-7表达的蛋白水解松散了血管的结构, 肿瘤细胞更容易浸润血管; 在细胞外基质降解的同时, MMP-7有助于为新的血管生长提供空间. Noë et al[8]发现MMP-7通过裂解细胞表面的上皮细胞钙黏蛋白(E-cadherin), 释放可溶性E-cadherin片段, 这种可溶性E-cadherin片段能够竞争性抑制E-cadherin的作用. 由于E-cadherin在肿瘤的浸润与转移中发挥了重要的抑制作用, 所以MMP-7也间接地促进了肿瘤浸润与转移.
本研究结果显示, 在HCC组织中, 肿瘤直径大于5 cm组MMP-7表达率高于肿瘤直径小于或等于5 cm组, 肿瘤数多个组的MMP-7表达率高于肿瘤数单个组, 有血管癌栓组MMP-7表达率高于无血管癌栓组, 有被膜浸润组的MMP-7表达率高于无被膜浸润组, MMP-7表达临床分期越晚其表达率越高, 表明MMP-7在HCC早期阶段的发生、后期阶段的浸润转移和发展中起关键作用, 可作为判断HCC预后的指标, 这与Ozaki et al[9]和Ishii et al[10]研究结果一致; MMP-7表达和MVD有关, MMP-7阳性组MVD值高于阴性组, 与Huachuan et al[11]在胃癌组织的研究结果一致, 提示MMP-7和HCC的血管形成密切相关, 可能参与肿瘤血管的形成和转移. 本实验显示: HCC组织中MMP-7的表达与患者性别、年龄和AFP均无相关性(P>0.05); MMP-7在HCC组织中表达具有显著性意义, 通过降解ECM, 参与HCC血管形成过程和肿瘤的生长侵袭过程.
总之, MMP-7在HCC组织中的表达明显高于肝硬化和正常肝组织, 提示MMP-7可能在HCC的发生发展过程中起重要作用. MMP-7的表达与HCC的大小、病灶数目、肿瘤被膜浸润、血管癌栓、临床分期和肿瘤血管生成具有正相关性; 因此认为他促进HCC浸润转移和血管生成, 可成为临床判定预后的良好指标.
MMP-7在正常细胞或肿瘤细胞都以无活性的酶原(pro-MMP-7)形式存在, 能被多种因素所激活, 如胰蛋白酶, 白细胞弹性蛋白酶和组织蛋白酶; 同时MMPs之间也能通过相互作用调节自身活性, 降解细胞外基质(ECM). MMP-7区别于其他MMP家族成员的另一特点是在基质细胞中并不表达, 而仅表达于肿瘤细胞内和肿瘤细胞邻近的血管内皮细胞中.
郑鹏远, 教授, 郑州大学第二附属医院消化科
Crawford et al在鼠模型胰腺癌细胞中发现, MMP-7不但可以裂解FasL抗凋亡, 而且可能诱导抗凋亡蛋白Bcl-2抑制凋亡, 并提出MMP-7可以通过水解蛋白激活潜在的营养因子抑制化生的细胞凋亡.
MMP-7促进HCC浸润转移和血管生成, 可成为临床判定预后的良好指标.
本文通过检测基质金属蛋白酶7在肝细胞癌组织中的表达, 对基质金属蛋白酶7与肝细胞癌生物学行为及预后的关系进行探讨研究, 选题准确, 具有一定的临床价值.
编辑: 李军亮 电编:何基才
| 1. | Knox JD, Boreham DR, Walker JA, Morrison DP, Matrisian LM, Nagle RB, Bowden GT. Mapping of the metalloproteinase gene matrilysin (MMP7) to human chromosome 11q21-->q22. Cytogenet Cell Genet. 1996;72:179-182. [PubMed] |
| 5. | Takeuchi N, Ichikawa Y, Ishikawa T, Momiyama N, Hasegawa S, Nagashima Y, Miyazaki K, Koshikawa N, Mitsuhashi M, Shimada H. Matrilysin gene expression in sporadic and familial colorectal adenomas. Mol Carcinog. 1997;19:225-229. [PubMed] |
| 6. | Crawford HC, Scoggins CR, Washington MK, Matrisian LM, Leach SD. Matrix metalloproteinase-7 is expressed by pancreatic cancer precursors and regulates acinar-to-ductal metaplasia in exocrine pancreas. J Clin Invest. 2002;109:1437-1444. [PubMed] |
| 7. | Rath T, Roderfeld M, Graf J, Wagner S, Vehr AK, Dietrich C, Geier A, Roeb E. Enhanced expression of MMP-7 and MMP-13 in inflammatory bowel disease: a precancerous potential? Inflamm Bowel Dis. 2006;12:1025-1035. [PubMed] |
| 8. | Noë V, Fingleton B, Jacobs K, Crawford HC, Vermeulen S, Steelant W, Bruyneel E, Matrisian LM, Mareel M. Release of an invasion promoter E-cadherin fragment by matrilysin and stromelysin-1. J Cell Sci. 2001;114:111-118. [PubMed] |
| 9. | Ozaki I, Yamamoto K, Mizuta T, Setoguchi Y, Morito F, Sakai T. Detection of matrix metalloproteinase gene expression by reverse transcription-polymerase chain reaction in human hepatocellular carcinoma. Int Hepatol Commun. 1996;6:36-42 DOI. |
| 10. | Ishii Y, Nakasato Y, Kobayashi S, Yamazaki Y, Aoki T. A study on angiogenesis-related matrix metalloproteinase networks in primary hepatocellular carcinoma. J Exp Clin Cancer Res. 2003;22:461-470. [PubMed] |
| 11. | Huachuan Z, Xiaohan L, Jinmin S, Qian C, Yan X, Yinchang Z. Expression of matrix metalloproteinase-7 involving in growth, invasion, metastasis and angiogenesis of gastric cancer. Chin Med Sci J. 2003;18:80-86. [PubMed] |