修回日期: 2009-08-14
接受日期: 2009-08-17
在线出版日期: 2009-10-08
目的: 评价血流阻断射频术后残余肿瘤细胞的缺氧诱导因子-1α(HIF-1α)及细胞增殖核抗原(PCNA)的表达.
方法: 兔VX2肝肿瘤接种成功后分为2组: 单独射频组和射频联合入肝血流阻断组(联合射频组). 射频采用冷循环射频消融治疗(参数设定为30 W、8 min); 联合射频组的消融同单独组, 在射频消融同时采用Pringle法射阻断入肝血流. 1 wk后处死动物, 通过免疫组织化学方法检测肿瘤细胞HIF-1α及PCNA的表达.
结果: 射频术后HIF-1α的表达: 单独射频组弱阳性(+)4例, 阳性(++)3例; 联合射频组弱阳性(+)1例, 阳性(++)2例, 强阳性(+++)4例; 联合射频组残余肿瘤细胞HIF-1α的表达水平较单独射频组高, 且差异有统计学意义(P<0.05). 射频术后PCNA的表达: 单独射频组弱阳性(+)3例, 阳性(++)2例, 强阳性(+++)2例; 联合射频组弱阳性(+)2例, 阳性(++)4例, 强阳性(+++)1例; 联合射频组残余肿瘤细胞PCNA的表达与单独射频组之间差异无统计学意义.
结论: 射频联合血流阻断增加射频后残留肿瘤细胞HIF-1α的表达, 其可能影响残余肿瘤细胞的侵袭和转移.
引文著录: 韩建波, 仇毓东, 张炜炜, 陈骏. 入肝血流阻断下射频消融后残余肿瘤细胞HIF-1α及PCNA的表达. 世界华人消化杂志 2009; 17(28): 2887-2891
Revised: August 14, 2009
Accepted: August 17, 2009
Published online: October 8, 2009
AIM: To evaluate the expression of hypoxia-inducible factor-1α (HIF-1α) and proliferating cell nuclear antigen (PCNA) in the residual tumor in rabbits after radiofrequency ablation (RFA) of VX2 liver tumor with hepatic inflow occlusion.
METHODS: A rabbit VX2 liver tumor model was established by implantation of VX2 tumor fragment into the liver. The model rabbits were divided into two groups: rabbits undergoing RFA alone (control group) and those undergoing RFA with hepatic inflow occlusion (experimental group). Radiofrequency lesions were created in vivo using a cool-tip radiofrequency electrode (parameters: burn time, 8 min; power, 30 W). The animals were sacrificed one week later. HIF-1α and PCNA expression in the residual tumor was examined by immunohistochemistry.
RESULTS: The expression of HIF-1α in the residual tumor was weakly and moderately positive in 4 and 3 rabbits in the control group, respectively. In contrast, the number of rabbits showing weakly, moderately and strongly positive HIF-1α expression were 1, 2 and 4 in the experimental group, respectively. The expression intensity of HIF-1α protein in the residual tumor was significantly higher in the experimental group than in the control group (P < 0.05). The expression of PCNA in the residual tumor was weakly, moderately and strongly positive in 3, 2 and 2 rabbits in the control group, while the number of rabbits showing weakly, moderately and strongly positive PCNA expression were 2, 4 and 1 in the experiment group, respectively. No significant difference was noted in the expression intensity of PCNA in the residual tumor between the two groups.
CONCLUSION: HIF-1α expression is upregulated in the residual tumor in rabbits after RFA of VX2 liver tumor with hepatic inflow occlusion, which may have an impact on the invasion and metastasis of residual tumor.
- Citation: Han JB, Qiu YD, Zhang WW, Chen J. Expression of hypoxia-inducible factor-1α and proliferating cell nuclear antigen in the residual tumor in rabbits after radiofrequency ablation of VX2 liver tumor with hepatic inflow occlusion. Shijie Huaren Xiaohua Zazhi 2009; 17(28): 2887-2891
- URL: https://www.wjgnet.com/1009-3079/full/v17/i28/2887.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i28.2887
射频消融是一种局部热疗措施, "热流失效应"影响射频毁损灶的大小, 研究发现, 入肝血流阻断可以减少热流失[1-4], 扩大消融范围, 但是术中将会因为阻断入肝血流而发生"缺血再灌注损伤". van der Bilt et al研究[5]发现, 缺血再灌注后肿瘤周围微环境将会发生失平衡, 对术后残余肿瘤生长和转移有一定的促进作用. 进一步研究发现, 微环境的失平衡与肿瘤周围的缺氧及其缺氧诱导因子-1α(hypoxia-inducible factor-1α, HIF-1α)的表达密切相关. 但是, 以往对于入肝血流阻断下局部消融治疗后残余肿瘤细胞的生物学改变研究较少, 本研究目的是了解入肝血流阻断下进行射频消融后, 残余肿瘤细胞内反应缺血再灌注损伤的HIF-1α及细胞增殖的细胞增殖核抗原(proliferating cell nuclear antigen, PCNA)变化, 初步探讨对血流阻断联合射频术后残余肿瘤复发转移的影响.
新西兰大白兔14只, 雌雄不限, 体质量为2.6-3.2 kg, 由南京大学附属鼓楼医院动物中心提供. 荷瘤VX2种兔由东南大学附属中大医院放射科滕皋军教授惠赠. 冷循环射频治疗仪(Cool-tip RF system)由美国Radionics公司制造. 小鼠抗兔HIF-1α mAb购自美国Abcam公司, 小鼠抗兔PCNA mAb购自武汉博士德生物工程有限公司, PV-6002非生物素二步法免疫组织化学试剂盒购自北京中山金桥生物工程公司.
1.2.1 兔VX2肝肿瘤模型的建立: 氯胺酮与氟哌利多(1:1)静脉麻醉荷瘤种兔, 无菌条件下取出VX2肿瘤, 于超净台剔除瘤周组织、肿瘤包膜和坏死组织, 选取靠近瘤体边缘的质嫩灰白色鱼肉样组织, 用眼科剪剪成约1.5 mm×1.5 mm×1.5 mm大小的瘤块备用. 参照文献[6]中的方法, 略加改进. 6 mL氯胺酮与6 mL氟哌利多加入500 mL生理盐水中静脉滴入维持麻醉, 麻醉成功后取仰卧位固定, 常规上腹部剪毛、备皮及消毒, 经腹白线正中切口进腹, 暴露肝脏左前叶, 轻压腹部将其挤出, 用盐水纱布拉出体外. 将2-3块备用瘤组织塞入16号针头, 后接1 mL注射器, 在距肝脏下缘约1.0-1.5 cm处斜向下插入约1.5 cm. 将瘤组织注入后拔出, 盐水纱布压迫至不再出血后用1号丝线两层关腹. 所有实验动物术前12 h禁食、不禁水. 术后连续3 d后肢肌肉注入青霉素40万单位、硫酸阿米卡星0.1 g预防感染.
1.2.2 分组和操作: 2 wk后种植VX2兔肝脏可形成直径约1.5 cm的单发肿瘤, 模型建立成功后随机分为2组: 单独射频组和射频联合肝脏血流阻断组(联合射频组).
术前准备及麻醉同上, 兔双后肢内侧备皮后贴电极板, 上腹部常规消毒、铺巾, 原切口进腹. 冷盐水纱布将荷瘤肝叶与周围的脏器分开. 射频采用射频针垂直插入肿瘤中心, 射频参数设定为30 W、8 min, 肝脏血流阻断采用Pringle法即绕扎肝十二指肠韧带阻断入肝血流. 确定无活动性出血及周围脏器损伤后关腹. 射频术后腹腔灌洗生理盐水50 mL补充丢失的水分. 术后抗生素应用同上.
1.2.3 HE染色及免疫组织化学检查: 术后1 wk处死动物, 切取荷瘤肝叶置于40 g/L甲醛中固定至少24 h. 将石蜡包埋标本切成5 µm厚的组织片, 常规病理切片行HE染色及免疫组织化学检查. 石蜡切片于梯度二甲苯中脱蜡, 梯度酒精至水; 30 mL/L H2O2去离子水中孵育10 min, 以阻断内源性过氧化物酶; 微波炉内抗原热修复; 滴加适当比例稀释的小鼠抗兔HIF-1α及PCNA mAb 50 µL, 4℃过夜; 滴加山羊抗小鼠IgG抗体-HRP多聚体, 37℃孵育20 min; DAB显色, 显微镜下控制显色时间; 以上步骤均用PBS冲洗3次, 每次2 min. 每张切片在镜下对残余肿瘤组织进行免疫组织化学评分. 高倍镜下观察肿瘤细胞以胞核出现棕色或棕黄色为阳性细胞, 无论其颜色深浅均认为阳性细胞, 无棕色或棕黄色的为阴性细胞. HIF-1α及PCNA的表达根据染色强度和阳性细胞数分为4级: 阴性(-): 无阳性细胞; 弱阳性(+): 细胞轻度着色染成淡黄色, 阳性细胞数<25%; 阳性(++): 细胞着色成黄色, 阳性细胞数25%-50%; 强阳性(+++): 细胞明显着色, 呈棕黄色, 阳性细胞数>50%.
统计学处理 采用SPSS11.5统计学软件进行分析, HIF-1α及PCNA的表达差异采用秩和检验, P<0.05认为具有统计学意义.
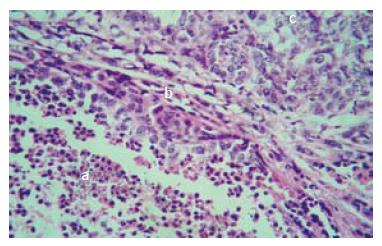
毁损肿瘤细胞与残余肿瘤细胞之间的边缘带内可见大量红染的纤维结缔组织. 残余肿瘤细胞呈癌巢聚集, 细胞形态不规则, 结构完整, 胞质很少, 胞核较大, 呈圆形或椭圆形, 核内可见深染的染色质. 毁损肿瘤细胞基本的细胞结构消失, 胞核浓缩深染, 核内见不到染色质, 胞质模糊一片红染(图1).
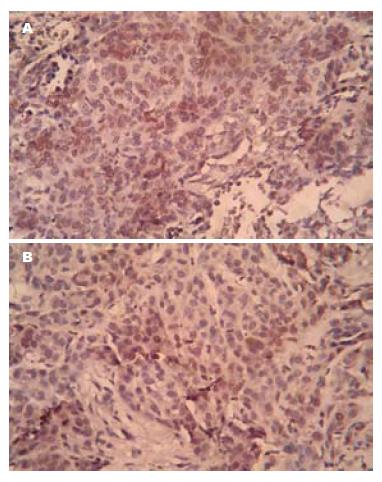
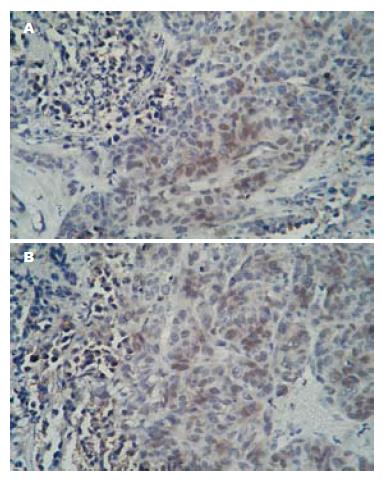
HIF-1α染色阳性细胞为肿瘤细胞核内出现棕色或棕黄色颗粒. HIF-1α主要在肿瘤组织中表达, 其主要位于肿瘤细胞核中(图2). 在残余肿瘤组织中的HIF-1α表达不均匀, 靠近毁损灶周边的肿瘤细胞HIF-1α表达最强. 射频术后HIF-1α的表达: 单独射频组弱阳性(+)4例, 阳性(++)3例; 联合射频组弱阳性(+)1例, 阳性(++)2例, 强阳性(+++)4例; 联合射频组残余肿瘤细胞HIF-1α的表达明显强于单独射频组残余肿瘤细胞, 且两者之间差异有统计学意义(P = 0.025). 残余肿瘤细胞中细胞核有黄色标志物的为PCNA阳性细胞(图3). 射频术后PCNA的表达: 单独射频组弱阳性(+)3例, 阳性(++)2例, 强阳性(+++)2例; 联合射频组弱阳性(+)2例, 阳性(++)4例, 强阳性(+++)1例; 本实验研究发现两治疗组残余肿瘤细胞的增殖活性之间的差异没有统计学意义(P = 0.945, 表1).
| 分组 | HIF-1α表达 | PCNA表达 | ||||||
| - | + | ++ | +++ | - | + | ++ | +++ | |
| 单独射频组 | 0 | 4 | 3 | 0 | 0 | 3 | 2 | 2 |
| 联合射频组 | 0 | 1 | 2 | 4 | 0 | 2 | 4 | 1 |
恶性肿瘤射频的局部复发率为2%-60%[7], 肿瘤大于3-4 cm、血管周围的肿瘤、肿瘤多发是肿瘤复发的危险因素[7-8], 肿瘤的复发被解释为肿瘤的局部消融不完全. 实验证明Pringle联合射频将会增加射频的毁损面积, 减少肿瘤的局部残留, 但是因为残余的肿瘤细胞都被留在体内, Pringle联合射频对于射频后残余肿瘤细胞的生物学影响研究较少. Pringle法是阻断肝十二指肠韧带, 其后将会发生I/R即缺血再灌注, 动物实验表明缺血再灌注是肝脏肿瘤生长和转移的一个重要刺激因素[9]. 同时van der Bilt et al[5]发现缺血再灌注术后的肿瘤生长和转移与长时间的肿瘤周围微循环的失平衡有关, 与肿瘤周围的缺氧及其HIF-1α的表达有关. 我们的研究目的即是血流阻断Pringle联合射频是否改变残余肿瘤的相关因子的变化.
HIF-1α是低氧条件下具有转录活性的一类核转录因子, 对缺氧反应基因的转录和激活发挥关键作用, 进而对缺氧状态下血管生成起核心调控作用, HIF-1α参与肿瘤血管生成以及细胞能量代谢等. 在肿瘤的进展和转移中HIF-1α的表达发挥重要作用. PCNA是一种细胞周期特异性相关蛋白, 相对分子质量为36 kDa, 在调节DNA合成和细胞增殖方向起重要作用. 因此, PCNA作为细胞周期的内源性组织标志物, 是反映细胞增殖活性的指标.
本研究表明, HIF-1α在射频后残余肿瘤组织中的表达不均匀, 靠近毁损灶周边的肿瘤细胞HIF-1α表达最强, 这在文献[10-11]中也是有所报道的. 联合射频后残余肿瘤细胞HIF-1α的表达明显强于单独射频组残余肿瘤细胞, 且两者之间差异有统计学意义(P = 0.025). 因此, 血流阻断后射频将会导致残余肿瘤细胞的HIF-1α高表达, HIF-1α的高表达进而调控VEGF的表达增加, 促进肿瘤微血管生成, 从而使残留肿瘤得以生存并促进肿瘤的侵袭和转移, 而HIF-1α的高表达往往是和肿瘤的高侵袭性相关的.
我们的结论就是如果Pringle联合射频, 肿瘤仍然不能完全被毁损, 残余肿瘤细胞的生物学特性将会发生改变, 这将会导致肿瘤的侵袭和远处转移. 我们的建议是Pringle联合射频消融仅仅用在肿瘤可以完全被毁损, 同时保证一定的安全边缘的情况时. 同时van der Bilt et al[5]发现防止缺血再灌注后引起的微环境失平衡, 防止HIF-1α的高表达, 可以降低肿瘤的复发和转移, 其应用17-DMAG减少局部HIF-1α的表达, 可以减少I/R引起的肿瘤侵袭和转移. 肝癌的综合治疗可以提高射频疗效, 这包括射频治疗和针对HIF-1α的生物学治疗相结合. 针对HIF-1α的靶点逐渐被认为是理想的药物靶点[12-13], 包括近年的索拉非尼等用于晚期肝癌患者的药物, 这是否可以在手术前用, 从而减少缺血再灌注引起的肿瘤生长和转移, 这仍需进一步探索. 因为HIF-1α仍然在一些生理反应中有一定作用, 如果应用针对HIF-1α的相应治疗措施, 可能会影响手术后切口及吻合口的愈合, 进而增加死亡率, 更多的实验需要研究这在手术前后应用的可行性.
射频消融是一种局部热疗措施, "热流失效应"影响射频毁损灶的大小. 入肝血流阻断联合射频可以减少"热流失"效应, 扩大消融范围, 但术中将会因为阻断入肝血流而发生"缺血再灌注损伤".
于颖彦, 教授, 上海交通大学医学院附属瑞金医院器官移植中心病理室
van der Bilt et al研究发现, 缺血再灌注后肿瘤周围微环境将会发生失平衡, 对术后残余肿瘤生长和转移有一定的促进作用, 其可能与HIF-1α的表达密切相关.
本实验从微观评价了血流阻断联合射频治疗这一手术方式对残余肿瘤细胞的影响.
本实验设计较科学, 数据可靠, 方法传统恰当, 文章的科学性、创新性和可读性较好地反映了我国肿瘤病学临床和基础研究的先进水平.
编辑: 李军亮 电编:何基才
| 1. | Rossi S, Garbagnati F, De Francesco I, Accocella F, Leonardi L, Quaretti P, Zangrandi A, Paties C, Lencioni R. Relationship between the shape and size of radiofrequency induced thermal lesions and hepatic vascularization. Tumori. 1999;85:128-132. [PubMed] |
| 2. | Wiersinga WJ, Jansen MC, Straatsburg IH, Davids PH, Klaase JM, Gouma DJ, van Gulik TM. Lesion progression with time and the effect of vascular occlusion following radiofrequency ablation of the liver. Br J Surg. 2003;90:306-312. [PubMed] |
| 3. | Chinn SB, Lee FT Jr, Kennedy GD, Chinn C, Johnson CD, Winter TC 3rd, Warner TF, Mahvi DM. Effect of vascular occlusion on radiofrequency ablation of the liver: results in a porcine model. AJR Am J Roentgenol. 2001;176:789-795. [PubMed] |
| 4. | Chang CK, Hendy MP, Smith JM, Recht MH, Welling RE. Radiofrequency ablation of the porcine liver with complete hepatic vascular occlusion. Ann Surg Oncol. 2002;9:594-598. [PubMed] |
| 5. | van der Bilt JD, Soeters ME, Duyverman AM, Nijkamp MW, Witteveen PO, van Diest PJ, Kranenburg O, Borel Rinkes IH. Perinecrotic hypoxia contributes to ischemia/reperfusion-accelerated outgrowth of colorectal micrometastases. Am J Pathol. 2007;170:1379-1388. [PubMed] |
| 6. | Chen JH, Lin YC, Huang YS, Chen TJ, Lin WY, Han KW. Induction of VX2 carcinoma in rabbit liver: comparison of two inoculation methods. Lab Anim. 2004;38:79-84. [PubMed] |
| 7. | Mulier S, Ni Y, Jamart J, Ruers T, Marchal G, Michel L. Local recurrence after hepatic radiofrequency coagulation: multivariate meta-analysis and review of contributing factors. Ann Surg. 2005;242:158-171. [PubMed] |
| 8. | Bleicher RJ, Allegra DP, Nora DT, Wood TF, Foshag LJ, Bilchik AJ. Radiofrequency ablation in 447 complex unresectable liver tumors: lessons learned. Ann Surg Oncol. 2003;10:52-58. [PubMed] |
| 9. | van der Bilt JD, Kranenburg O, Nijkamp MW, Smakman N, Veenendaal LM, Te Velde EA, Voest EE, van Diest PJ, Borel Rinkes IH. Ischemia/reperfusion accelerates the outgrowth of hepatic micrometastases in a highly standardized murine model. Hepatology. 2005;42:165-175. [PubMed] |
| 10. | Talks KL, Turley H, Gatter KC, Maxwell PH, Pugh CW, Ratcliffe PJ, Harris AL. The expression and distribution of the hypoxia-inducible factors HIF-1alpha and HIF-2alpha in normal human tissues, cancers, and tumor-associated macrophages. Am J Pathol. 2000;157:411-421. [PubMed] |
| 11. | Maxwell PH, Dachs GU, Gleadle JM, Nicholls LG, Harris AL, Stratford IJ, Hankinson O, Pugh CW, Ratcliffe PJ. Hypoxia-inducible factor-1 modulates gene expression in solid tumors and influences both angiogenesis and tumor growth. Proc Natl Acad Sci U S A. 1997;94:8104-8109. [PubMed] |
| 12. | Semenza GL. Development of novel therapeutic strategies that target HIF-1. Expert Opin Ther Targets. 2006;10:267-280. [PubMed] |
| 13. | Melillo G. HIF-1: a target for cancer, ischemia and inflammation--too good to be true? Cell Cycle. 2004;3:154-155. [PubMed] |