修回日期: 2009-08-27
接受日期: 2009-09-07
在线出版日期: 2009-10-08
目的: 探讨痘苗病毒辅助的重组丙型肝炎病毒制备体系中生产细胞的选择.
方法: 将已构建好的质粒pT7HCV及pVHCV分别共转染BHK21, HepG2, SMMC7721细胞株, 4 h后用痘苗病毒感染细胞, 96 h后用RT-PCR检测HCV的RNA表达, 用荧光定量PCR方法检测培养上清中RNA的拷贝数, 并用Western blot检测结构蛋白E2以及非结构蛋白NS5的表达.
结果: RT-PCR检测到各细胞株培养上清中均有HCV的RNA的存在, 定量PCR显示RNA的拷贝数在BHK21, HepG2, SMMC7721细胞中的产量分别为(2.97±0.28)×107, (1.99±0.17)×105, (1.19±0.17)×105(copies/mL). Western blot检测到在这3种生产细胞中均有HCV非结构蛋白NS5的表达.
结论: BHK21, HepG2, SMMC7721细胞株均可生产出重组丙型肝炎病毒颗粒, 且以BHK21为生产细胞株时产量最高.
引文著录: 舒文, 马强, 董慧敏, 林冠峰, 吴英松. 痘苗病毒辅助的重组丙型肝炎病毒生产体系中生产细胞的选择. 世界华人消化杂志 2009; 17(28): 2877-2880
Revised: August 27, 2009
Accepted: September 7, 2009
Published online: October 8, 2009
AIM: To compare the yield of recombinant hepatitis C virus (HCV) in different cell lines.
METHODS: BHK-21, HepG2 and SMMC7721 cells were co-transfected with recombinant plasmid pT7HCV and pVHCV, respectively, followed by infection with vTF7-3 vaccinia viruses. Ninety-six hours later, the presence of HCV RNA in culture supernatants was detected by reverse transcription-polymerase chain reaction (RT-PCR). The titers of HCV were measured by fluorescent quantitative PCR (FQ-PCR). The expression of HCV antigens was detected by Western blot.
RESULTS: HCV RNA was detectable in all culture supernatants. The titers of HCV in BHK-21, HepG2 and SMMC7721 cells were (2.97 ± 0.28) × 107, (1.99 ± 0.17) × 105, (1.19 ± 0.17) × 105 (copies/mL), respectively. The expression of HCV E2, NS3 and NS5 antigens could be detected in all the three cell lines.
CONCLUSION: Recombinant HCV can be produced in BHK-21, HepG2 or SMMC7721 cells. The yield of recombinant HCV is highest in BHK-21 cells.
- Citation: Shu W, Ma Q, Dong HM, Lin GF, Wu YS. Selection of cell lines for production of recombinant hepatitis C virus using the vaccinia virus expression system. Shijie Huaren Xiaohua Zazhi 2009; 17(28): 2877-2880
- URL: https://www.wjgnet.com/1009-3079/full/v17/i28/2877.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i28.2877
HCV感染是慢性肝病和肝癌的主要致病原因之一. 然而, 由于缺乏有效的HCV体外培养体系, 针对HCV的药物研发工作进展受到严重制约, 目前还没有一种可以用于广泛接种预防HCV的特异性药物投入生产. 本实验室目前已经初步建立了以痘苗病毒辅助的重组HCV体外生产的体系, 同时, 为了便利该体系规模化应用, 我们拟尝试性使用该制备体系以多种细胞系为生产细胞体外培养HCV, 为该体系规模化应用提供客观依据.
DMEM, opti-MEM培养基购自Gibco公司; 脂质体LipofectamineTM 2000购自Invitrogen公司; 小牛血清购自Hyclone公司; 胰蛋白酶、无RNA酶的DNA酶、无DNA酶的RNA酶和蛋白酶K均购自Promega公司; DNaseⅠ购自TaKaRa; 抗NS5蛋白的鼠多克隆抗体购自Biodesign公司; HRP-兔抗鼠IgG购自博士德生物技术公司; QIAamp® Viral RNA提取试剂盒自Qiagen公司; HCV核酸扩增(PCR)荧光检测试剂盒购自广州达安试剂公司. AMV Reverse Transcriptase购自Promega公司. RNAsin购自ToYoBo公司. 重组质粒pT7HCV和pVHCV由本室构建; 重组痘苗病毒vTF7-3由冯愈博士惠赠; BHK21, HepG2, SMMC7721细胞由本室保存. GeneAmp PCR system 2400(PE公司), 自动凝胶成像分析仪(英国Syngene公司), DYY-Ⅲ-5型电泳仪, DYCP-31D型电泳槽(北京六一仪器厂); 荧光定量PCR ABI Prism7000; Beckman Coulter OptimaTM L-100XP Ultracentrifuge.
1.2.1 重组HCV的培养: 在六孔板中每空接种5×105个BHK21, HepG2, SMMC7721细胞, 用DMEM10培养基在37℃、50 mL/L CO2培养箱中培养过夜. 第2天按脂质体LipofectamineTM 2000说明书步骤将pT7HCV和pVHCV共转染细胞, 其中pT7HCV含有T7启动子和终止子控制下的HCV的全长cDNA. pVHCV含有痘苗病毒晚起启动子控制下的HCV前体蛋白开放阅读框架序列. 4 h后, 每孔加入100 μL重组痘苗病毒vTF7-3(1012 PFU/L), 此重组痘苗病毒表达T7RNA聚合酶, 直接指导PT7HCV转录HCV RNA, 并且直接指导前体蛋白的表达. 2 h后, 吸去培养上清, 用无血清DMEM洗涤3次, 每孔加入4 mL DMEM2.5, 37℃, 50 mL/L CO2培养箱中培养. 细胞培养96 h后, 收集培养上清, 1000 r/min离心10 min, 分离上清与沉淀, 分别于-20℃冻存并检测.
1.2.2 RT-PCR检测重组HCV基因组RNA: 取细胞培养上清用0.22 μm的滤膜过滤, 取滤过培养上清200 μL, 加入10 U的DNA酶和20 U的RNA酶, 37℃水浴中孵育1 h, 加蛋白酶K至终浓度为100 mg/L, 37℃孵育30 min. 处理后的细胞培养上清用Qiagen病毒RNA提取试剂盒提取HCV基因组RNA, 提取物用RNAFREE的DNase于37℃水浴处理30 min以除去可能的DNA污染. 用HCV 5'-UTR的特异性引物进行PCR鉴定, 以证实质粒DNA是否彻底去除. 将提取的病毒RNA进行逆转录反应, 引物采用随机引物Random Primer 9. 应用HCV 5'-UTR的特异性引物, 将逆转录的cDNA进行PCR反应, 上游引物为5'-GCA CAA ATC CAA AAC CCC AAA GAA AAA-3'(nt 346-372), 下游引物为5'-GAC GAG CGG AAT GTA CCC CAT GAG GTC GGC-3'(nt 761-732). 反应条件: 94℃ 5 min; 94℃ 30 s, 55℃ 30 s, 72℃ 30 s; 35个循环, 72℃延伸10 min.
1.2.3 Western blot检测重组HCV蛋白在细胞中的表达: 培养后的细胞用胰蛋白酶消化后, 用15 mL离心管离心沉淀, 用TBST缓冲液洗涤细胞3次; 每1×106个细胞加入40 μL SDS上样缓冲液, 100℃煮沸10 min裂解细胞, 用39 g/L浓缩胶、120 g/L分离胶进行SDS-PAGE电泳; 将电泳后的SDS-PAGE胶在冷却条件下45 V、2 h转印PVDF膜; 转印后的PVDF膜用含50 g/L脱脂奶粉的TBST缓冲液室温封闭2 h; 封闭后的PVDF膜用TBST缓冲液洗涤3×10 min, 加1:100稀释的抗HCV非结构蛋白NS5多抗以及加1:5000稀释的抗HCV结构蛋白E2多抗作为一抗, 4℃孵育过夜; 然后用TBST洗涤, 加1:5000稀释的HRP-兔抗鼠IgG室温孵育1 h; 然后用TBST洗涤3×10 min, ECL显色.
1.2.4 荧光定量PCR检测细胞培养上清中重组HCV的拷贝数: 收集细胞培养上清, RNA酶处理后取160 μL, 用Qiagen病毒RNA提取试剂盒提取HCV基因组RNA, 提取物用RNAFREE的DNase于37℃水浴处理30 min以除去可能的DNA污染, 使用丙型肝炎病毒荧光定量PCR检测试剂盒, 用HCV 5'-UTR的特异性引物和探针PCR反应, 检测HCV基因组RNA拷贝数.
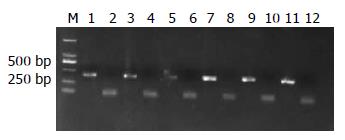
人工构建的质粒PT7 HCV及PV HCV共转染BHK21, HepG2, SMMC7721细胞株, 4 h后用痘苗病毒感染细胞, 96 h后用RT-PCR检测HCV的RNA表达. 培养上清提取RNA前后均用DNase消化, PCR鉴定是否彻底除去质粒DNA的污染. 结果显示: 培养上清用DNase消化前可以检测到质粒DNA的存在, DNase消化后未检测到质粒DNA. 3种细胞培养上清均可以检测到HCV RNA, 而对照组细胞上清中未发现HCV RNA(图1).
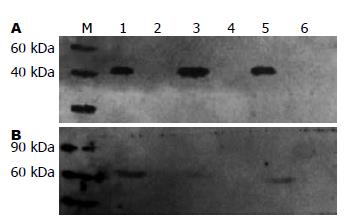
收集病毒培养细胞及上清进行蛋白质印迹鉴定, 由图2可观察到, 收集的病毒培养细胞的E2蛋白呈阳性(只感染痘苗病毒的细胞作为阴性对照), 收集的病毒培养上清的NS5蛋白呈阳性(只感染痘苗病毒的细胞上清作为阴性对照), 表明在收集的培养细胞中存在NS5蛋白, 收集的培养上清中存在E2蛋白.
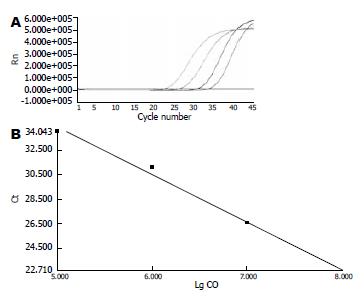
BHK21, HepG2, SMMC7721作为HCV的生产细胞, 各细胞培养上清中HCV的拷贝数分别为(2.97±0.28)×107 copies/mL, (1.99±0.17)×105 copies/mL, (1.19±0.17)×105 copies/mL(图3).
HCV是输血后非甲非乙型肝炎的主要病因, 丙型肝炎呈全球性流行, 是终末期肝病的最主要原因. 目前在HCV分子生物学方面[1-6]的研究已有很大进步, 但体外大规模培养及其感染的机制、复制的方式及疫苗研制[7]等问题尚未完全明确和解决. 首先研究人员建立了复制子体外培养体系[8-12], 但是病毒复制水平不高, 随后构建HCV的嵌合体[13-16], 目前较先进的核酶表达系统[17-18]体系产量仅可以达到1×105 copies/mL. 并且生产细胞颇具局限性, 主要以Huh-7为主, 使得体系产量在很大程度上受到生产细胞的制约. 此外, Huh-7细胞不易培养, 以此系统为基础的生产体系产量欠稳定, 比较耗时[10,17-18]. 以Huh-7.5细胞株为生产细胞时, 体系产量会更高[19], 但仍存在细胞不易培养的问题.
本研究小组已经利用并改造VV/T7[20]瞬时表达系统, 初步建立了痘苗病毒辅助的重组丙型肝炎病毒生产体系[21,23]. 此体系采用BHK21为生产细胞, 然而由于痘苗病毒表达对于宿主细胞选择性较低[22], 为了便利该体系的病毒制备方式, 我们拟尝试性使用多种细胞株作为生产细胞, 探索该体系生产HCV时的产量高低.
目前, 本实验室利用BHK21, HepG2, SMMC7721作为生产细胞, 生产重组丙型肝炎病毒. 对病毒培养上清用DNase和RNase进行处理, 去除破碎细胞中释放的质粒DNA和未被包膜蛋白包装的HCV RNA, 只有当RNA被包膜蛋白包裹才能不被RNA酶降解, 由此可以推断在培养上清中存在HCV颗粒. DNase和RNase处理后培养上清RT-PCR结果为阳性. 荧光定量PCR检测到BHK21, HepG2, SMMC7721上清中HCV的拷贝数分别为(2.97±0.28)×107 copies/mL, (1.99±0.17)×105 copies/mL, (1.19±0.17)×105copies/mL. 本系统在以BHK21为生产细胞时, 所得到的HCV的拷贝数最高, 显示本系统以BHK21为生产细胞最佳, 可能BHK21易于培养和繁殖, 痘苗病毒容易在该细胞中复制.
通过此研究探索, 我们发现使用比较通用的肝癌细胞系时, 该系统均有可能生产出HCV病毒颗粒, 但以BHK21细胞产量最高, 提示该系统制备病毒颗粒对细胞选择性低, 由此为本系统的进一步应用提供客观依据.
丙型肝炎病毒(HCV)体外不易培养, 导致HCV药物研发进展缓慢. 本研究拟通过优化痘苗病毒辅助生产体系达到规模化体外培养HCV病毒颗粒的目的.
谭德明, 教授, 中南大学湘雅医院感染病科
目前该领域的研究热点是如何建立HCV大规模体外培养体系, 为药物的研发以及疫苗的研制提供条件. 目前, 关于HCV感染的机制、复制的方式还存在许多尚未解决的问题.
Heller et al已构建了较先进的HCV核酶表达系统, 该法操作简单, 但生产体系欠稳定, 产量不高.
本研究通过比较BHK21, HepG2, SMMC7721三个生产细胞株, 拟探索生产HCV最适合的细胞株, 本系统同时也为其他RNA病毒的生产提供了一个技术平台.
本研究通过比较几株常用细胞株, 发现在BHK21细胞中, HCV病毒颗粒产量最高, 由此为本系统的进一步应用提供客观依据.
本研究选题新颖, 结果明确, 结论可靠, 具有较好的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Masante C, Mahias K, Lourenço S, Dumas E, Cahour A, Trimoulet P, Fleury H, Astier-Gin T, Ventura M. Seven nucleotide changes characteristic of the hepatitis C virus genotype 3 5' untranslated region: correlation with reduced in vitro replication. J Gen Virol. 2008;89:212-221. [PubMed] |
| 2. | Pfingsten JS, Costantino DA, Kieft JS. Structural basis for ribosome recruitment and manipulation by a viral IRES RNA. Science. 2006;314:1450-1454. [PubMed] |
| 5. | Kieft JS. Viral IRES RNA structures and ribosome interactions. Trends Biochem Sci. 2008;33:274-283. [PubMed] |
| 6. | Diviney S, Tuplin A, Struthers M, Armstrong V, Elliott RM, Simmonds P, Evans DJ. A hepatitis C virus cis-acting replication element forms a long-range RNA-RNA interaction with upstream RNA sequences in NS5B. J Virol. 2008;82:9008-9022. [PubMed] |
| 8. | 刘 艳, 张 贺秋, 凌 世淦, 祁 自柏. 丙型肝炎病毒(HCV)培养模型的研究进展. 细胞与分子免疫学杂志. 2005;21:125-127. |
| 10. | Bartenschlager R. Hepatitis C virus molecular clones: from cDNA to infectious virus particles in cell culture. Curr Opin Microbiol. 2006;9:416-422. [PubMed] |
| 11. | Ali S, Pellerin C, Lamarre D, Kukolj G. Hepatitis C virus subgenomic replicons in the human embryonic kidney 293 cell line. J Virol. 2004;78:491-501. [PubMed] |
| 12. | Pietschmann T, Kaul A, Koutsoudakis G, Shavinskaya A, Kallis S, Steinmann E, Abid K, Negro F, Dreux M, Cosset FL. Construction and characterization of infectious intragenotypic and intergenotypic hepatitis C virus chimeras. Proc Natl Acad Sci U S A. 2006;103:7408-7413. [PubMed] |
| 13. | Scheel TK, Gottwein JM, Jensen TB, Prentoe JC, Hoegh AM, Alter HJ, Eugen-Olsen J, Bukh J. Development of JFH1-based cell culture systems for hepatitis C virus genotype 4a and evidence for cross-genotype neutralization. Proc Natl Acad Sci U S A. 2008;105:997-1002. [PubMed] |
| 14. | King RW, Zecher M, Jeffries MW, Carroll DR, Parisi JM, Pasquinelli C. A cell-based model of HCV-negative-strand RNA replication utilizing a chimeric hepatitis C virus/reporter RNA template. Antivir Chem Chemother. 2002;13:353-362. [PubMed] |
| 15. | Mateu G, Donis RO, Wakita T, Bukh J, Grakoui A. Intragenotypic JFH1 based recombinant hepatitis C virus produces high levels of infectious particles but causes increased cell death. Virology. 2008;376:397-407. [PubMed] |
| 16. | Kato T, Matsumura T, Heller T, Saito S, Sapp RK, Murthy K, Wakita T, Liang TJ. Production of infectious hepatitis C virus of various genotypes in cell cultures. J Virol. 2007;81:4405-4411. [PubMed] |
| 17. | Heller T, Saito S, Auerbach J, Williams T, Moreen TR, Jazwinski A, Cruz B, Jeurkar N, Sapp R, Luo G. An in vitro model of hepatitis C virion production. Proc Natl Acad Sci U S A. 2005;102:2579-2583. [PubMed] |
| 18. | Blight KJ, McKeating JA, Rice CM. Highly permissive cell lines for subgenomic and genomic hepatitis C virus RNA replication. J Virol. 2002;76:13001-13014. [PubMed] |
| 19. | Moss B. Genetically engineered poxviruses for recombinant gene expression, vaccination, and safety. Proc Natl Acad Sci U S A. 1996;93:11341-11348. [PubMed] |
| 20. | Wu YS, Feng Y, Dong WQ, Zhang YM, Li M. A vaccinia replication system for producing recombinant hepatitis C virus. World J Gastroenterol. 2004;10:2670-2674. [PubMed] |