修回日期: 2009-08-30
接受日期: 2009-09-07
在线出版日期: 2009-09-28
目的: 探讨Hep Par 1、CD34及Cytokeratin在血清[AFP(-)HCC]诊断及其在ICC、MAC鉴别诊断中的意义.
方法: 选取南通市肿瘤医院1989-2007年手术切除的70例[AFP(-)HCC]、6例ICC及24例MAC的石蜡标本, 免疫组织化学染色法检测Hep Par 1、CD34及Cytokeratin在血清[AFP(-)HCC]中的表达.
结果: Hep Par 1、CD34在血清AFP(-)HCC、ICC及MAC中的表达差异性均具有显著统计学意义(Hep Par 1: χ2 = 50.7937、9.5745及37.4532; CD34: χ2 = 67.0330、9.9836及49.3927, 均P<0.01). 在分化不良组与分化较好组血清AFP(-)HCC中表达差异性的比较中, Hep Par 1与CD34、CK20、CK19的表达均有统计学意义(P<0.01或0.05). 联合应用Hep Par 1、CD34对AFP(-)HCC与ICC、MAC的鉴别诊断评价准确度、灵敏度及特异度分别为: 90.7%、89.8%及93.3%.
结论: 联合应用Hep Par 1、CD34及Cytokeratin可提高血清AFP(-)HCC的诊断准确率及其与ICC、MAC的鉴别诊断准确率, 为临床治疗方案的选择与预测评估提供了病理依据.
引文著录: 张婷, 陈旭东, 何松, 王旗春. Hep Par 1、CD34及Cytokeratin在血清AFP阴性肝细胞癌诊断中的应用. 世界华人消化杂志 2009; 17(27): 2791-2797
Revised: August 30, 2009
Accepted: September 7, 2009
Published online: September 28, 2009
AIM: To investigate the significance of hepatocyte paraffin-1 (Hep Par-1), cluster of differentiation 34 (CD34) and cytokeratin (CK) expression in the diagnosis of alpha-fetoprotein-negative hepatocellular carcinoma (AFP(-)HCC) and in the differential diagnosis among AFP(-) HCC, intrahepatic cholangiocellular carcinoma (ICC) and metastatic adenocarcinoma (MAC).
METHODS: Paraffin-embedded surgical specimens were collected from 70 AFP(-)HCC patients, 6 ICC patients and 24 MAC patients at Nantong Tumor Hospital from 1989 to 2007. All specimens were stained immunohistochemically for Hep Par 1, CD34 and CK.
RESULTS: There were statistically significant differences in the positive expression rates of Hep Par 1 and CD34 in AFP(-)HCC, ICC and MAC (Hep Par 1: χ2 = 50.7937, 9.5745 and 37.4532, respectively; CD34: χ2 = 67.0330, 9.9836 and 49.3927, respectively; all P < 0.01). Significant differences were also noted in the positive expression rates of Hep Par 1, CD34, CK20 and CK19 between poorly and well differentiated AFP(-)HCC (all P < 0.01 or 0.05). The accuracy, sensitivity and specificity of combined immunohistochemical detection of Hep Par 1, CD34 and CK in the differential diagnosis among AFP(-) HCC, ICC and MAC were 90.7%, 89.8% and 93.3%, respectively.
CONCLUSION: Combined detection of Hep Par 1, CD34 and CK can improve the accuracy of diagnosis of AFP(-)HCC and of differential diagnosis among AFP(-)HCC, ICC and MAC.
- Citation: Zhang T, Chen XD, He S, Wang QC. Significance of hepatocyte paraffin-1, cluster of differentiation 34 and cytokeratin expression in the diagnosis of alpha-fetoprotein-negative hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2009; 17(27): 2791-2797
- URL: https://www.wjgnet.com/1009-3079/full/v17/i27/2791.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i27.2791
当肝细胞肝癌(hepatocellular carcinoma, HCC)血清AFP呈阴性(以AFP<10 μg/L为AFP(-)HCC)或病理类型不确定(如低分化或透明细胞型HCC)时, HCC的诊断及其与肝内胆管细胞癌(intrahepatic cholangiocellular carcinoma, ICC)、肝转移性腺癌(metastatic adenocarcinoma, MAC)等的鉴别诊断就成为外科病理诊断中的难题.
Hep Par 1是目前肝细胞分化标志物中较敏感和特异的标志物, 在HCC中呈胞质颗粒染色[1]. 但Hep Par 1在低分化HCC中表达率不高, 而低分化HCC更易与低分化ICC、MAC混淆. CD34在HCC中呈微血管均匀染色, 而在ICC和MAC中呈微血管不均染色[2]. Cytokeratin(CK)家族的CK7、CK19是ICC与HCC鉴别诊断的标志物[3-4].
本研究通过联合应用Hep Par 1、CD34及CK家族, 探讨这3类免疫组织化学标记在AFP(-)HCC及ICC、MAC鉴别诊断中的意义, 为AFP(-)HCC及ICC、MAC的临床治疗方案的选择和预测评估提供病理依据.
选取南通市肿瘤医院1989-2007年手术切除的70例AFP(-)HCC、6例ICC及24例MAC(分别来源于6例肺腺癌、6例肾透明细胞癌、6例胃腺癌、6例卵巢透明细胞癌)的石蜡标本, 每例切4 μm切片, 分别作HE染色及免疫组织化学标记, 重新阅片观察.
1.2.1 HE染色: 石蜡组织连续切片, 常规HE染色、封片. 结果判断: 根据病理分化分级(Edmondson-Steiner分级), 分为Ⅰ、Ⅱ、Ⅲ及Ⅳ级. 将I、Ⅱ级作为分化较好组, 将Ⅲ、Ⅳ级作为分化不良组. AFP(-)HCC镜下组织学形态显示瘤细胞胞质有大量糖原或脂质积蓄呈透明状, 则诊断为AFP(-)HCC透明细胞亚型.
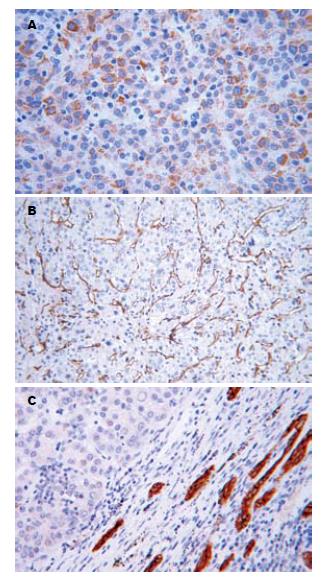
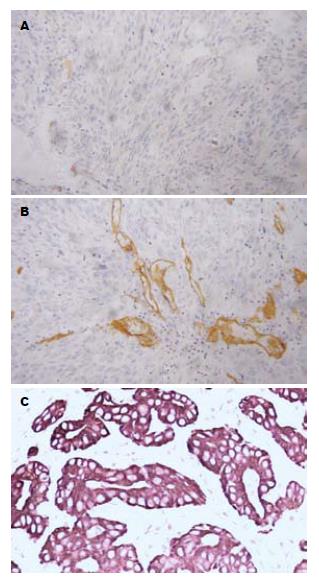
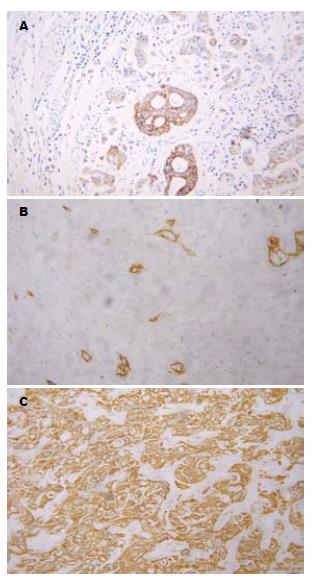
1.2.2 免疫组织化学染色: 免疫组织化学染色采用SP法. 实验操作按试剂盒说明进行, DAB显色, 以PBS代替第一抗作阴性对照, 用已知阳性切片作阳性对照. 即用型鼠单克隆抗体Hep Par 1、即用型鼠抗CD34 mAb、即用型兔抗人CK20 mAb、即用型兔抗人CK19多克隆抗体、即用型鼠抗人mAb CK7、SP即用型试剂盒和DAB显色试剂盒均由北京中杉金桥生物技术有限公司提供. 免疫组织化学结果判断: Hep Par 1在HCC中呈胞质均匀棕黄色颗粒染色; CD34在HCC中呈微血管长条状或分支状染色, 管壁纤细、管腔狭窄、分布均匀弥漫(如呈血管不均匀染色则判断为阴性); CK7、CK19、CK20呈胞质均匀棕黄色颗粒染色. 染色结果观察采用双盲法, 由两位病理科医生在不知病理分级与临床资料的情况下阅片, 每个切片观察5个视野(400倍)计算阳性细胞数, 计算总细胞数不少于1000个, 按阳性细胞所占百分数分为: 阳性细胞率<5%为阴性(-), >5%为阳性(+).
统计学处理 应用Stata 10.0统计软件对计数资料进行四格表χ2检验. 统计结果以P<0.05为有统计学差异, P<0.01为有显著统计学差异. 以准确度、灵敏度、特异度、阳性预测值、阴性预测值、Youden指数作为诊断价值的评价指标.
Hep Par 1呈胞质颗粒状染色(表达率82.9%); CD34呈血管均匀染色(表达率87.1%); CK家族多呈阴性(CK7、CK20、CK19的表达率分别为31.4%、10.0%和20.0%(表1-2, 图1).
| AFP(-)HCC | ICC | MAC | ||||
| 肾透明细胞癌 | 卵巢透明细胞癌 | 胃腺癌 | 肺腺癌 | |||
| Hep Par 1 | 胞质 | - | - | - | 膜浆+/- | 膜浆+/- |
| CD34 | 血管均匀 | - | - | - | - | - |
| CK7 | +/- | 胞质 | +/- | 胞质 | 胞质 | 胞质 |
| CK20 | +/- | +/- | 胞质 | - | - | - |
| CK19 | +/- | 胞质 | 胞质 | - | 胞质 | 胞质 |
| AFP(-)HCC (n = 70) | ICC (n = 6) | MAC (n = 2400) | ||||||||||
| +(%) | - | χ2值 | P值 | +(%) | - | χ2值 | P值 | +(%) | - | χ2值 | P值 | |
| Hep Par 1 | 58(82.9) | 12 | 50.7937 | <0.01 | 0(0) | 6 | 9.5745 | <0.01 | 2(8.3) | 22 | 37.4532 | <0.01 |
| CD34 | 61(87.1) | 9 | 67.0330 | <0.01 | 0(0) | 6 | 9.9836 | <0.01 | 0(0) | 24 | 49.3927 | <0.01 |
| CK7 | 22(31.4) | 48 | 19.9448 | <0.01 | 5(83.3) | 1 | 3.5815 | >0.05 | 19(79.2) | 5 | 13.9846 | <0.01 |
| CK20 | 7(10.0) | 63 | 0.2383 | >0.05 | 2(33.3) | 4 | 3.2520 | >0.05 | 2(8.3) | 22 | 0.2294 | >0.05 |
| CK19 | 14(20.0) | 56 | 28.9289 | <0.01 | 5(83.3) | 1 | 5.8785 | <0.05 | 18(75.0) | 6 | 19.5624 | <0.01 |
分化不良组与分化较好组比较, Hep Par 1的表达率显著降低(P<0.01), CD34的表达率有所降低(P<0.05); 而CK19、CK20的表达率有所升高(P<0.05, 表3).
| 分化较好组 | 分化不良组 | χ2值 | P值 | |||||||||||
| Ⅰ(n = 9) | Ⅱ(n = 44) | Ⅰ、Ⅱ(n = 53) | Ⅲ(n = 11) | Ⅳ(n = 6) | Ⅲ、Ⅳ(n = 17) | |||||||||
| +(%) | - | +(%) | - | +(%) | - | +(%) | - | +(%) | - | +(%) | - | |||
| Hep Par 1 | 9(100) | 0 | 39(88.6) | 5 | 48(90.6) | 5 | 8(72.7) | 3 | 2(33.3) | 4 | 10(58.8) | 7 | 9.1305 | <0.01 |
| CD34 | 9(100) | 0 | 40(90.9) | 4 | 49(92.5) | 4 | 7(63.6) | 4 | 5(83.3) | 1 | 12(70.6) | 5 | 5.4920 | <0.05 |
| CK7 | 2(22.2) | 7 | 15(34.1) | 29 | 17(32.1) | 36 | 3(27.3) | 8 | 2(33.3) | 4 | 5(29.4) | 12 | 0.0424 | >0.05 |
| CK20 | 1(11.1) | 8 | 2(4.5) | 42 | 3(5.7) | 50 | 2(18.2) | 9 | 2(33.3) | 4 | 4(23.5) | 13 | 4.5665 | <0.05 |
| CK19 | 1(11.1) | 8 | 6(13.6) | 38 | 7(13.2) | 46 | 4(36.4) | 7 | 3(50.0) | 3 | 7(41.2) | 10 | 6.2930 | <0.05 |
Hep Par 1、CD34在AFP(-)HCC透明细胞亚型中的表达率均较高(分别为87.0%和78.3%), 而CK家族表达率均较低(CK7、CK20及CK19分别为26.1%、4.4%和21.7%).
Hep Par 1呈阴性; CD34部分呈血管不均染色; CK19、CK7呈胞质均匀棕黄色颗粒染色, CK20有部分表达(表1-2, 图2).
Hep Par 1在部分胃腺癌、肺腺癌中呈膜浆颗粒状染色. CK7、CK19在胃腺癌、肺腺癌中呈胞质颗粒状染色. CK19、CK20在肾透明细胞癌中呈胞质颗粒状染色. CD34在MAC中均呈血管不均染色(表1-2, 图3).
此外, Hep Par 1、CD34在AFP(-)HCC透明细胞亚型与肾透明细胞癌、卵巢透明细胞癌的表达具有显著性差异(P<0.01, χ2值分别为19.1020, 16.3429).
联合应用Hep Par 1与CD34对AFP(-)HCC与ICC、MAC的灵敏度比单独使用单一标志物有所增高(表4).
| 标志物 | 准确度 | 灵敏度 | 特异度 | 阳性预测值 | 阴性预测值 | Youden指数 |
| Hep Par 1 | 86.0(86/100) | 82.9(58/70) | 93.3(28/30) | 96.7(58/60) | 70.0(28/40) | 76.2 |
| CD34 | 91.0(91/100) | 87.1(61/70) | 100.0(30/30) | 100.0(61/61) | 76.9(30/39) | 87.1 |
| Hep Par 1+CD34 | 90.7(107/118) | 89.8(79/88) | 93.3(28/30) | 97.5(79/81) | 75.7(28/37) | 83.1 |
AFP是临床上诊断原发性HCC最常用的肿瘤标志物之一, 在肝癌普查、早期诊断和疗效判定等方面发挥着重要作用. 通过血清AFP检测HCC的诊断率约为70%, 但是仍有30%左右的HCC血清AFP为阴性[5]. 有研究发现AFP检测HCC的敏感性较低(70%左右), 特异性也较低(64%)[6], 因此单独应用AFP诊断HCC容易造成漏诊和误诊. 因此, 寻找阳性率高、特异性强的肝癌标志物是当前肝癌研究的重要课题.
Hep Par 1是1993年由美国Pittsburgh大学Wennerbery et al以石蜡包埋肝组织作为抗原而获得的一种单克隆抗体OCH1E5.2.10[7]. 文献[1]报道Hep Par 1对HCC特异性和敏感性比以往的抗体都高(Hep Par 1对HCC的敏感性为75%-99%), 被认为是HCC器官特异性抗体. Chu et al[8]报道Hep Par 1在HCC中的表达率为92%. 另有报道Hep Par 1免疫组织化学标记在HCC患者的骨髓中也有所表达[9]. 丛文铭 et al[10]报道Hep Par 1对HCC的敏感性为83.7%、特异性为96.7%, Hep Par 1除了在HCC中表达外, 还在50%的胃腺癌、胃和胆囊的肝样腺癌、内胚窦及肝母细胞瘤局灶性表达; 在结肠、肺、子宫颈、卵巢、胰腺和膀胱腺癌也可局灶表达, 而在肾透明细胞癌、乳腺癌、黑色素瘤和间皮瘤不表达. 我们的研究发现, Hep Par 1在部分胃腺癌、肺腺癌中也有表达, 表明Hep Par 1对于HCC的诊断并无绝对特异性. 这为Hep Par 1应用于HCC诊断带来了一定困难.
有研究发现Hep Par 1对于良恶性肝肿瘤是比较敏感和特异的指标, 在ICC中几乎不表达[8,11]. 但后来又有研究发现在某个患有HCC的特殊类型纤维板层癌与ICC的患者, 其HCC与ICC的成分都有Hep Par 1的表达[12]. 虽然Hep Par 1是鉴别HCC、ICC及MAC较好的指标, 但不是所有的Hep Par 1阳性的就是HCC或起源于肝细胞的肿瘤[8,13-16]. 所以单独的Hep Par 1的诊断显得非常单薄, 在本研究中我们对于HCC的诊断以及与ICC及MAC的鉴别诊断联合了其他的标记.
Hep Par 1的染色模式在分化较好的HCC和分化较差的HCC中差别很大, 在分化较好的HCC中可达到100%的肿瘤细胞染色, 而在部分分化较差的HCC中只有<5%的肿瘤细胞染色, 这一结果很容易引起假阴性[17], 在我们的研究中也有此发现.
CD34是血管源性肿瘤的特异性标志物之一, 属于HCC相对特异性抗体. 据报道CD34在HCC微血管中阳性表达, 呈特殊的长条状或分支状、管壁纤细、管腔狭窄、分布均匀弥漫, 而在ICC和MAC微血管中分布不均, 呈干枝状、稀疏杂乱[11,18]. 我们研究发现CD34这种特殊表达方式对于HCC的诊断具有一定的作用.
CK家族属于ICC及MAC相对特异性抗体, 有报道CK7、CK19是ICC与HCC鉴别诊断的标志物[3-4]. 我们研究发现CK在HCC中多呈阴性, 在部分ICC及MAC中有所表达, 这在HCC的鉴别诊断中发挥了重要的作用.
近年来国内外研究发现, 联合使用多种HCC敏感性、特异性强的多种标志物可显著增加HCC诊断与鉴别诊断正确率. 丛文铭 et al[10]报道了HCC免疫组织化学谱, 一线抗体由Hep Par 1和CD34组成, 二线抗体由pCEA和AFP组成; ICC的一线抗体为CK19, 二线抗体为CA19-9. 由3种一线抗体组合成肝癌的核心免疫组织化学谱, 酌情使用二线抗体, 可以较好地解决对HCC、ICC和MAC之间的免疫病理诊断和鉴别诊断.
本研究通过探讨Hep Par 1、CD34及CK免疫组织化学标记分别在AFP(-)HCC、ICC与MAC中的表达, 表明联合应用这些标记可提高AFP(-)HCC的诊断准确率及其与ICC、MAC的鉴别诊断准确率, 为临床治疗方案的选择和预测评估提供了病理依据.
同时联合应用Hep Par 1、CD34及CK免疫组织化学标记检测不同病理分化分级AFP(-)HCC, 为不同病理分化分级AFP(-)HCC选择最佳免疫组织化学标记组合. 我们的研究发现, AFP(-)HCC中Hep Par 1、CD34的表达率随着肿瘤分化程度降低而减低; 而CK19、CK20的表达率随着肿瘤分化程度的降低而升高, 提示联合应用这些标记可作为诊断AFP(-)HCC并确定其分化程度的一种重要手段.
在以往对于HCC鉴别诊断的研究中, ICC、MAC作为对照组多为随机选择的癌组织, 大多数根据HE形态即可明确ICC、MAC的诊断. 本研究特别选择了较易与HCC混淆的低分化ICC、低分化肺腺癌及胃腺癌、低分化肾及卵巢透明细胞癌等肝MAC作为对照组. 我们的研究发现, Hep Par 1在AFP(-)HCC中呈胞质颗粒状染色, 在部分MAC中(胃腺癌、肺腺癌)呈膜浆颗粒状染色, 在ICC、肾透明细胞癌、卵巢透明细胞癌中呈阴性; CD34在AFP(-)HCC中呈血管均匀染色, 在ICC、MAC中均呈血管不均染色; CK家族在AFP(-)HCC中多呈阴性, 在部分ICC及MAC中呈胞质颗粒状染色. 我们还发现, Hep Par 1、CD34在AFP(-)HCC透明细胞亚型与肾透明细胞癌、卵巢透明细胞癌的表达具有显著性差异(P<0.01), 这对于AFP(-)HCC透明细胞亚型与其他透明细胞肿瘤的鉴别具有重要的实用价值.
有研究发现, Hep Par 1、CD34的联合使用不仅可以鉴别HCC与ICC、MAC, 有时候Hep Par 1、CD34可以用于鉴别HCC与肝腺瘤样肿瘤[19].
我们的研究发现, 联合应用Hep Par 1与CD34对AFP(-)HCC与ICC、MAC的灵敏度比单独使用单一标志物有所增高. 而CK家族的加入使得ICC及MAC的诊断更具准确性.
除了联合应用各种免疫组织化学标记, 我们还需不断发现更多有价值的标志物开展进一步的研究. 近年来研究发现的某些标志物进一步提高了HCC的诊断正确率, 如Raf-1在早期肝癌中的高表达, 使其具备了良好的早期诊断能力[20], Aurora-B的检测可以作为肝癌的初步筛选指标[21].
血清甲胎蛋白(AFP)目前是诊断原发性肝细胞癌的首选血清标志物. 但近年来发现血清AFP阴性肝癌有增多趋势, 尚有其他肿瘤可出现血清AFP升高, 进一步增加了血清AFP阴性肝癌的漏诊率和误诊率. 选取HCC和ICC一线抗体并优化组合成诊断谱有助于提高血清AFP阴性肝癌诊断与鉴别诊断的正确率.
肖恩华, 教授, 中南大学湘雅二医院放射教研室.
HCC的早期诊断近年来成为临床医学研究热点之一. 联合应用特异性、敏感性及准确性更强的HCC血清学指标(如DcR3、leptin、VEGF等与AFP联用)、免疫组织化学诊断谱(Hep Par 1、CD34、CK家族、Raf-1等联用)及基因家族蛋白标志物(Aurora-B、survivin、RASSF1A、CYP3A5、Plk1等)等多种诊断技术已引起肿瘤学界的高度重视.
丛文明 et al发现HCC的一线抗体由Hep Par 1和CD34组成, 二线抗体由pCEA和AFP组成; ICC的一线抗体为CK19, 二线抗体为CA19-9. 由3种一线抗体组合成肝癌的核心免疫组织化学谱, 酌情使用二线抗体, 可以较好地对HCC、ICC和肝MAC进行鉴别诊断. 而此诊断谱在血清AFP阴性HCC诊断及鉴别诊断中的作用则需要进一步研究.
本研究首次将免疫组织化学诊断谱用于血清AFP阴性HCC的诊断及其与ICC、肝MAC的鉴别诊断; 并发现此诊断谱有助于评估HCC分化程度.
本研究选取HCC和ICC一线抗体组合成诊断谱, 综合比较了Hep Par 1、CD34及CK家族对血清AFP阴性HCC与ICC、肝MAC鉴别诊断的准确度、灵敏度、特异度、阳性预测值、阴性预测值、Youden指数; 选择了较易与肝细胞癌混淆的低分化ICC、低分化肝MAC作为对照组, 具有较大的鉴别诊断实用价值.
本文研究血清AFP呈阴性是HCC的阳性率高、特异性强的标志物, 对临床诊断有一定的意义.
编辑: 李军亮 电编:吴鹏朕
| 1. | Amarapurkar AD, Rege JD, Joshi AS, Vaiphei K, Amarapurkar DN. Utilization of antihepatocyte clone OCH1E5 (Hep Par 1) in histological evaluation of liver tumors. Indian J Pathol Microbiol. 2006;49:341-344. [PubMed] |
| 3. | Srisomsap C, Sawangareetrakul P, Subhasitanont P, Panichakul T, Keeratichamroen S, Lirdprapamongkol K, Chokchaichamnankit D, Sirisinha S, Svasti J. Proteomic analysis of cholangiocarcinoma cell line. Proteomics. 2004;4:1135-1144. [PubMed] [DOI] |
| 4. | Uenishi T, Kubo S, Yamamoto T, Shuto T, Ogawa M, Tanaka H, Tanaka S, Kaneda K, Hirohashi K. Cytokeratin 19 expression in hepatocellular carcinoma predicts early postoperative recurrence. Cancer Sci. 2003;94:851-857. [PubMed] [DOI] |
| 5. | Wudel LJ Jr, Chapman WC. Indications and limitations of liver transplantation for hepatocellular carcinoma. Surg Oncol Clin N Am. 2003;12:77-90, ix. [PubMed] [DOI] |
| 6. | Soresi M, Magliarisi C, Campagna P, Leto G, Bonfissuto G, Riili A, Carroccio A, Sesti R, Tripi S, Montalto G. Usefulness of alpha-fetoprotein in the diagnosis of hepatocellular carcinoma. Anticancer Res. 2003;23:1747-1753. [PubMed] [DOI] |
| 7. | Wennerberg AE, Nalesnik MA, Coleman WB. Hepatocyte paraffin 1: a monoclonal antibody that reacts with hepatocytes and can be used for differential diagnosis of hepatic tumors. Am J Pathol. 1993;143:1050-1054. [PubMed] |
| 8. | Chu PG, Ishizawa S, Wu E, Weiss LM. Hepatocyte antigen as a marker of hepatocellular carcinoma: an immunohistochemical comparison to carcinoembryonic antigen, CD10, and alpha-fetoprotein. Am J Surg Pathol. 2002;26:978-988. [PubMed] [DOI] |
| 9. | Sutcliffe R, Maguire D, Murphy P, Portmann B, Rela M, O'Sullivan G, Mufti G, Heaton N. Detection and clinical significance of bone marrow micrometastases in patients undergoing liver transplantation for hepatocellular carcinoma. Transplantation. 2005;80:88-94. [PubMed] [DOI] |
| 11. | Lau SK, Prakash S, Geller SA, Alsabeh R. Comparative immunohistochemical profile of hepatocellular carcinoma, cholangiocarcinoma, and metastatic adenocarcinoma. Hum Pathol. 2002;33:1175-1181. [PubMed] [DOI] |
| 12. | Tanaka K, Honna T, Kitano Y, Kuroda T, Tanaka K, Morikawa N, Matsuda H, Kawashima N, Matsuoka K, Miyauchi J. Combined fibrolamellar carcinoma and cholangiocarcinoma exhibiting biphenotypic antigen expression: a case report. J Clin Pathol. 2005;58:884-887. [PubMed] [DOI] |
| 13. | Minervini MI, Demetris AJ, Lee RG, Carr BI, Madariaga J, Nalesnik MA. Utilization of hepatocyte-specific antibody in the immunocytochemical evaluation of liver tumors. Mod Pathol. 1997;10:686-692. [PubMed] |
| 14. | Fan Z, van de Rijn M, Montgomery K, Rouse RV. Hep par 1 antibody stain for the differential diagnosis of hepatocellular carcinoma: 676 tumors tested using tissue microarrays and conventional tissue sections. Mod Pathol. 2003;16:137-144. [PubMed] [DOI] |
| 15. | Siddiqui MT, Saboorian MH, Gokaslan ST, Ashfaq R. Diagnostic utility of the HepPar1 antibody to differentiate hepatocellular carcinoma from metastatic carcinoma in fine-needle aspiration samples. Cancer. 2002;96:49-52. [PubMed] [DOI] |
| 16. | Zimmerman RL, Burke MA, Young NA, Solomides CC, Bibbo M. Diagnostic value of hepatocyte paraffin 1 antibody to discriminate hepatocellular carcinoma from metastatic carcinoma in fine-needle aspiration biopsies of the liver. Cancer. 2001;93:288-291. [PubMed] [DOI] |
| 17. | Leong AS, Sormunen RT, Tsui WM, Liew CT. Hep Par 1 and selected antibodies in the immunohistological distinction of hepatocellular carcinoma from cholangiocarcinoma, combined tumours and metastatic carcinoma. Histopathology. 1998;33:318-324. [PubMed] [DOI] |
| 18. | Ohmori S, Shiraki K, Sugimoto K, Sakai T, Fujikawa K, Wagayama H, Takase K, Nakano T. High expression of CD34- positive sinusoidal endothelial cells is a risk factor for hepatocellular carcinoma in patients with HCV-associated chronic liver diseases. Hum Pathol. 2001;32:1363-1370. [PubMed] [DOI] |
| 19. | Nagata S, Aishima S, Fukuzawa K, Takagi H, Yonemasu H, Iwashita Y, Kinoshita T, Wakasugi K. Adenomatoid tumour of the liver. J Clin Pathol. 2008;61:777-780. [PubMed] [DOI] |