修回日期: 2009-09-11
接受日期: 2009-09-15
在线出版日期: 2009-09-28
目的: 探讨HIF-1α沉默后对食管癌细胞株TE13的生物学行为的影响.
方法: 应用倒置荧光显微镜观察HIF-1α的干扰质粒转染食管癌细胞TE13后绿色荧光蛋白的表达; 采用Western blot方法检测HIF-1α蛋白的表达; 四甲基偶氮唑蓝(MTT)法检测转染前后细胞增殖能力的变化; Transwell方法检测干扰前后细胞迁移能力的变化; 流式细胞术检测干扰前后细胞周期的变化.
结果: TE13/12单克隆干扰效果好, Western blot结果显示无HIF-1α表达. HIF-1α被干扰后, 细胞增殖能力明显减弱(P<0.05), 运动迁移能力显著下降, 与未转染的细胞相比穿过人工基底膜的细胞数明显减少(18.2±3.7 vs 103.8±8.5,P<0.05). 与未转染组相比, TE13/12的细胞周期发生变化, G2/M期细胞明显减少(5.99%±1.19% vs 20.47%±4.30%, P<0.05), S期增加(64.67%±1.98% vs 48.53%±3.89%, P<0.05).
结论: RNA干扰可引起TE13中HIF-1α的沉默, 而HIF-1α表达下调后食管癌细胞株TE13的增殖与迁移能力均减弱. 推测阻断HIF-1α通路有可能成为治疗人食管鳞癌的新靶点.
引文著录: 金海林, 施瑞华, 朱宏, 凌亭生, 郝波. RNA干扰HIF-1α对食管癌细胞株TE13的生物学特性的影响. 世界华人消化杂志 2009; 17(27): 2762-2766
Revised: September 11, 2009
Accepted: September 15, 2009
Published online: September 28, 2009
AIM: To investigate the impact of RNA interference-mediated downregulation of hypoxia-inducible factor-1α (HIF-1α) on the biological behavior of esophageal squamous cell carcinoma TE13 cells.
METHODS: The plasmid harboring small interfering RNA targeting HIF-1α was introduced into TE13 cells by liposome-mediated transfection. The expression of HIF-1α protein was measured by Western blot. The proliferation of TE13 cells was determined by methyl thiazolyl tetrazolium (MTT) colorimetric assay. The migration of TE13 cells was evaluated by Transwell migration assay. Cell cycle analysis was performed by fluorescence-activated cell sorting (FACS).
RESULTS: HIF-1α expression was markedly downregulated in TE13/12 cell clone (transfected with the plasmid harboring small interfering RNA targeting HIF-1α). The expression of HIF-1α protein in TE13/12 cells could not be detected by Western blot. The proliferation of TE13/12 cells decreased significantly compared with untransfected TE13 cells (P < 0.05). Transwell migration assay showed that less TE13/12 cells could move through the artificial basement membrane when compared with untransfected TE13 cells (18.2 ± 3.7 vs 103.8 ± 8.5, P < 0.05). The cell cycle of TE13/12 cells was changed. Compared with untransfected TE13 cells, the percentage of TE13/12 cells in G2/M phase decreased significantly (5.99% ± 1.19% vs 20.47% ± 4.30%, P < 0.05), whereas the percentage of TE13/12 cells in S phase increased remarkably (64.67% ± 1.98% vs 48.53% ± 3.89%, P < 0.05).
CONCLUSION: RNA interference-mediated downregulation of HIF-1α can attenuate the proliferation and migration of TE13 cells. Blockade of the HIF-1α pathway may provide a new approach to the treatment of human esophagus squamous cell carcinoma.
- Citation: Jin HL, Shi RH, Zhu H, Ling TS, Hao B. RNA interference-mediated downregulation of hypoxia-inducible factor-1α attenuates the proliferation and migration of esophageal squamous cell carcinoma TE13 cells. Shijie Huaren Xiaohua Zazhi 2009; 17(27): 2762-2766
- URL: https://www.wjgnet.com/1009-3079/full/v17/i27/2762.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i27.2762
缺氧诱导因子-1(hypoxia inducible factor-1, HIF-1)是广泛存在于哺乳动物体内的一种核转录因子, 由HIF-1α和HIF-1β 2个亚基组成. 其中HIF-1α是主要的氧调节亚基和功能亚基. 常氧下HIF-1α的脯氨酸残基被羟化并通过E3泛素化-蛋白酶体途径迅速降解. 缺氧时细胞通过多个通路感受到, 脯氨酸羟化酶(prolyl hydroxylase, PHDs)失活, 泛素-蛋白酶体对HIF-1α的降解受阻, 致使HIF-1α大量积聚并转移至细胞核中, 与HIF-1β聚合形成稳定的HIF-1, 其与靶基因的缺氧反应元件(hypoxia-response element, HRE)结合, 形成转录起始复合物, 启动靶基因转录[1-2]. 已发现大多数肿瘤中存在HIF-1α的过表达[3-4], 并且与肿瘤的复发转移相关. 本研究通过建立食管癌细胞TE13的稳定HIF-1α干扰株, 探讨HIF-1α下调后对TE-13的生物学行为的影响.
人食管鳞癌细胞株TE13(中科院上海细胞所), pGCsi-HIF-1α和阴性对照环形质粒(上海吉凯公司)为携带绿色荧光蛋白(GFP)报道基因, 并不干扰任何内源基因的短发状RNA载体. FBS和DMEM(Hyclone), LipofectamineTM 2000(Invitrogen), 克隆环(Sigma), 鼠抗人HIF-1α mAb(Chemicon), 鼠抗人的Tubulin-α mAb (Sigma).
1.2.1 细胞转染: 转染前1 d取对数生长期的TE13细胞约2.0×105个接种于35 mm培养皿, 培养于不含抗生素的DMEM培养液, 次日观察细胞长至约90%聚合开始转染. 取pGCsi-HIF-1α质粒4 µg和LipofectamineTM 2000 10 µL分别稀释于250 µL不含抗生素的DMEM培养液, 5 min内混匀, 室温孵育20 min后加入培养皿. 6 h后更换新鲜的含100 mL/L胎牛血清DMEM培养液, 其后每2-3 d更换培养液. TE13细胞转染后24 h按l:12的比例传代, 48 h后开始用含400 mg/L G418(筛选浓度在转染前制杀伤曲线后获得)的选择性培养液进行筛选, 约4 wk后挑取克隆在400 mg/L G418培养液中继续传代, 扩大培养. 同步转染阴性对照质粒. 倒置荧光显微镜结合Western鉴定干扰效果.
1.2.2 Western blot: 细胞聚合后弃去培养液, 予冷PBS洗细胞2次, 加蛋白裂解液制备总蛋白, 超声破碎后4℃, 12 000 r/min, 离心10 min, 取上清. 采用BCA法定量蛋白浓度. 取总蛋白40 µg于100℃加热变性5 min后上样, 行40 mA稳流SDS-PAGE电泳, 100 V稳压冰浴电转至PVDF膜, 50 g/L脱脂奶粉室温封闭1 h后TBST漂洗, 5 min×3, 加入适当浓度一抗(HIF-1α 1:500, Tubulin-α 1:4000)4℃孵育过夜. 次日TBST漂洗5 min×3后再加HRP标记的二抗(羊抗鼠1:5000)室温孵育1 h, TBST漂洗5 min×3. ECL化学发光法显影.
1.2.3 MTT法检测转染前后TE13的增殖: 将不同细胞株按2000/孔接种于96孔板, 与MTT(5 g/L)反应, 连续7 d, 最后1 d每孔加200 μL DMSO, 摇床振荡15 min溶解后, 在酶联免疫检测仪选择波长490 nm测量各孔的吸光度值(A). 每个时间点设3复孔. 根据A绘制干扰前后细胞的增殖趋势图.
1.2.4 Transwell实验检测转染前后TE13的迁移能力: 采用孔径8 μm的24孔Transwell小室(corning). 用明胶均匀涂在小室下面晾干后, 上室加1×105个细胞, 总体积为200 μL. 下室加500 μL含100 mL/L胎牛血清的DMEM培养液. 24 h后甲醇固定, HE染色. 400倍光镜下随机取5个视野拍照, 计算穿膜细胞数.
1.2.5 流式细胞术检测干扰前后细胞周期的变化: 各组细胞同步培养收集后, 用700 mL/L乙醇固定, 碘化丙啶避光染色30 min后上机检测.
统计学处理 采用SPSS11.0统计软件处理数据. 计量资料, 用mean±SD表示. 2组数据比较采用成组t检验, P<0.05为有统计学意义.
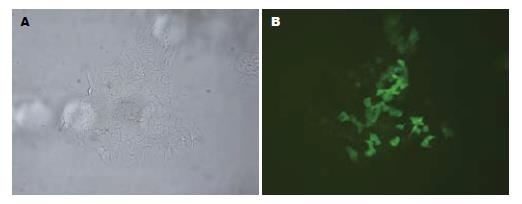
在所挑出的单克隆中, TE13/12细胞株在倒置荧光显微镜下发出绿色荧光, 证实质粒已转入细胞基因组并稳定表达(图1).
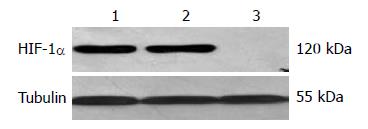
TE13/12单克隆无HIF-1α的表达, 而转染阴性对照质粒的细胞株HIF-1α的表达与未转染的细胞无明显差异(图2).
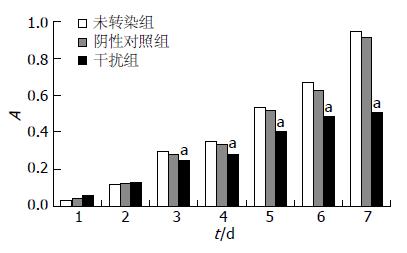
根据连续7 d A值绘制的生长趋势图提示干扰组明显低于未转染组(P<0.05), 而阴性对照组与未转染组无明显差异(图3).
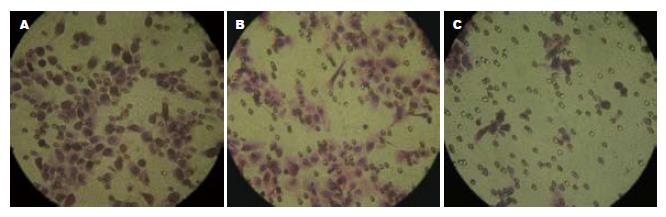
HIF-1α沉默后, TE13/12的迁移能力明显下降, 穿过人工膜的细胞数明显少与未转染组(18.2±3.7vs 103.8±8.5, P<0.05), 而阴性对照组和未转染组穿膜细胞数无统计学差异(96.8±9.4 vs 103.8±8.5, P>0.05, 图4).
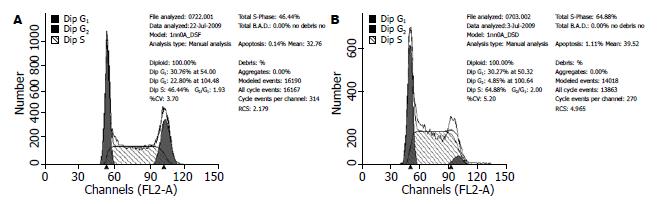
干扰组细胞G2/M期细胞明显少于未转染组(5.99%±1.19% vs 20.47%±4.30%, P<0.05), 细胞被阻滞于S期(64.67%±1.98% vs 48.53%±3.89%, P<0.05), 而G0/G1期细胞比例变化无统计学意义(28.61%±3.04% vs 31.00%±0.41%,P>0.05, 图5).
HIF-1α作为一种核转录因子, 能通过对缺氧诱导基因如血管内皮生长因子(vascular endothelial growth factor, VEGF)、血红素氧合酶-1、糖酵解酶等表达的调节, 维持机体对缺氧的适应能力. 其功能涉及代谢适应、红细胞生成、血管发生和细胞生长、分化、凋亡等多个方面[5]. 目前研究认为HIF-1α与肿瘤患者预后及对治疗的反应密切相关[6-8]. 关于HIF-1α的生物学研究在过去几年中已经获得了显著的进步, 但其在血管生成和肿瘤中的作用机制及通路方面的研究仍相对不足[9].
RNA干扰是20世纪90年代发现的一种生物学现象, 广泛的存在于各种生物体内, 是一种古老而且分布极为广泛的保护自身遗传物质完整的机制[10]. 其机制为外源性基因随机整合到宿主基因组并利用宿主细胞进行转录时, 宿主细胞常产生一些双链RNA(dsRNA), 随后dsRNA被切割酶Dicer剪切为21-23 bp的小干扰RNA(small interfering RNA, siRNA). siRNA再与酶蛋白结合形成RNA诱导的沉默复合体(RNA-induced silencing complex, RISC), RISC根据碱基互补配对原则与靶向mRNA结合, 最终导致目标mRNA降解, 从而导致基因沉默[11]. 由于RNAi对目的基因的表达有高效和特异性的抑制作用, 目前在基因的基础研究中占据着不可替代的地位, 并且在某些病毒感染、肿瘤的临床治疗上也显示出了巨大的潜力[12]. 在前期实验中我们设计合成了3个不同序列的针对HIF-1α的干扰质粒pGCsi-HIF1、pGCsi-HIF2和pGCsi-HIF3, 并筛选出干扰效率较高的pGCsi-HIF3[13]. 本实验中我们应用pGCsi-HIF3干扰质粒稳定转染食管癌细胞TE13, 单克隆扩大培养后, 倒置荧光显微镜下观察, 可见TE13/12克隆有较强的绿色荧光蛋白表达, 提示质粒已整合到基因组中并稳定表达. Western blot结果显示, TE13/12克隆无HIF-1α的表达, 进一步在蛋白水平证明了干扰的效果.
HIF-1α在肿瘤细胞的生长、分化、增殖及转移过程中发挥着重要作用. 由于肿瘤细胞的恶性增殖, 巨大的细胞团对能量的需求急剧增加的同时形成了局部缺氧的微环境. 于是HIF-1α降解减少, 转位进入胞核与β亚基结合形成HIF-1, 启动其下游靶基因的表达, 从而促进血管发生、糖酵解及代谢适应等[14]. 我们在实验中发现, HIF-1α被干扰后, 细胞增殖速度明显减慢, 流式细胞术检测细胞周期提示TE13被干扰后, 细胞被阻滞于S期, 而进入分裂期的细胞明显减少, 这也部分解释了MTT的结果. 关于HIF-1α促进肿瘤细胞增殖的机制, 有研究认为是HIF-1α刺激了MXI1表达后, 增加了C-MYC降解, 从而降低了肿瘤细胞的氧耗所致[15]. 另外, 我们还发现在TE13中HIF-1α被干扰后, 细胞的迁移能力显著下降, 提示HIF-1α在食管癌的转移过程中有重要作用.
我们的实验结果显示, 食管癌细胞株TE13经针对HIF-1α的干扰质粒转染, 用G418筛选后再单克隆化, 经Western鉴定的细胞株能稳定的抑制HIF-1α的表达. 其后的功能实验进一步提示HIF-1α沉默后TE-13的增殖、迁移能力显著下降以及细胞周期发生改变. 这些结果提示HIF-1α在食管癌的发生、进展及转移过程中起着重要作用, 有可能成为一个潜在的肿瘤治疗靶点.
目前已有较多的HIF-1α抑制剂问世, 比如相关信号通路(PI3K/Akt/mTOR, MAPK及Hsp90系统等)的抑制剂[16], 但其中大部分并非特异性的抑制HIF-1α的表达. 由于缺乏特异性使其作用机制无法确切的评价, 这也限制了其在临床的应用. 因此, 特异性的HIF-1α抑制剂的研制成为现代抗肿瘤研究领域的热点. 这类药物的研制成功必定会为肿瘤的治疗带来巨大的进展.
实体肿瘤微环境存在缺氧与代谢紊乱, 而缺氧诱导因子-1(HIF-1)的表达和活性增强是肿瘤细胞适应缺氧环境的重要原因, 其α亚基HIF-1α是主要的氧调节亚基和功能亚基. 目前已发现人类多数肿瘤中存在HIF-1α的过表达.
吕宾, 教授, 浙江中医学院附属医院(浙江省中医院、浙江省东方医院)消化科.
关于HIF-1α的生物学研究在近几年已经获得了显著的进步, 但其在肿瘤中的作用机制及通路方面的研究仍相对不足. 成为该领域的研究热点问题之一.
Takahashi et al在肝癌中研究提示RNA干扰HIF-1α后抑制了肝癌细胞的增殖. Kang et al在胰腺癌的研究中也得出与本文相似的结果. 这些研究提示HIF-1α很可能在肿瘤的发生、增殖过程中发挥了重要的作用.
HIF-1α的相关研究虽然较多, 但在食管鳞癌中通过RNA干扰技术研究其功能的报道尚少. 本文在高度恶性食管癌细胞株TE13中的研究结果为证实HIF-1α的生物学作用的普遍性提供了一定的依据.
本研究证实RNA干扰可以沉默食管癌细胞株TE13 的HIF-1α表达, 抑制其增殖与迁移, 为其将来临床应用提供了理论依据.
本文采用RNA干扰技术, 沉默HIF-1α, 研究食管癌细胞株TE13的生物学特征的变化. 设计合理, 方法先进, 结果可信, 有较好的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Smith TG, Robbins PA, Ratcliffe PJ. The human side of hypoxia-inducible factor. Br J Haematol. 2008;141:325-334. [PubMed] |
| 2. | Semenza GL. HIF-1, O(2), and the 3 PHDs: how animal cells signal hypoxia to the nucleus. Cell. 2001;107:1-3. [PubMed] [DOI] |
| 3. | Zhong H, De Marzo AM, Laughner E, Lim M, Hilton DA, Zagzag D, Buechler P, Isaacs WB, Semenza GL, Simons JW. Overexpression of hypoxia-inducible factor 1alpha in common human cancers and their metastases. Cancer Res. 1999;59:5830-5835. [PubMed] |
| 4. | Talks KL, Turley H, Gatter KC, Maxwell PH, Pugh CW, Ratcliffe PJ, Harris AL. The expression and distribution of the hypoxia-inducible factors HIF-1alpha and HIF-2alpha in normal human tissues, cancers, and tumor-associated macrophages. Am J Pathol. 2000;157:411-421. [PubMed] |
| 5. | Maxwell PH, Pugh CW, Ratcliffe PJ. Activation of the HIF pathway in cancer. Curr Opin Genet Dev. 2001;11:293-299. [PubMed] |
| 6. | Tzao C, Lee SC, Tung HJ, Hsu HS, Hsu WH, Sun GH, Yu CP, Jin JS, Cheng YL. Expression of hypoxia-inducible factor (HIF)-1alpha and vascular endothelial growth factor (VEGF)-D as outcome predictors in resected esophageal squamous cell carcinoma. Dis Markers. 2008;25:141-148. [PubMed] [DOI] |
| 7. | Bos R, van der Groep P, Greijer AE, Shvarts A, Meijer S, Pinedo HM, Semenza GL, van Diest PJ, van der Wall E. Levels of hypoxia-inducible factor-1alpha independently predict prognosis in patients with lymph node negative breast carcinoma. Cancer. 2003;97:1573-1581. [PubMed] [DOI] |
| 8. | Koukourakis MI, Bentzen SM, Giatromanolaki A, Wilson GD, Daley FM, Saunders MI, Dische S, Sivridis E, Harris AL. Endogenous markers of two separate hypoxia response pathways (hypoxia inducible factor 2 alpha and carbonic anhydrase 9) are associated with radiotherapy failure in head and neck cancer patients recruited in the CHART randomized trial. J Clin Oncol. 2006;24:727-735. [PubMed] [DOI] |
| 9. | Weidemann A, Johnson RS. Biology of HIF-1alpha. Cell Death Differ. 2008;15:621-627. [PubMed] [DOI] |
| 10. | Mello CC, Conte D Jr. Revealing the world of RNA interference. Nature. 2004;431:338-342. [PubMed] [DOI] |
| 11. | Tijsterman M, Plasterk RH. Dicers at RISC; the mechanism of RNAi. Cell. 2004;117:1-3. [PubMed] [DOI] |
| 12. | Leung RK, Whittaker PA. RNA interference: from gene silencing to gene-specific therapeutics. Pharmacol Ther. 2005;107:222-239. [PubMed] [DOI] |
| 13. | 肖 斌, 施 瑞华, 杜 琰萍, 朱 宏, 凌 亭生, 张 国新, 林 艳, 郝 波. RNA干扰体外抑制人食管鳞癌细胞Eca-109缺氧诱导 因子-1α的表达. 世界华人消化杂志. 2006;14:1654-1661. [DOI] |
| 14. | Ziello JE, Jovin IS, Huang Y. Hypoxia-Inducible Factor (HIF)-1 regulatory pathway and its potential for therapeutic intervention in malignancy and ischemia. Yale J Biol Med. 2007;80:51-60. [PubMed] [DOI] |
| 15. | Zhang H, Gao P, Fukuda R, Kumar G, Krishnamachary B, Zeller KI, Dang CV, Semenza GL. HIF-1 inhibits mitochondrial biogenesis and cellular respiration in VHL-deficient renal cell carcinoma by repression of C-MYC activity. Cancer Cell. 2007;11:407-420. [PubMed] [DOI] |
| 16. | Diaz-Gonzalez JA, Russell J, Rouzaut A, Gil-Bazo I, Montuenga L. Targeting hypoxia and angiogenesis through HIF-1alpha inhibition. Cancer Biol Ther. 2005;4:1055-1062. [PubMed] [DOI] |