修回日期: 2009-08-20
接受日期: 2009-08-24
在线出版日期: 2009-09-08
目的: 观察结肠腺癌组织细胞凋亡的变化, 探讨抑制凋亡蛋白Bcl-2、Bcl-xL及Bcl-w在结肠腺癌中的作用.
方法: 收集14例我院手术切除结肠腺癌标本, 肠镜取正常结肠黏膜组织27例, 所有标本均经病理明确诊断. 用TUNEL法检测其组织细胞凋亡水平, 并用免疫组织化学PV法检测蛋白Bcl-2、Bcl-xL及Bcl-w的表达水平.
结果: 正常结肠黏膜组织的细胞凋亡指数明显高于结肠腺癌, 有统计学显著性差异(t = 3.35, P = 0.002); 结肠腺癌中Bcl-xL与Bcl-w的表达均高于正常结肠黏膜组织, 有统计学差异(92.86% vs 11.11%; 85.71% vs 0%, P<0.01或P<0.05); Bcl-2的表达与正常结肠黏膜组织没有统计学差异(P>0.05).
结论: 结肠腺癌的组织细胞凋亡明显低于正常结肠组织; 结肠腺癌中抑制凋亡蛋白Bcl-xL与Bcl-w的高表达可能发挥了重要的作用.
引文著录: 郭文娟, 王爱英, 高春. 细胞凋亡在结肠腺癌组织中的变化及其相关蛋白的表达. 世界华人消化杂志 2009; 17(25): 2589-2594
Revised: August 20, 2009
Accepted: August 24, 2009
Published online: September 8, 2009
AIM: To examine the occurrence of apoptosis in colon adenocarcinoma and investigate the role of Bcl-2, Bcl-xL and Bcl-w as mediators of apoptosis.
METHODS: Fourteen human colon adenocarcinoma specimens were obtained by surgical resection and pathologically confirmed. Twenty-seven normal colon tissue specimens were obtained by colonoscopic biopsy. Apoptosis was detected using the terminal deoxynucleotidyl transferase-mediated dUTP nick end labeling (TUNEL) assay. The expression of Bcl-2, Bcl-xL and Bcl-w proteins was measured by immunohistochemistry.
RESULTS: Compared with normal colon tissues, the apoptosis index (AI) in colon adenocarcinoma tissues significantly decreased (t = 3.35, P = 0.002). The expression levels of Bcl-xL and Bcl-w proteins were significantly higher in colon adenocarcinoma tissues than in normal colon tissues (92.86% vs 11.11% and 85.71% vs 0%, respectively; P < 0.01 and 0.05), whereas no significant difference was noted in the expression level of Bcl-2 protein between adenocarcinoma and normal colon tissues (P > 0.05).
CONCLUSION: Apoptosis occurs in normal colon tissue but decreases in colon adenocarcinoma. Both Bcl-xL and Bcl-w proteins, rather than Bcl-2 protein, may play an important role in the suppression of apoptosis in colon adenocarcinoma.
- Citation: Guo WJ, Wang AY, Gao C. Apoptosis and expression of apoptosis-related proteins Bcl-2, Bcl-xL and Bcl-w in human colon adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2009; 17(25): 2589-2594
- URL: https://www.wjgnet.com/1009-3079/full/v17/i25/2589.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i25.2589
尽管结肠癌的诊断水平和治疗技术有所提高, 但其预后仍然不容乐观. 大量研究表明, 结肠腺癌的发生、发展与细胞凋亡的失调有密切关系. 而Bcl-2家族在细胞凋亡中发挥了重要作用, 该家族包括抑制凋亡蛋白(如Bcl-2、Bcl-xL、Bcl-w等)和促进凋亡蛋白(如Bax、Bad等), 他们之间形成同源或异源二聚体, 从而发挥不同的作用. 一旦促凋亡蛋白和抑制凋亡蛋白之间的平衡打破, 不仅影响DNA损伤或周期异常细胞的凋亡, 甚至影响肿瘤细胞的凋亡. 本研究通过检测正常结肠组织和结肠腺癌组织的细胞凋亡以及Bcl-2家族成员(Bcl-2、Bcl-xL和Bcl-w蛋白)在两者中表达的差异, 探讨其在结肠腺癌发生发展中的作用, 为结肠腺癌的化学药物治疗和基因治疗提供新的理论支持.
标本来源于北京大学第三医院, 27例正常结肠黏膜标本取自结肠镜黏膜活检, 14例结肠腺癌黏膜标本取自手术标本, 术前所有患者均未经化疗、放疗或免疫治疗, 所有病例均经病理明确诊断. 标本用40 g/L甲醛固定, 常规石蜡包埋, 4 μm厚连续切片, 每份标本均制作成免疫组织化学用的切片, 另有一张做HE染色. 细胞凋亡试剂盒、DNaseⅠ、蛋白酶K和NBT/BCIP显色液均购自罗氏公司; Bcl-w兔抗人/鼠多克隆抗体(1:300)由Abcam公司提供, Bcl-2鼠抗人mAb(1:600)由美国Sigma公司提供, Bcl-xL兔抗人mAb(1:200)由Cell signaling公司提供. DAB显色液购于DAKO公司. PV-6001、PV-6002为两步法的非生物素标记的检测系统, 购自北京中衫公司. 多聚赖氨酸、0.01 mol/L磷酸盐(PBS)缓冲液(pH7.2-7.4)、0.01 mol/L枸橼酸盐缓冲液(pH6.0)及其他常规试剂均购自北京中衫公司.
1.2.1 TUNEL法检测细胞凋亡: 石蜡切片脱蜡、水化后, 蛋白酶K(1:10)37℃孵育10 min, PBS冲洗后加入TUNEL反应液, 避光湿盒孵育60 min, PBS冲洗后加入Converter-POD反应液, 湿盒孵育30 min, 最后NBT/BCIP显色, 甲基绿复染. 阴性对照使用Lable Solution取代TUNEL反应液. 结果判定: 每张切片选5-10个高倍镜视野, 计数黏膜及腺管上皮细胞, 核染色阳性者记为TUNEL阳性细胞, 计数阳性细胞占视野总细胞数的百分比, 其均值即为该标本的凋亡指数(apoptotic index, AI).
1.2.2 免疫组织化学检测Bcl-2、Bcl-xL和Bcl-w蛋白在组织中的表达: 按照PV两步法进行. 40 g/L中性甲醛溶液固定, 常规石蜡包埋切片(厚度4 μm), 贴于涂有多聚赖氨酸的玻片上, 常规脱蜡至水, 微波修复高火15 min, 30 mL/L过氧化氢甲醇溶液灭活内源性过氧化物酶, 余步骤按照试剂盒说明操作. 对照设立包括阳性对照、阴性空白对照和阴性替代对照; 阳性对照由已知阳性切片做阳性对照, 空白对照由既往实验证实, 阴性替代对照用0.01 mol/L的PBS(pH7.4)代替一抗.
1.2.3 结果判定: 计分参照Rahman的标准并作适当修改, 染色强度计分: 无色0分; 淡黄色1分; 黄色2分; 棕褐色3分[3]. 阳性细胞数计分: <25% 1分; 26%-50% 2分; 51%-75% 3分; >75% 4分. 根据染色强度和阳性细胞数计分之和进行判断: 0分为阴性(-), 1-2分为弱阳性(+), 3-5分为中等阳性(++), 6-7分为强阳性(+++). 所有结果均经3位作者在病理医生帮助下分别阅片, 若有异议共同商议后确定.
统计学处理 用SPSS13.0软件, 细胞凋亡指数组间均数的比较采用独立样本的t检验; 结肠腺癌与正常结肠蛋白阳性率之间的比较采用卡方检验. 以α = 0.05为检验标准.
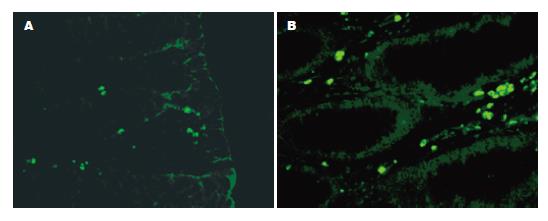
在正常结肠黏膜组织中, 凋亡不仅出现在黏膜上皮细胞, 也出现在腺管上皮细胞. 在结肠腺癌组织中, 则散在分布于腺管状癌组织中. 27例正常结肠黏膜组织的AI均值为8.61%, 14例结肠腺癌组织AI均值为0.47%. 正常结肠黏膜组织和腺癌组织进行比较(t = 3.35, P = 0.002), 提示二者之间有统计学差异, 正常结肠黏膜组织的AI明显高于结肠腺癌(图1).
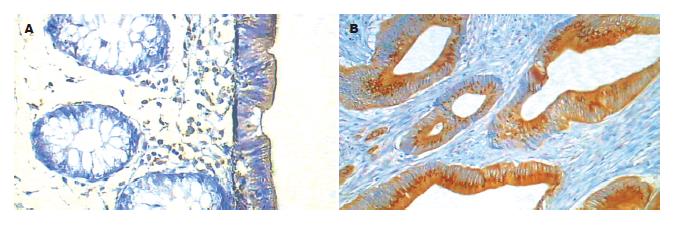
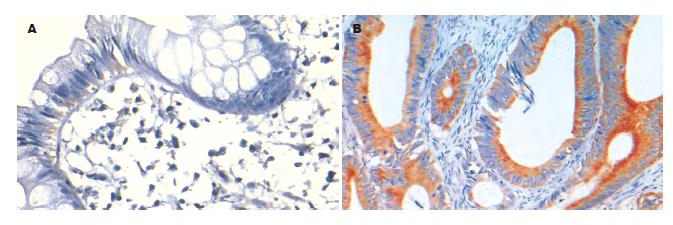
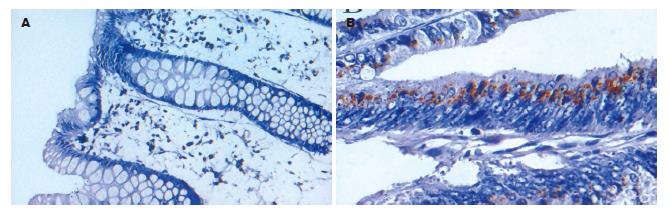
Bcl-2在结肠腺癌中的阳性率为64.29%, 正常结肠黏膜组织为44.44%, 两者比较没有统计学差异(P = 0.276). Bcl-2在正常组织中主要位于上皮游离缘胞质, 在结肠腺癌组织中则弥漫的分布于胞质和胞膜. Bcl-xL在结肠腺癌中的阳性率明显高于正常结肠, 分别为92.86%和11.11%, 统计学有显著性差异(P<0.01). Bcl-xL在正常结肠黏膜组织中表达主要分布在黏膜上皮细胞核的下方, 在结肠腺癌中则广泛表达于细胞质, 多呈强阳性颗粒状着色, 明显不同于Bcl-2的表达. Bcl-w在结肠腺癌中的阳性表达率高于正常结肠, 分别为85.17%和0%, 有统计学差异(P = 0.00), Bcl-w在正常结肠组织中黏膜上皮和腺体未见阳性表达, 在结肠腺癌中则主要在胞质着色(表1, 图2-4).
| n | Bcl-2 | Bcl-xL | Bcl-w | |
| 正常结肠黏膜 | 27 | 12(44.44) | 3(11.11) | 0(0.00) |
| 结肠腺癌 | 14 | 9(64.29) | 13(92.86) | 12(85.71) |
凋亡参与体内细胞数量的调节, 清除体内无功能的细胞、对机体有害的细胞、突变的细胞以及受损后不能存活的细胞, 在机体正常生长发育和稳态调节中发挥了重要的作用[4-5]. 凋亡在维持结肠的正常结构和功能中有重要意义[6]. 在正常结肠中, 隐窝基底部的干细胞不断分化出新的细胞转移并到隐窝顶部, 同时每天大约有1010个细胞脱落到肠腔, 维持了肠道细胞数量的平衡[7-8]. 结肠癌的发生过程经历了息肉-腺瘤-含有腺瘤的腺癌-腺癌的一系列病理过程[9], 同时伴随着凋亡水平的降低和增殖水平的升高[10]. Bcl-2家族是调节细胞凋亡的重要成员, 其抑制凋亡蛋白的升高促进了肿瘤的发生[11]. 在本研究中, 正常结肠的凋亡显著高于结肠腺癌组织, 推测与Bcl-2家族中抑制凋亡蛋白的表达水平升高有关.
Bcl-2是研究最为广泛的抑制凋亡蛋白之一, 本研究发现, Bcl-2在正常结肠的黏膜和腺体中均有表达, 在腺癌中则弥散分布于整个胞质中, 且在细胞膜和核膜中亦有表达. 有研究表明Bcl-2在没有淋巴血管侵犯, 没有淋巴结转移的早期结肠癌中的表达较高[12], 因此Bcl-2可能在结肠腺癌形成的早期发挥了重要的作用, 同时其表达与较好的临床预后相关[13-14], Bendardaf et al[15-16]研究表明, Bcl-2和胸苷酸合酶的表达与结直肠癌的无瘤生存期有关. 另有研究表明, 随结肠腺癌恶性程度的进一步发展, 其表达量又相对下降[17]. 在结肠腺瘤由轻度异型性到中度、重度异型性进展的过程中, Bcl-2的表达逐渐减少甚至消失, 但降低的Bcl-2表达并没有导致凋亡活性的升高, 因此Bcl-2在结肠肿瘤的晚期可能并不发挥主要作用[18-20]. 在本研究中, 14例结肠腺癌中, 有12例中分化腺癌, 2例低分化腺癌, 因此Bcl-2在结肠腺癌中的表达与正常组织中没有统计学差异, 可能与所选标本的恶性程度较高有关.
与Bcl-2相比, Bcl-xL在正常结肠黏膜组织主要位于黏膜上皮核的基底部, 在结肠腺癌组织中则广泛表达于胞质, 且多为强阳性着色. 本研究发现, Bcl-xL在结肠腺癌中的表达水平明显高于正常结肠黏膜组织, 且有统计学意义, 这与Zhang et al[21]的研究结果一致. 有研究报道Bcl-xL的表达在结直肠腺癌中明显高于Bcl-2, 另有研究表明, Bcl-xL/Bax而非Bcl-2/Bax与结直肠癌细胞系对5-FU化学敏感性显著相关[22-23]. Bcl-xL可能通过与Bcl-2不同的机制发挥抑制凋亡的作用. 在Ras诱导的抗失巢凋亡中, 发挥抗凋亡作用的为Bcl-xL而非Bcl-2[24-25], 在神经胶质瘤中, JNK(c-Jun氨基末端激酶)对Bcl-xL和Bcl-2的拮抗作用不同[26]. 由于Bcl-xL的过表达可以抑制一些细胞的凋亡, 而Bcl-2的过表达却不能, 因此, 越来越多的研究结果显示在一些组织(如膀胱癌)[27]Bcl-xL的抗凋亡作用强于Bcl-2, 而且他们可能通过不同的路径发挥作用, 尽管其结构存在相似性[28-29].
Bcl-w是Bcl-2家族中重要成员之一, 其抑制凋亡的作用受到越来越多的关注. 本研究发现Bcl-w在腺癌中表达的阳性率为85.71%, 而正常结肠黏膜组织中未见阳性表达(P<0.01), Wilson et al研究表明Bcl-w在正常结肠, 结肠腺瘤和结肠腺癌中的表达逐渐升高[31], 这与本研究结果相一致. 在胃癌组织, Bcl-w表达明显高于正常组织, 在2种不同的人类胃腺癌细胞系(SNU-16和SNU-620)的研究中, SNU-16较SNU-620对各种促进凋亡刺激敏感, 后者Bcl-w的含量明显高于前者. 同时, Bcl-w含量高的细胞其侵袭力强[32]. 在Bcl-w敲除的老鼠, 只表现为精子的发生异常[33-34], 但在γ射线或细胞毒性药物的作用下, Bcl-w敲除的老鼠其肠道细胞凋亡明显增加[35]. 在小肠大部切除术的研究中, 也表明Bcl-w表达的增高对于促进切除后小肠细胞增殖中发挥了重要作用[36]. Bcl-w促进结肠腺癌发生的机制尚不清楚, 但有研究表明, 在结直肠腺癌中, Met可通过增加Bcl-w的表达而抑制癌细胞的凋亡[32,37]. β-catenin可以激活Bcl-w的启动子, 导致Bcl-w的高表达, 抑制了结肠癌细胞的凋亡[38]. 在Bae et al的研究中, Bcl-w也可以通过激活PI3K/AKT进而激活了转录因子Sp1的活性, 使得MMP2表达增加, 分解细胞外基质, 从而促进胃癌细胞的侵袭力[39]; 也可以在激活转录因子Sp1后, 诱导了uPA(尿激酶型纤维蛋白酶原激活剂)的表达, 从而使黏着斑激酶(FAK)的水平升高, 促进了细胞的侵袭力[40].
本研究发现, 结肠腺癌组织的凋亡明显低于正常组织, 抑制凋亡蛋白Bcl-xL和Bcl-w在腺癌中的高表达可能发挥了重要的作用. 因此, 降低抑制凋亡蛋白的表达, 对降低结肠腺癌耐药性和结肠腺癌进展有重要的意义.
结肠癌在西方国家肿瘤相关性死亡中位居第3位, 而肿瘤的发生与细胞凋亡和增殖的失衡有关. Bcl-2家族在内源性凋亡途径中发挥了重要作用, 其家族成员表达的失调一定程度上导致了肿瘤的发生和对化疗药物敏感性的降低.
曹秀峰, 主任医师, 南京医科大学附属南京第一医院肿瘤中心.
尽管结肠癌的诊断水平和治疗技术有所提高, 但其预后仍然不容乐观. 大量研究表明, 结肠腺癌的发生、发展与细胞凋亡的失调有密切关系.
Lee et al的研究表明, Bcl-w可以通过抑制SAPK/JNK的激活, 降低细胞对anti-Fas、血清撤退等促凋亡刺激的反应; 在Bae et al的研究中, Bcl-w通过促进基质金属蛋白激酶MMP2或黏着斑激酶(FAK)含量, 促进细胞的迁移.
由于Bcl-xL在结肠癌中的高表达, 降低了细胞的凋亡水平, 因此应用针对Bcl-xL的反义寡核苷酸, 通过降低Bcl-xL的表达水平, 可以引起细胞凋亡的增加和增殖的减少, 并增加了对肿瘤化疗药物的敏感性.
本研究通过检测正常结肠和结肠腺癌的细胞凋亡以及Bcl-2家族成员在两者中表达的差异, 探讨其在结肠腺癌发生发展中的作用, 为结肠腺癌的化学药物治疗和基因治疗提供了新的理论支持.
编辑: 李军亮 电编:何基才
| 1. | Ferlay J, Autier P, Boniol M, Heanue M, Colombet M, Boyle P. Estimates of the cancer incidence and mortality in Europe in 2006. Ann Oncol. 2007;18:581-592. [PubMed] [DOI] |
| 2. | Jemal A, Siegel R, Ward E, Murray T, Xu J, Thun MJ. Cancer statistics, 2007. CA Cancer J Clin. 2007;57:43-66. [PubMed] [DOI] |
| 4. | Fulda S. Apoptosis pathways and neuroblastoma therapy. Curr Pharm Des. 2009;15:430-435. [PubMed] [DOI] |
| 5. | Cotter TG. Apoptosis and cancer: the genesis of a research field. Nat Rev Cancer. 2009;9:501-507. [PubMed] [DOI] |
| 6. | Watson AJ, Pritchard DM. Lessons from genetically engineered animal models. VII. Apoptosis in intestinal epithelium: lessons from transgenic and knockout mice. Am J Physiol Gastrointest Liver Physiol. 2000;278:G1-G5. [PubMed] [DOI] |
| 7. | Rajagopalan H, Nowak MA, Vogelstein B, Lengauer C. The significance of unstable chromosomes in colorectal cancer. Nat Rev Cancer. 2003;3:695-701. [PubMed] [DOI] |
| 8. | Leedham SJ, Wright NA. Expansion of a mutated clone: from stem cell to tumour. J Clin Pathol. 2008;61:164-171. [PubMed] [DOI] |
| 9. | Kukitsu T, Takayama T, Miyanishi K, Nobuoka A, Katsuki S, Sato Y, Takimoto R, Matsunaga T, Kato J, Sonoda T. Aberrant crypt foci as precursors of the dysplasia-carcinoma sequence in patients with ulcerative colitis. Clin Cancer Res. 2008;14:48-54. [PubMed] [DOI] |
| 10. | Oumouna-Benachour K, Oumouna M, Zerfaoui M, Hans C, Fallon K, Boulares AH. Intrinsic resistance to apoptosis of colon epithelial cells is a potential determining factor in the susceptibility of the A/J mouse strain to dimethylhydrazine-induced colon tumorigenesis. Mol Carcinog. 2007;46:993-1002. [PubMed] [DOI] |
| 11. | Youle RJ, Strasser A. The BCL-2 protein family: opposing activities that mediate cell death. Nat Rev Mol Cell Biol. 2008;9:47-59. [PubMed] [DOI] |
| 12. | Han HS, Park YM, Hwang TS. Differential expression of Bcl-2, Bcl-XL and p53 in colorectal cancer. J Gastroenterol Hepatol. 2006;21:1108-1114. [PubMed] [DOI] |
| 13. | Ilyas M, Hao XP, Wilkinson K, Tomlinson IP, Abbasi AM, Forbes A, Bodmer WF, Talbot IC. Loss of Bcl-2 expression correlates with tumour recurrence in colorectal cancer. Gut. 1998;43:383-387. [PubMed] [DOI] |
| 14. | Leahy DT, Mulcahy HE, O'Donoghue DP, Parfrey NA. bcl-2 protein expression is associated with better prognosis in colorectal cancer. Histopathology. 1999;35:360-367. [PubMed] [DOI] |
| 15. | Bendardaf R, Ristamaki R, Syrjanen K, Pyrhonen S. Bcl-2 expression significantly correlates with thymidylate synthase expression in colorectal cancer patients. World J Gastroenterol. 2008;14:6218-6223. [PubMed] [DOI] |
| 16. | Bendardaf R, Lamlum H, Ristamäki R, Syrjänen K, Pyrhönen S. Oncoprotein Bcl-2 and microsatellite instability are associated with disease-free survival and treatment response in colorectal cancer. Oncol Rep. 2008;20:999-1004. [PubMed] [DOI] |
| 17. | Watson AJ, Merritt AJ, Jones LS, Askew JN, Anderson E, Becciolini A, Balzi M, Potten CS, Hickman JA. Evidence of reciprocity of bcl-2 and p53 expression in human colorectal adenomas and carcinomas. Br J Cancer. 1996;73:889-895. [PubMed] [DOI] |
| 18. | Berney CR, Downing SR, Yang JL, Russell PJ, Crowe PJ. Evidence for post-transcriptional down-regulation of the apoptosis-related gene bcl-2 in human colorectal cancer. J Pathol. 2000;191:15-20. [PubMed] [DOI] |
| 19. | Carr NJ, Emory TS, Sobin LH. Epithelial neoplasms of the appendix and colorectum: an analysis of cell proliferation, apoptosis, and expression of p53, CD44, bcl-2. Arch Pathol Lab Med. 2002;126:837-841. [PubMed] [DOI] |
| 20. | Yang SY, Sales KM, Fuller B, Seifalian AM, Winslet MC. Apoptosis and colorectal cancer: implications for therapy. Trends Mol Med. 2009;15:225-233. [PubMed] [DOI] |
| 21. | Zhang YL, Pang LQ, Wu Y, Wang XY, Wang CQ, Fan Y. Significance of Bcl-xL in human colon carcinoma. World J Gastroenterol. 2008;14:3069-3073. [PubMed] [DOI] |
| 22. | Zhang L, Yu J, Park BH, Kinzler KW, Vogelstein B. Role of BAX in the apoptotic response to anticancer agents. Science. 2000;290:989-992. [PubMed] [DOI] |
| 23. | Maurer CA, Friess H, Bühler SS, Wahl BR, Graber H, Zimmermann A, Büchler MW. Apoptosis inhibiting factor Bcl-xL might be the crucial member of the Bcl-2 gene family in colorectal cancer. Dig Dis Sci. 1998;43:2641-2648. [PubMed] [DOI] |
| 24. | Coll ML, Rosen K, Ladeda V, Filmus J. Increased Bcl-xL expression mediates v-Src-induced resistance to anoikis in intestinal epithelial cells. Oncogene. 2002;21:2908-2913. [PubMed] [DOI] |
| 25. | Alfano D, Iaccarino I, Stoppelli MP. Urokinase signaling through its receptor protects against anoikis by increasing BCL-xL expression levels. J Biol Chem. 2006;281:17758-17767. [PubMed] [DOI] |
| 26. | Jeong HS, Choi HY, Choi TW, Kim BW, Kim JH, Lee ER, Cho SG. Differential regulation of the antiapoptotic action of B-cell lymphoma 2 (Bcl-2) and B-cell lymphoma extra long (Bcl-xL) by c-Jun N-terminal protein kinase (JNK) 1-involved pathway in neuroglioma cells. Biol Pharm Bull. 2008;31:1686-1690. [PubMed] [DOI] |
| 27. | Hameed DA, Abdel Raheem AM, Mosad E, Hammouda HM, Kamel NA, Abdel Aziz MA. Bcl-XL and Bcl-2 expression in bilharzial squamous cell carcinoma of the urinary bladder: which protein is prognostic? Urology. 2008;72:374-378. [PubMed] [DOI] |
| 28. | Zheng X, Wang Y, Wei H, Ling B, Sun R, Tian Z. Bcl-xL is associated with the anti-apoptotic effect of IL-15 on the survival of CD56(dim) natural killer cells. Mol Immunol. 2008;45:2559-2569. [PubMed] [DOI] |
| 29. | Wang Y, Zhang B, Peng X, Perpetua M, Harbrecht BG. Bcl-xL prevents staurosporine-induced hepatocyte apoptosis by restoring protein kinase B/mitogen-activated protein kinase activity and mitochondria integrity. J Cell Physiol. 2008;215:676-683. [PubMed] [DOI] |
| 30. | Wacheck V, Selzer E, Günsberg P, Lucas T, Meyer H, Thallinger C, Monia BP, Jansen B. Bcl-x(L) antisense oligonucleotides radiosensitise colon cancer cells. Br J Cancer. 2003;89:1352-1357. [PubMed] [DOI] |
| 31. | Wilson JW, Nostro MC, Balzi M, Faraoni P, Cianchi F, Becciolini A, Potten CS. Bcl-w expression in colorectal adenocarcinoma. Br J Cancer. 2000;82:178-185. [PubMed] [DOI] |
| 32. | Lee HW, Lee SS, Lee SJ, Um HD. Bcl-w is expressed in a majority of infiltrative gastric adenocarcinomas and suppresses the cancer cell death by blocking stress-activated protein kinase/c-Jun NH2-terminal kinase activation. Cancer Res. 2003;63:1093-1100. [PubMed] [DOI] |
| 33. | Ross AJ, Waymire KG, Moss JE, Parlow AF, Skinner MK, Russell LD, MacGregor GR. Testicular degeneration in Bclw- deficient mice. Nat Genet. 1998;18:251-256. [PubMed] [DOI] |
| 34. | Print CG, Loveland KL, Gibson L, Meehan T, Stylianou A, Wreford N, de Kretser D, Metcalf D, Köntgen F, Adams JM. Apoptosis regulator bcl-w is essential for spermatogenesis but appears otherwise redundant. Proc Natl Acad Sci U S A. 1998;95:12424-12431. [PubMed] [DOI] |
| 35. | Pritchard DM, Print C, O'Reilly L, Adams JM, Potten CS, Hickman JA. Bcl-w is an important determinant of damage-induced apoptosis in epithelia of small and large intestine. Oncogene. 2000;19:3955-3959. [PubMed] [DOI] |
| 36. | Stern LE, Falcone RA Jr, Kemp CJ, Stuart LA, Erwin CR, Warner BW. Effect of massive small bowel resection on the Bax/Bcl-w ratio and enterocyte apoptosis. J Gastrointest Surg. 2000;4:93-100. [PubMed] [DOI] |
| 37. | Kitamura S, Kondo S, Shinomura Y, Kanayama S, Miyazaki Y, Kiyohara T, Hiraoka S, Matsuzawa Y. Met/HGF receptor modulates bcl-w expression and inhibits apoptosis in human colorectal cancers. Br J Cancer. 2000;83:668-673. [PubMed] [DOI] |
| 38. | Lapham A, Adams JE, Paterson A, Lee M, Brimmell M, Packham G. The Bcl-w promoter is activated by beta-catenin/TCF4 in human colorectal carcinoma cells. Gene. 2009;432:112-127. [PubMed] [DOI] |
| 39. | Bae IH, Park MJ, Yoon SH, Kang SW, Lee SS, Choi KM, Um HD. Bcl-w promotes gastric cancer cell invasion by inducing matrix metalloproteinase-2 expression via phosphoinositide 3-kinase, Akt, and Sp1. Cancer Res. 2006;66:4991-4995. [PubMed] [DOI] |
| 40. | Bae IH, Yoon SH, Lee SB, Park JK, Ho JN, Um HD. Signaling components involved in Bcl-w-induced migration of gastric cancer cells. Cancer Lett. 2009;277:22-28. [PubMed] [DOI] |