修回日期: 2009-08-20
接受日期: 2009-08-24
在线出版日期: 2009-09-08
目的: 探讨疑核对炎症性肠病(inflammatory bowel disease, IBD)相关细胞因子IL-6的调控作用, 以及在IBD发生发展过程中发挥的作用.
方法: 三硝基苯磺酸(TNBS)诱导IBD大鼠动物模型, 采用脑立体定位技术和电生理方法, 应用Real-time PCR方法来检测急性电刺激疑核前后IBD大鼠结肠、胸腺、脾脏、外周血淋巴细胞中IL-6 mRNA表达水平的变化.
结果: 经急性电刺激疑核后, IBD模型大鼠结肠、胸腺、脾脏及外周血淋巴细胞中IL-6的mRNA转录水平均显著升高(3.26E-02±5.83E-03 vs 5.12E-03±6.86E-04, 5.52E-02±9.56E-03 vs 2.04E-02±3.58E-03, 3.42E-02±7.19E-03 vs 2.91E-03±3.41E-04, 8.12E-03±4.24E-04 vs 3.74E-03±5.73E-04, 均P<0.01), 而假刺激组和对照组没有明显变化(P>0.05).
结论: 疑核对IBD大鼠相关细胞因子IL-6具有一定的调控作用, 且以正调控作用为主, 并且在IBD发生发展过程中可能发挥着重要的作用.
引文著录: 袁川评, 王玮, 母连志, 杨占清, 王贤平, 商秀玲, 姜艳福, 张峰, 张雪莉, 刘冬, 柳巨雄. 急性电刺激疑核对TNBS诱导的IBD大鼠IL-6 mRNA表达的影响. 世界华人消化杂志 2009; 17(25): 2566-2570
Revised: August 20, 2009
Accepted: August 24, 2009
Published online: September 8, 2009
AIM: To observe the regulatory effects of the nucleus ambiguous (NA) on interleukin-6 expression in inflammatory bowel disease (IBD) and investigate the role of NA in the development and progression of IBD.
METHODS: Trinitrobenzenesulfonic acid (TNBS) was used to induce colitis in rats. After stereotactic localization of the NA, electrical stimulation was applied. Real-time polymerase chain reaction was utilized to detect the expression of IL-6 mRNA in the colon, thymus, spleen and peripheral blood lymphocytes in rats with TNBS-induced colitis following acute electrical stimulation.
RESULTS: After acute electrical stimulation, the expression levels of IL-6 mRNA significantly increased in the colon, thymus, spleen and peripheral blood lymphocytes in rats with TNBS-induced colitis (3.26E-02 ± 5.83E-03 vs 5.12E-03 ± 6.86E-04, 5.52E-02 ± 9.56E-03 vs 2.04E-02 ± 3.58E-03, 3.42E-02 ± 7.19E-03 vs 2.91E-03 ± 3.41E-04 and 8.12E-03 ± 4.24E-04 vs3.74E-03 ± 5.73E-04, respectively; all P < 0.01), whereas those in normal control rats and sham-stimulated rats showed no obvious changes (all P > 0.05).
CONCLUSION: The NA can positively regulate the expression of cytokine IL-6 in IBD rats and may play a regulatory role in the development and progression of IBD.
- Citation: Yuan CP, Wang W, Mu LZ, Yang ZQ, Wang XP, Shang XL, Jiang YF, Zhang F, Zhang XL, Liu D, Liu JX. Acute electrical stimulation of the nucleus ambiguous upregulates the expression of interleukin-6 mRNA in rats with trinitrobenzenesulfonic acid-induced colitis. Shijie Huaren Xiaohua Zazhi 2009; 17(25): 2566-2570
- URL: https://www.wjgnet.com/1009-3079/full/v17/i25/2566.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i25.2566
炎症性肠病(inflammatory bowel disease, IBD)是一种累及胃肠道的慢性炎症性疾病, 目前其病因和发病机制尚不明确, 多数研究[1]认为细胞因子, 尤其是致炎因子与抗炎因子失衡在IBD发病过程中起着极其重要的作用. IL-6被视为细胞因子网络的核心成员之一, 是由多种细胞产生的一种具有多种生物学活性的刺激因子, 其在多种自身免疫及肿瘤疾病中均有异常, 并与这些疾病的病理过程及病情严重程度有关. 为了探讨细胞因子IL-6、IBD、疑核三者之间的联系, 我们利用TNBS诱导IBD大鼠动物模型, 采用脑立体定位技术和电生理方法, 并应用Real-time PCR方法来检测急性电刺激疑核前后IBD大鼠结肠、胸腺、脾脏、外周血淋巴细胞中IL-6 mRNA表达水平的变化, 为进一步探讨IBD的发生发展及其与神经-内分泌-免疫网络的关系提供了实验依据.
未成年♀Wistar大鼠60只, 体质量150±10 g, 清洁级(由吉林大学基础医学部实验动物中心提供), 随机分3组, 空白对照组10只, 模型组50只. 放置于22-24℃、湿度<60%、噪声<50 db的环境中, 分笼饲养, 正常饮水摄食; 5% TNBS购自Sigma公司.
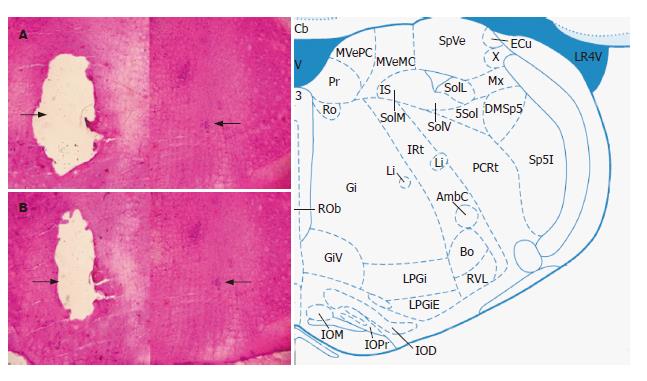
1.2.1 造模及分组: 将5% TNBS与无水乙醇以体积比2:1配成混合液, 按每只大鼠0.1 mL/100 g对模型组进行直肠灌注[2], 对照组给予等体积的生理盐水. 灌注后, 正常进食饮水. 灌注7 d后, 将模型组随机平均分为3组, 分别为对照组、假刺激组和刺激组. 分别将正常组、模型对照组、假刺激组和刺激组大鼠进行脑立体定位. 参考Gerge et al[3]定位大鼠疑核. 根据图谱, 疑核密集区的坐标为Bregma(-12.00)-(-12.84) mm, 左右1.98-2.38 mm, 深度9.22-9.68 mm. 按照坐标, 采用大脑立体定位, 将刺激电极(直径0.2 mm)深入大脑内部疑核位置. 用刺激器进行电刺激(刺激参数: 波宽5 ms, 频率100 Hz, 电流强度50-100 μA, 持续时间60 s). 待1 h后, 改变电流方向, 并将电流强度调至200 μA, 通直流电10 s烧毁刺激的疑核位置[4], 作为标记. 然后通过心脏采血进行淋巴细胞的分离, 快速取大鼠结肠、胸腺、脾脏组织, 冷冻于液氮中, 用于后期的Real-time PCR的实验; 并打开头颅, 暴露并取出大脑, 快速冷冻于预冷的正己烷中. 用冰冻切片机做30 μm冠状切片, 进行常规HE染色.
1.2.2 IL-6和GAPDH的引物和探针引物的设计: 根据GenBank中大鼠IL-6、GAPDH的基因序列设计引物见表1. 引物均由上海生物工程技术有限公司合成.
| 基因 | 引物和探针 | 序列(5'-3') | 片段大小(bp) |
| GAPDH | F | CTGACCTGCCGTCTGGAGAA | 95 |
| R | TAGCCCAGGATGCCCTTGAG | ||
| P | CCTCGGACGCCTGCTTCACCACCT | ||
| IL-6 | F | GCCCTTCAGGAACAGCTATGA | 80 |
| R | TGTCAACAACATCAGTCCCAAGA | ||
| P | CTCTCCGCAAGAGACTTCCAGCCAGTT |
1.2.3 大鼠IL-6和GAPDH的克隆: 按照TRIzol使用说明提取大鼠结肠、胸腺、脾脏及淋巴细胞总RNA. 以各基因特异性引物进行反转录和PCR扩增, 其中反转录体系为: 总RNA 2 μL, Oligo-dT Primer(10 μmol/L)1.0 μL, DEPC H2O 9.5 μL, 5×Buffer 4.0 μL, dNTP Mixture(2.5 mmol/L) 2.0 μL, Reverse Transcriptase(5 U/μL) 1.0 μL, Rnase Inhibitor(40 U/μL) 0.5 μL. 混匀后置于42℃水浴90 min, 90℃水浴5 min, 冰浴冷却备用. PCR扩增反应体系为: H2O 17.5 μL, 10×PCR Buffer 2.5 μL, dNTP Mixture(2.5 mmol/L) 2 μL, 上下游引物(10 μmol/L)各1 μL, 反转录产物1 μL, Ex Taq(5 U/μL)0.1 μL. 反应条件为: 95℃预变性3 min; 95℃变性30 s, 62℃退火45 s, 72℃延伸30 s, 35个循环; 72℃延伸5 min. 并将获得的基因片段连接至pMD18-T, 进行PCR鉴定及测序.
1.2.4 IL-6 mRNA水平的定量检测: 对鉴定正确的GAPDH和IL-6质粒重新转化扩增, 提取质粒, 进行梯度稀释, 制作Real-time PCR标准曲线. 反应体系为: 反转录产物1 μL, Taqman Real-time PCR Master Mix 12.5 μL, 上下游引物及探针各1 μL, H2O 8.5 μL. 反应条件: 95 ℃预变性3 min; 95℃变性30 s, 62℃退火45 s, 72℃延伸30 s, 35个循环; 72℃延伸5 min. 将备好的结肠、胸腺、脾脏及淋巴细胞的样品分别进行Real-time PCR检测. 用建立的荧光定量PCR测定, 并绘制出标准曲线给出标准曲线的表达式. 他们分别为: GAPDH: y = -3.174230x+32.527992, R2 = 0.999347; IL-6: y = -3.53097x+32.527992, R2 = 0.999279. 我们的实验结果采用相对定量即IL-6初始浓度/GAPDH初始浓度表示, 根据样品荧光定量扩增曲线和SPSS13.0软件分析, 得出急性电刺激疑核前后IL-6, GAPDH mRNA在IBD大鼠不同组织及外周血淋巴细胞中的表达.
统计学处理 各组数据结果以mean±SD表示. 统计用SPSS13.0软件包, 实验结果进行单因素方差分析和LSD检验.
将疑核定位后的冰冻切片进行HE染色, 图片左侧的空白位置就是疑核烧毁部位, 而右侧箭头所指即为疑核部位 (图1).
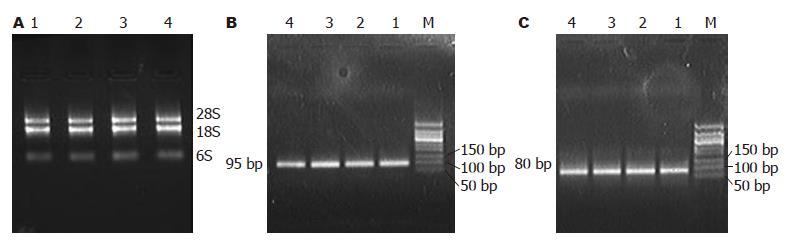
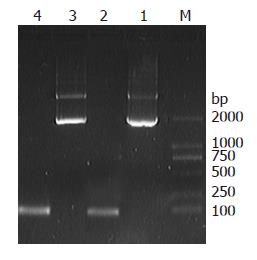
成功提取大鼠结肠、胸腺、脾脏及淋巴细胞总RNA, 电泳后, 在紫外灯下可见28S、18S、6S 3条清晰的条带(图2A). 以结肠、胸腺、脾脏及外周血淋巴细胞总RNA为模板, 以GAPDH、IL-6基因特异性引物进行反转录和PCR扩增, 分别获得了95、80 bp的基因片段, 与预期目的片段大小一致(图2B-C). 分别将PCR产物连接转化, 提取质粒, 并进行质粒的PCR鉴定(图3).
急性电刺激疑核前后IL-6, GAPDH mRNA在IBD大鼠不同组织及外周血淋巴细胞中的表达见表2.
| 组织 | 对照组 | 假刺激组 | 刺激组 |
| 结肠 | |||
| 正常组 | 1.41E-04±3.49E-05 | 1.57E-04±1.00E-05 | 2.35E-04±3.94E-05 |
| 模型组 | 5.12E-03±6.86E-04 | 3.98E-03±5.72E-04 | 3.26E-02±5.83E-03b |
| 胸腺 | |||
| 正常组 | 4.69E-03±8.27E-04 | 5.37E-03±7.74E-04 | 8.95E-03±7.41E-04a |
| 模型组 | 2.04E-02±3.58E-03 | 1.41E-02±4.12E-03 | 5.52E-02±9.56E-03b |
| 脾脏 | |||
| 正常组 | 7.71E-04±8.06E-05 | 7.10E-04±7.27E-05 | 1.60E-03±2.56E-04 |
| 模型组 | 2.91E-03±3.41E-04 | 3.44E-03±4.81E-04 | 3.42E-02±7.19E-03b |
| 外周血淋巴细胞 | |||
| 正常组 | 8.25E-04±1.62E-04 | 7.65E-04±3.80E-05 | 1.73E-03±1.25E-04b |
| 模型组 | 3.74E-03±5.73E-04 | 3.62E-03±2.95E-04 | 8.12E-03±4.24E-04b |
IBD是一种病因未明的慢性非特异性的肠道炎症性疾病, 包含两个独立的疾病, 溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD). 他可能与多种因素有关, 目前仍假设由遗传易感性、胃肠道益生菌与致病菌失衡、肠上皮细胞完整性受损以及宿主免疫功能失调等综合因素的作用而致病[1]. 而神经内分泌免疫调节网络已逐渐为大家所认识, 中枢神经系统可通过下丘脑-垂体-肾上腺轴和交感神经系统广泛地影响机体免疫和内分泌系统[5]. 延髓疑核是一个特殊的内脏神经核团, 属于迷走神经核, 含有多种神经元, 形态学研究表明: 支配胃的迷走神经的节前神经元大部分位于迷走神经运动背核(DMV), 一小部分位于疑核(NA). 大量资料表明: 来自疑核的神经元纤维主要支配着胃肠道的平滑肌[6-7]. 许多研究表明, IBD的发生与多种细胞因子的作用关系密切. 细胞因子(cytokine, CK)是多种细胞所分泌的, 能调节细胞生化分化、调节免疫功能、参与炎症发生和创伤愈合等小分子多肽的统称[8-9]. 其中IL-6是某些自身免疫性疾病中的关键性炎症因子, 与许多疾病的发生与转归密切相关[10-12]. 因而, IL-6在慢性肠道炎性反应的发病机制中起着至关重要的作用[13-14]. 本研究发现, 在未刺激情况下, 模型组结肠、胸腺、脾脏及外周血淋巴细胞中IL-6的mRNA转录水平均高于正常组. 因为IL-6在急性炎症反应中的作用主要表现为多种细胞的促炎作用和诱导肝组织产生急性反应蛋白, 故活动期IBD大鼠在结肠等组织中IL-6水平比正常大鼠显著升高[15]. 然而急性电刺激疑核后, 模型组结肠、胸腺、脾脏及外周血淋巴细胞中IL-6的mRNA转录水平均显著高于假刺激组和对照组, 证明在这些组织中IL-6的表达量经疑核电刺激后有明显升高, 其中在胸腺中最为明显. 因为T细胞由一群功能不同的异质性淋巴细胞组成, 并在中枢淋巴器官胸腺内分化成熟为Th1、Th2和Th3三种亚群后再运送到淋巴结和脾脏等免疫器官[16]. 因而在刺激疑核后, 模型组胸腺中分泌的IL-6的表达水平理应明显高于其他组织器官. 另外, 在脾脏和结肠组织中, IL-6的表达水平和变化趋势几乎一致. 脾脏是机体最大的免疫器官, 含有大量的淋巴细胞和巨噬细胞, 是细胞免疫和体液免疫的中心. 经急性电刺激模型组疑核, Th2细胞通过血液循环从胸腺运送至脾脏和结肠组织中产生大量的促炎因子IL-6, 从而介导体液免疫应答[14]. 外周血液中的淋巴细胞由于不断的运送至结肠和脾脏等免疫器官, 因此在外周血液中由Th2细胞产生的IL-6的升高幅度低于结肠组织和其他免疫器官. 但从整体变化趋势来看, 急性电刺激疑核后, 模型组结肠等组织中IL-6的mRNA转录水平均显著高于假刺激组和对照组, 说明在IBD中, 疑核对IL-6呈现正调控作用. 使其表达量显著升高, 但具体的调控机制还有待于我们进一步研究.
总之, 该实验为进一步探讨IBD的发生发展与神经-内分泌-免疫网络的关系提供了实验依据, 并很可能为IBD的防治提供新的思路.
IBD是一种在我国及欧美等诸多国家极为普遍得慢性胃肠道疾病. IBD的病因和发病机制尚未明确, 目前认为免疫因素, 特别是Th1/Th2免疫应答失衡是引起IBD发病的主要原因之一.
杜群, 副研究员, 广州中医药大学脾胃研究所药理室; 王小众, 教授, 福建医科大学附属协和医院消化内科.
延髓疑核是一特殊的内脏神经核团, 他与中枢神经系统和外周器官建立着广泛的神经联系, 并且在调节T细胞介导的免疫中发挥重要作用.
李巨浪 et al研究发现急性电刺激家兔疑核, PHA诱导的外周血淋巴细胞转化活动明显增强, 并且在刺激后其外周学T淋巴细胞百分率明显提高. 梅英武 et al研究发现急性电刺激大鼠疑核, 可使脾脏淋巴细胞增殖, 并使其分泌IL-2、IL-6的能力明显增强.
本文从神经-内分泌-免疫调节网络和免疫稳态调节的角度出发, 探讨了疑核与IBD之间的关系.
本文研究疑核对IBD相关细胞因子IL-6的调控作用, 以期为探讨IBD的发生发展及其与神经-内分泌-免疫网络的关系奠定基础, 为进一步丰富和完善神经-内分泌-免疫网络学说提供实验依据, 为IBD的防治提供新的思路.
疑核: 属迷走神经核, 是一个特殊的内脏运动核, 位于延髓腹外侧的网状结构中, 内含肾上腺素能神经元、乙酰胆碱能神经元、肽能神经元等多种神经元. 他与中枢神经系统和外周器官建立着广泛的神经联系.
本文观察急性电刺激疑核对TNBS诱导的IBD大鼠IL-6 mRNA表达水平的影响, 具有较好的科学意义, 文章方法较先进, 数据可信,讨论得当.
编辑: 李军亮 电编:吴鹏朕
| 1. | 邓 长生, 夏 冰. 炎症性肠病. 第2版. 北京: 人民卫生出版社 2006; 58-73. |
| 3. | Gerge P, Charles W. The rat brain in stereotaxic coordinates. San Diego: ELISEVIER Academic Press 2007; 165-190. |
| 5. | Wrona D. Neural-immune interactions: an integrative view of the bidirectional relationship between the brain and immune systems. J Neuroimmunol. 2006;172:38-58. [PubMed] [DOI] |
| 6. | Chiocchetti R, Clavenzani P, Barazzoni AM, Grandis A, Bombardi C, Costerbosa GL, Petrosino G, Avoni GB, Bortolami R. Viscerotopic representation of the subdiaphragmatic tracts of the digestive apparatus within the vagus complex in the sheep. Brain Res. 2003;961:32-44. [PubMed] [DOI] |
| 8. | Goral V, Celenk T, Kaplan A, Sit D. Plasma cytokine levels in ulcerative colitis. Hepatogastroenterology. 2007;54:1130-1133. [PubMed] [DOI] |
| 9. | Petrović-Rackov L. Cytokines in rheumatoid arthritis and osteoarthrosis. Med Pregl. 2005;58:245-251. [PubMed] [DOI] |
| 11. | Pecoits-Filho R, Lindholm B, Axelsson J, Stenvinkel P. Update on interleukin-6 and its role in chronic renal failure. Nephrol Dial Transplant. 2003;18:1042-1045. [PubMed] [DOI] |
| 12. | Hong DS, Angelo LS, Kurzrock R. Interleukin-6 and its receptor in cancer: implications for Translational Therapeutics. Cancer. 2007;110:1911-1928. [PubMed] [DOI] |
| 13. | Reddy KP, Markowitz JE, Ruchelli ED, Baldassano RN, Brown KA. Lamina propria and circulating interleukin-8 in newly and previously diagnosed pediatric inflammatory bowel disease patients. Dig Dis Sci. 2007;52:365-372. [PubMed] [DOI] |
| 14. | Newton C, Klein T, Friedman H. The role of macrophages in THC-induced alteration of the cytokine network. Adv Exp Med Biol. 1998;437:207-214. [PubMed] |
| 15. | Feister HA, Auerbach BJ, Cole LA, Krause BR, Karathanasis SK. Identification of an IL-6 response element in the human LCAT promoter. J Lipid Res. 2002;43:960-970. [PubMed] |
| 16. | Cardillo MR, Ippoliti F. IL-6, IL-10 and HSP-90 expression in tissue microarrays from human prostate cancer assessed by computer-assisted image analysis. Anticancer Res. 2006;26:3409-3416. [PubMed] |