修回日期: 2009-08-22
接受日期: 2009-08-24
在线出版日期: 2009-09-08
目的: 探讨一种简便、高效的大鼠离体肝脏分离Kupffer细胞(KCs)及原代培养的方法.
方法: 采用大鼠肝脏离体Ⅳ型胶原酶灌注, 剪碎肝脏, 37℃消化30 min, 低速离心去除肝细胞, Percoll不连续密度梯度离心和选择性贴壁的方法分离KCs. 通过墨汁吞噬实验和ED2免疫细胞化学来鉴定KCs.
结果: 分离的KCs的得率在细胞贴壁前(2.1±0.3)×106/g肝脏、贴壁后(1.5±0.1)×106/g肝脏, 用0.4%台盼蓝染色, 活率大于92%, ED2染色阳性的细胞达90%以上, 分离的细胞培养后功能完整并延伸呈不规则型.
结论: 本实验建立的大鼠肝脏KCs的分离培养方法简便、高效、稳定, 培养的细胞具有良好的生物学性状, 为进一步研究提供基础.
引文著录: 曾仲, 黄汉飞, 宋飞, 段键. 体外灌注法分离大鼠肝脏Kupffer细胞及原代培养. 世界华人消化杂志 2009; 17(25): 2550-2554
Revised: August 22, 2009
Accepted: August 24, 2009
Published online: September 8, 2009
AIM: To explore a convenient and effective method for isolation and primary culture of rat Kupffer cells (KCs) in vitro.
METHODS: Ex vivo rat liver tissue was perfused with collagenase IV and diced into small pieces. The diced tissue was digested for 30 min at 37℃and centrifuged to remove hepatocytes. KCs were then separated by means of Percoll density gradient centrifugation and selective adherence. Phagocytosis assay and immunocytochemistry for ED2 were used to identify cells isolated.
RESULTS: The average cell yield per gram of liver before plastic adherence was (2.1 ± 0.3) × 106, and (1.5 ± 0.1) × 106following plastic adherence. The viability of KCs isolated was higher than 92% as determined by trypan blue exclusion. The purity of KCs, identified by immunocytochemistry for ED2, was higher than 90%. Cultured KCs were functionally intact and exhibited irregular shape.
CONCLUSION: The method for isolation and culture of Kupffer cells by ex vivo perfusion is convenient, efficient and stable. Cultured Kupffer cells retain naive biological characteristics and can be used in future studies.
- Citation: Zeng Z, Huang HF, Song F, Duan J. Isolation of rat Kupffer cells by ex vivo perfusion and their primary culture. Shijie Huaren Xiaohua Zazhi 2009; 17(25): 2550-2554
- URL: https://www.wjgnet.com/1009-3079/full/v17/i25/2550.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i25.2550
Kupffer细胞(kupffer cells, KCs)是位于肝血窦内的巨噬细胞, 寄居于肝血窦内皮细胞之间或之上, 是体内固定型巨噬细胞中最大的群体, 约占肝非实质细胞的30%. KCs在肝脏的炎性反应、缺血再灌注损伤、移植免疫及维持肝脏内环境稳定等方面发挥着重要作用, 体外原代培养是探讨其特定功能和阐明作用机制的最有效方式. Knook et al[1]首次从大鼠肝脏分离出KCs, 但原位灌注的方法操作较困难, 经过改进后也产生了一些新的分离方法, 但对于离体肝脏组织的KCs分离报道较少. 我们参照Valatas et al[2]和Alabraba et al[3]的方法并加以改进, 摸索出一套简便、稳定而有效的体外灌注法分离大鼠肝脏KCs及其培养方法, 为进一步研究奠定了基础.
♂SD大鼠, 清洁级, 体质量200-250 g, 由中国人民解放军第三军医大学附属大坪医院实验动物中心提供; HBSS液(无Ca2+, Mg2+)购自德国Hyclone公司; 无水CaCl2(分析纯)购自天津市光复精细化工研究所; Ⅳ型胶原酶和HEPES购自美国Sigma公司; Percoll细胞分离液购自瑞典Pharmacia公司; RPMI 1640培养基和胎牛血清均购自美国Gibco公司; 青链霉素混合液购自德国Hyclone公司; 小鼠抗大鼠CD163 mAb(又名ED2)购自英国Serotec公司; 即用型SABC小鼠IgG免疫组织化学试剂盒和DAB显色试剂盒购自武汉博士德生物工程有限公司.
1.2.1 细胞分离液的配置: 100 mg的Ⅳ型胶原酶用200 mL的HBSS溶解, 加无水氯化钙0.066 g, 即配成Ⅳ型胶原酶组织消化液(含胶原酶0.5 g/L、Ca2+ 3 mmol/L), 0.22 μm滤器过滤除菌, 存放4℃冰箱备用. 取Percoll原液90 mL高压灭菌, 加入1.5 mol/L灭菌氯化钠溶液10 mL配成100% Percoll工作液, 然后用100% Percoll工作液与0.15 mol/L灭菌氯化钠溶液以体积比配成30%和60%的Percoll工作液, 存放4℃冰箱.
1.2.2 KCs的分离: 取♂SD大鼠1只, 乙醚吸入麻醉后碘伏消毒腹部皮毛, 以十字型切口打开腹腔, 将胃及肠管推向大鼠的左侧, 暴露出门静脉. 剪开膈肌和膈上下腔静脉, 使大鼠体内血液流入胸腔, 肝脏颜色变成暗红, 此时经门静脉推注生理盐水20 mL, 驱除肝脏内的淤血, 肝脏会逐渐变成土黄色. 取最大的左侧一整叶肝脏用于分离KCs(注: 从肝静脉分支开口处切下, 保留该叶完整的肝静脉开口), 将取下的肝脏放于无菌的培养皿中. 在无菌操作台上用37℃ HBSS液20 mL经肝静脉开口继续反复冲洗肝脏, 进一步冲出残留的血液, 至肝脏变成灰白色. 将肝脏转移到另一培养皿中, 加入预热至37℃的Ⅳ型胶原酶消化液20 mL, 直接用注射器抽取消化液经门静脉开口反复冲洗肝脏, 使肝脏体积增大, 组织松散. 肝脏用眼科小剪刀剪碎至2-3 mm3, 胶原酶消化液与肝脏组织一起转移至50 mL离心管中, 放入恒温振荡器中振荡消化30 min(200 r/min, 37℃). 振荡消化液经200目不锈钢筛网过滤, 滤除未完全消化掉的组织, 收集滤液以600 r/min, 4℃离心3 min, 使肝细胞沉淀. 收集上清于另一50 mL离心管中, 1500 r/min, 4℃离心5 min, 沉淀肝脏非实质细胞, 弃上清, 沉淀用30% Percoll工作液重悬. 取2支15 mL的离心管, 最下层分别铺上60% Percoll工作液3 mL, 中间层为含30% Percoll工作液的肝非实质细胞悬液3 mL, 最上层铺HBSS液3 mL, 加样时沿离心管管壁慢慢加入, 避免各层之间相混合. 两离心管以1500 r/min, 4 ℃离心15 min, 取出后可以看到30% Percoll与60% Percoll液界面间有一膜状细胞层. 小心吸取两离心管界面层细胞于另一50 mL离心管中, 用HBSS液10 mL稀释, 1500 r/min, 4℃离心5 min使细胞沉淀于管底.
1.2.3 KCs的培养与纯化: 将离心后所得的细胞沉淀用RPMI 1640培养液(含HEPES 10 mmol/L, 100 mL/L灭活胎牛血清, 青霉素100 kU/L, 链霉素100 mg/L)重悬后以2×109/L浓度接种于培养瓶中, 放于50 mL/L CO2, 37℃培养箱中培养. 培养2 h后, 取出培养瓶, 用瓶内的培养液轻轻冲洗, 去除未贴壁细胞, 更换新的培养液继续放回培养箱中, 即可得到纯化后的肝脏KCs.
1.2.4 KCs的鉴定: 分离的KCs得率和活性测定, 取出5滴细胞悬液加入5滴0.4%台盼蓝染液, 将待测细胞悬液吹打均匀后滴入计数板计数, 活细胞不被染色. 在细胞培养液中加入少量碳素墨水, 6-12 h后显微镜下观察细胞吞噬碳素颗粒的情况. 收集梯度离心后不同层面的细胞与培养后的KCs使用ED2 mAb进行免疫细胞化学鉴定.
Percoll密度梯度离心后分层明显, 从上依次是: HBSS层、细胞碎片层、30% Percoll层(富含星形细胞和内皮细胞)、富含KCs层、60% Percoll层(少量KCs和肝细胞)及沉淀(红细胞和肝细胞). 经梯度离心后KCs的得率为(2.1±0.3)×106/g肝脏, 选择性贴壁后为(1.5±0.1)×106/g肝脏, 经0.4%台盼蓝染色, 活率大于92%. 刚分离出来的KCs在328 nm波长的激发光下不发出荧光, 而肝星形细胞则会发出蓝绿色荧光.
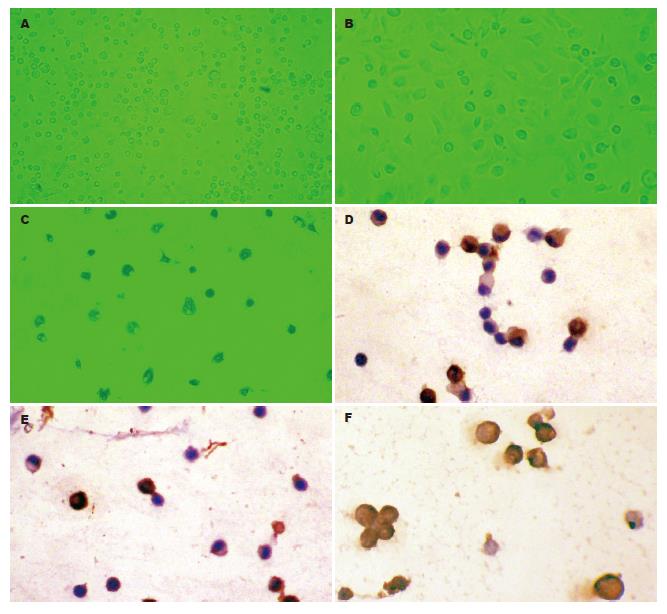
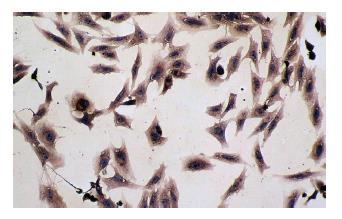
刚分离的KCs呈圆形, 体积较小, 折光性强, 培养15 min后开始贴壁, 1-2 h后贴壁牢靠(图1A). 培养24 h后, 细胞体积开始增大, 延伸成三角形与多边形等不规则形状, 2-3 d后开始伸出伪足, 可成梭形(图1B). 随着培养时间的延长, KCs内吞噬颗粒(细胞碎片)会逐渐增多, 间隔1-2 d换液1次, 培养2 wk后细胞仍能成活. 在细胞培养液中加入碳素6-12 h后, 镜下KCs胞质内可见吞噬大量的碳素颗粒, 细胞核衬托得更加清晰(图1C).
KCs在肝脏中所占的比例少, 而且肝非实质细胞间大小相似, 分离得到高纯度的KCs比较困难. 目前, 国内外使用较多的有密度梯度离心法[4-10]、离心淘析法[11-13]及流式细胞术[14-15]. 离心淘析法的优点在于能提高KCs的纯度, 获取的细胞数量也很可观, 但需要昂贵的设备, 在国内很少使用; 流式细胞术所得到的细胞纯度最高, 但细胞的数量有限, 不适合需求量大的实验, 且成本也较高, 应用受到限制; 密度梯度离心法在国内外应用最多, 主要是先用酶使肝脏消化成细胞悬液, 再通过密度梯度离心将不同密度的细胞分开, 但获得的KCs数量和纯度有很大的差异.
我们采用肝脏离体灌注消化法, 完整取下一叶肝脏, Ⅳ型胶原酶溶液经肝静脉开口处反复冲洗肝脏, 使肝脏体积增大, 结构松散, 再将肝脏剪碎消化. 国内外大多采用链霉蛋白酶E和Ⅳ型胶原酶联合消化法[3,16], 链霉蛋白酶E能选择性的破坏肝细胞, 消化后能直接得到肝非实质细胞悬液[13,17-19]. 本实验弃用了链霉蛋白酶E, 因为肝细胞破坏后会释放大量的DNA, 使细胞间形成粘连、聚集成絮状物, 影响细胞的分离效率和产率, 往往需要与DNA酶Ⅰ一起使用, 而且DNA酶Ⅰ的用量很大[20]. 另外, 有报道[21]认为链霉蛋白酶E在破坏肝细胞的同时, 也对肝非实质细胞有影响, 可破坏KCs表面CD14分子的表达使KCs在初分离的24 h内CD14的表达很少, 影响KCs的功能. 我们仅使用Ⅳ型胶原酶也能将肝脏消化得很好, 钙离子能增加胶原酶活性, 而且通过差速离心很容易把肝细胞去除, 可以去除肝细胞的80%-90%. 也有报道直接将肝脏剪碎消化[3], 省去肝脏离体冲洗步骤, 我们通过实验发现, 肝脏离体冲洗灌注, 可以大大提升胶原酶的消化效果. 因为冲洗可以使肝脏体积增大, 更易于剪碎, 使相同体积的组织较不冲洗的实际组织小, 冲洗可以使胶原酶进入肝脏的微循环, 增加接触面积, 有利于其充分发挥消化作用.
获得肝脏非实质细胞后, 通过不连续密度梯度离心可以将KCs从其他非实质细胞中分离出来[22-24], 密度梯度离心使用的细胞分离液有多种, 其中以Percoll细胞分离液应用最普遍, 具有操作方便和性能稳定等优点, 分离细胞的产率和纯度都令人满意[25-26]. 我们采用的是30% Percoll工作液(1.040 kg/L)和60% Percoll工作液(1.075 kg/L), 虽然没有使用链霉蛋白酶E, 但在振荡消化过程中以及胶原酶消化过度都会导致少量细胞破坏, 使用30% Percoll重悬肝非实质细胞, 可以避免细胞碎片层及少量的DNA絮状物阻止KCs的沉降, 提高了KCs的产率. 也有文献报道使用30% Percoll和70% Percoll两种密度梯度分离[27], 我们发现该方法两层之间的细胞会有一定量的肝细胞污染, 可能是不同批次Percoll细胞分离液密度有细微差异所致. KCs与其他肝非实质细胞在体积和密度上有一部分重叠, 准确配置细胞分离液的密度很关键, 可以最大化的去除其他肝非实质细胞, 但要得到高纯度的KCs, 还要进一步纯化. KCs与其他肝非实质细胞的贴壁时间有较大差异, 培养1-2 h可以完全贴壁牢靠, 而其他细胞贴壁时间较长, 选择性贴壁是常用的方法. KCs培养时应使用灭活的胎牛血清, 没有灭活的血清含有一些补体成分, 激活的补体很容易导致KCs衰老、死亡[3]. KCs培养几乎不分裂, 分离出多少就只能培养多少, 得到高产量和高纯度的细胞尤其重要.
我们摸索的这套方法可以用于KCs的进一步研究. 与肝脏原位灌注消化法相比, 离体冲洗消化可以大大节约酶的用量. 使用部分肝脏提取KCs, 适合用于多次少量的获取细胞, 在不能使用完整的肝脏标本提取细胞时尤为适用.
KCs是肝脏最重要的非实质细胞之一, 在肝脏的炎性反应、缺血再灌注损伤、移植免疫、肝脏纤维化与再生等方面发挥着重要作用, 分离并培养高纯度的KCs是研究其生物性状的基础.
龚建平, 教授, 重庆医科大学附属第二医院肝胆外科.
KCs在肝脏中所占的比例少, 而肝非实质细胞间大小形态相似, 分离KCs的方法也有很多种, 不同方法获得的KCs数量和纯度都有很大的差异.
Alabraba et al曾报道通过链霉蛋白酶消化人肝脏和密度梯度离心的方法获得较高纯度的KCs, 提供了一种新的以非灌注为基础的获得KCs的方法.
本研究通过离体灌注, 一步消化和不连续密度梯度离心方法, 分离获得较多数量和高纯度的KCs, 使用的方法操作简便, 可操作性强.
本研究通过离体灌注消化肝脏, 简化操作流程, 降低成本, 可使用部分肝脏提取KCs, 适合用于多次少量的获取细胞, 在不能使用完整的肝脏标本提取细胞时更为适用.
不连续密度梯度离心法: 用一定的介质在离心管内形成不连续的密度梯度, 将细胞混悬液或匀浆置于介质的顶部, 离心后不同大小、不同形状、有一定沉降系数差异的颗粒在密度梯度液中形成若干条界面清楚的不连续区带.
本研究建立的大鼠肝脏KCs的分离培养方法简便、高效、稳定, 培养的细胞具有良好的生物学性状, 对实验研究有一定指导意义.
编辑: 李军亮 电编:吴鹏朕
| 1. | Knook DL, Sleyster EC. Separation of Kupffer and endothelial cells of the rat liver by centrifugal elutriation. Exp Cell Res. 1976;99:444-449. [PubMed] [DOI] |
| 2. | Valatas V, Xidakis C, Roumpaki H, Kolios G, Kouroumalis EA. Isolation of rat Kupffer cells: a combined methodology for highly purified primary cultures. Cell Biol Int. 2003;27:67-73. [PubMed] [DOI] |
| 3. | Alabraba EB, Curbishley SM, Lai WK, Wigmore SJ, Adams DH, Afford SC. A new approach to isolation and culture of human Kupffer cells. J Immunol Methods. 2007;326:139-144. [PubMed] [DOI] |
| 4. | Liu H, Cao H, Wu ZY. Isolation of Kupffer cells and their suppressive effects on T lymphocyte growth in rat orthotopic liver transplantation. World J Gastroenterol. 2007;13:3133-3136. [PubMed] |
| 5. | Hirsch J, Hansen KC, Choi S, Noh J, Hirose R, Roberts JP, Matthay MA, Burlingame AL, Maher JJ, Niemann CU. Warm ischemia-induced alterations in oxidative and inflammatory proteins in hepatic Kupffer cells in rats. Mol Cell Proteomics. 2006;5:979-986. [PubMed] [DOI] |
| 6. | 郑 雪莲, 严 茂林, 廖 大清, 周 总光, 陈 珂玲. 应用联合酶建立BALB/c鼠枯否氏细胞体外分离培养方法. 四川大学学报 (医学版). 2008;39:298-301. |
| 8. | Qiu DK, Hua J, Li JQ, Li EL. CD14 expression on Kupffer cells during the course of carbon tetrachloride-mediated liver injury. Chin J Dig Dis. 2005;6:137-141. [PubMed] [DOI] |
| 9. | 蔡 伟, 李 非. 大鼠肝脏Kupffer细胞的分离, 纯化. 中国普外基础与临床杂志. 2007;14:292-295. |
| 10. | Tanimoto A, Wakabayashi G, Shinmoto H, Okuda S, Kuribayashi S, Mukai M. The mechanism of ring enhancement in hepatocellular carcinoma on superparamagnetic iron oxide-enhanced T1-weighted images: an investigation into peritumoral Kupffer cells. J Magn Reson Imaging. 2005;21:230-236. [PubMed] [DOI] |
| 11. | Murthi P, Kalionis B, Ghabrial H, Dunlop ME, Smallwood RA, Sewell RB. Kupffer cell function during the erythocytic stage of malaria. J Gastroenterol Hepatol. 2006;21:313-318. [PubMed] [DOI] |
| 12. | Dory D, Echchannaoui H, Letiembre M, Ferracin F, Pieters J, Adachi Y, Akashi S, Zimmerli W, Landmann R. Generation and functional characterization of a clonal murine periportal Kupffer cell line from H-2Kb -tsA58 mice. J Leukoc Biol. 2003;74:49-59. [PubMed] [DOI] |
| 13. | Lee CM, Knight B, Yeoh GC, Ramm GA, Olynyk JK. Lymphotoxin-beta production following bile duct ligation: possible role for Kupffer cells. J Gastroenterol Hepatol. 2005;20:1762-1768. [PubMed] [DOI] |
| 14. | Tomiyama K, Ikeda A, Ueki S, Nakao A, Stolz DB, Koike Y, Afrazi A, Gandhi C, Tokita D, Geller DA. Inhibition of Kupffer cell-mediated early proinflammatory response with carbon monoxide in transplant-induced hepatic ischemia/reperfusion injury in rats. Hepatology. 2008;48:1608-1620. [PubMed] [DOI] |
| 15. | You Q, Cheng L, Kedl RM, Ju C. Mechanism of T cell tolerance induction by murine hepatic Kupffer cells. Hepatology. 2008;48:978-990. [PubMed] [DOI] |
| 17. | Burlak C, Twining LM, Rees MA. Carbohydrates borne on human glycophorin A are recognized by porcine Kupffer cells. Transplantation. 2005;80:66-74. [PubMed] [DOI] |
| 18. | Yao HW, Li J, Chen JQ, Xu SY. Leflunomide attenuates hepatocyte injury by inhibiting Kupffer cells. World J Gastroenterol. 2004;10:1608-1611. [PubMed] |
| 19. | Kiemer AK, Baron A, Gerbes AL, Bilzer M, Vollmar AM. The atrial natriuretic peptide as a regulator of Kupffer cell functions. Shock. 2002;17:365-371. [PubMed] [DOI] |
| 20. | Zhang X, Yu WP, Gao L, Wei KB, Ju JL, Xu JZ. Effects of lipopolysaccharides stimulated Kupffer cells on activation of rat hepatic stellate cells. World J Gastroenterol. 2004;10:610-613. [PubMed] |
| 21. | Ikejima K, Enomoto N, Seabra V, Ikejima A, Brenner DA, Thurman RG. Pronase destroys the lipopolysaccharide receptor CD14 on Kupffer cells. Am J Physiol. 1999;276:G591-G598. [PubMed] |
| 23. | Xidakis C, Ljumovic D, Manousou P, Notas G, Valatas V, Kolios G, Kouroumalis E. Production of pro- and anti-fibrotic agents by rat Kupffer cells; the effect of octreotide. Dig Dis Sci. 2005;50:935-941. [PubMed] [DOI] |
| 24. | Xidakis C, Mastrodimou N, Notas G, Renieri E, Kolios G, Kouroumalis E, Thermos K. RT-PCR and immunocytochemistry studies support the presence of somatostatin, cortistatin and somatostatin receptor subtypes in rat Kupffer cells. Regul Pept. 2007;143:76-82. [PubMed] [DOI] |
| 25. | Souza LJ, Shio MT, Molan NA, Machado MC, Jancar S. Acute pancreatitis affects non-parenchymal liver cells by a mechanism dependent on platelet-activating factor. Pancreatology. 2007;7:67-73. [PubMed] [DOI] |
| 26. | Marangoni A, Aldini R, Sambri V, Giacani L, Di Leo K, Cevenini R. Production of tumor necrosis factor alpha by Treponema pallidum, Borrelia burgdorferi s.l., and Leptospira interrogans in isolated rat Kupffer cells. FEMS Immunol Med Microbiol. 2004;40:187-191. [PubMed] [DOI] |