修回日期: 2009-07-31
接受日期: 2009-08-03
在线出版日期: 2009-08-28
目的: 探讨JDP2蛋白在胰腺癌组织中的表达及其与胰腺癌临床病理特征的关系.
方法: 利用Western blot检测36例胰腺癌手术切除标本与对应的癌旁胰腺组织中JDP2蛋白的表达. 用Log-rank检验分析JDP2蛋白表达与预后的关系.
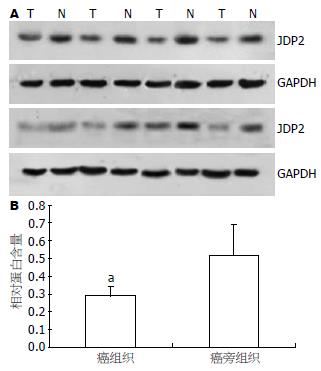
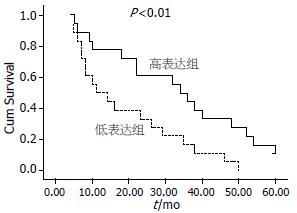
结果: JDP2在胰腺癌中的表达与对应癌旁胰腺组织相比显著下降(0.287±0.052 vs 0.517±0.172, P<0.05). JDP2在胰腺癌中的表达与肿瘤大小、病理分级、肿瘤累及范围、淋巴结转移、远处转移和临床分期有明显差异(P<0.05), 胰腺癌中JDP2的表达水平下降时, 术后生存时间明显缩短(P<0.01).
结论: JDP2可能与胰腺癌的增殖、侵袭、转移及预后密切相关.
引文著录: 汪海洋, 许元鸿, 郭克建. JDP2与胰腺癌侵袭及转移的相关性. 世界华人消化杂志 2009; 17(24): 2522-2525
Revised: July 31, 2009
Accepted: August 3, 2009
Published online: August 28, 2009
AIM: To investigate the expression and the clinical pathological significance of JDP2 protein in pancreatic cancer.
METHODS: The expression of JDP2 protein in 36 pancreatic cancer tissues and matched non-cancerous adjacent tissues were detected by Western blot. The association between the expression of JDP2 protein and the prognosis of patients were analyzed by Log-rank test.
RESULTS: The expression of JDP2 protein significantly decreased in pancreatic cancer compared with the matched non-cancerous adjacent tissues (0.287 ± 0.052 vs 0.517 ± 0.172, P < 0.05). The expression of JDP2 protein was closely associated with tumor size, histological type, invasion degree, lymph node metastasis, distant metastasis and clinical stage (P < 0.05). The survival time of the patients with low JDP2 expression significantly shortened (P < 0.01).
CONCLUSION: JDP2 may be closely associated with the proliferation, invasion, metastasis and prognosis of pancreatic cancer.
- Citation: Wang HY, Xu YH, Guo KJ. Relationship of JDP2 with invasion and metastasis of pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2009; 17(24): 2522-2525
- URL: https://www.wjgnet.com/1009-3079/full/v17/i24/2522.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i24.2522
Jun二聚化蛋白2(jun dimerization protein 2, JDP2)由163个氨基酸组成, 并含有一个碱性亮氨酸拉链(basic leucine zipper, bZIP)结构, 是转录因子活化蛋白1(activator protein-1, AP-1)家族成员之一, 由c-Jun作为结合蛋白分离[1]. JDP2可以和自身以及c-Jun、JunB、JunD或ATF-2形成二聚体, 并可以抑制Jun、c-Fos和ATF-2等的转录活性, 显示JDP2是一种广泛的AP-1抑制蛋白[1-2]. AP-1是由Jun, Fos或ATF蛋白系列所构成的二聚体, 其功能涉及细胞周期调节, 细胞分化, 凋亡及肿瘤的发生等方面[3-5]. 研究表明, JDP2作为AP-1的抑制蛋白在UV诱导的细胞凋亡, 细胞分化以及肿瘤的发生过程中起重要作用. 但目前为止, 研究JDP2与胰腺癌的关系尚不清楚[6-7]. 本文通过临床标本的检测, 证实JDP2可能在胰腺癌的侵袭和转移中发挥重要作用.
收集2000-02/2003-12中国医科大学附属第一医院36例胰腺癌手术切除标本和对应的癌旁胰腺组织, 所有标本均经病理证实. 胰腺癌患者中, 男23例, 女13例, 年龄50-76(平均62.4)岁. 临床分期采用1987年国际抗癌协会(UICC)的TNM分期: Ⅰ期7例, Ⅱ期10例, Ⅲ期11例, Ⅳ期8例. 所有患者均随访至2008-12, 并记录生存时间. 获取组织后, 立即切块并快速液氮冻存, 保存在-80℃冰箱中. 研究与患者签署知情同意书.
200 mg组织加入800 μL的蛋白裂解液(50 mmol/L Tris2 HCl, pH7.5, 150 mmol/L NaCl, 2 mmol/L EDTA, 1% SDS, 每10 mL加入一片蛋白酶抑制剂), 充分组织匀浆裂解后, 经4℃、12 000 g离心20 min, 取上清液并测定蛋白浓度. 取80 μg蛋白与上样缓冲液混合, 煮沸5 min, 置于SDS变性聚丙烯酰胺凝胶电泳分离, 蛋白通过湿转过夜转移到PVDF膜, 1% BSA封闭4 h后与1:500的羊抗人JDP2多克隆抗体(Santa Cruz公司)于4℃反应过夜, 另用1:10 000的鼠抗人GAPDH mAb(上海康成公司), 作为内参. 加入相应的二抗, 室温下孵育2 h. 抗体检测按试剂盒说明书进行(Amersham公司). 结果经过计算机扫描后定量分析.
统计学处理 使用SPSS13.0软件包进行统计学分析. 组间差异用Mann-Whitney检验. 以JDP2蛋白含量(癌/癌旁)0.56倍为分界值, 将36例胰腺癌患者分成高表达组和低表达组各18例. 各组术后生存以Kaplan-Meier曲线表示, 用Log-rank检验比较两组间差异. P<0.05认为差异有统计学意义.
Western blot检测JDP2蛋白在胰腺癌及其对应癌旁组织中的表达, 发现JDP2在胰腺癌中的表达显著下降. JDP2蛋白在胰腺癌中的相对含量为0.287±0.052, 在对应的癌旁胰腺组织中的相对含量为0.517±0.172, 两组进行比较差异有统计学意义(P<0.05, 图1).
利用JDP2在癌组织与对应癌旁组织的表达比值代表该病例的JDP2含量. 统计学分析胰腺癌组织中的JDP2表达与临床病理特征的关系, JDP2在胰腺癌中的表达与年龄、性别及肿瘤部位无明显差异(P>0.05), 与肿瘤大小、病理分级、肿瘤累及范围、淋巴结转移、远处转移和临床分期有明显差异(Mann-Whitney检验, P<0.05, 表1).
| 分组 | n | JDP2含量癌/癌旁 | P值 |
| 年龄(岁) | |||
| <60 | 19 | 0.58±0.23 | 0.326 |
| ≥60 | 17 | 0.54±0.22 | |
| 性别 | |||
| 男 | 23 | 0.57±0.18 | 0.416 |
| 女 | 13 | 0.52±0.28 | |
| 肿瘤部位 | |||
| 胰头 | 28 | 0.59±0.32 | 0.299 |
| 胰体尾 | 8 | 0.48±0.21 | |
| 病理分级 | |||
| 高分化 | 18 | 0.72±0.30 | 0.042 |
| 中低分化 | 28 | 0.26±0.12 | |
| 肿瘤大小(cm) | |||
| <2.5 | 12 | 0.82±0.49 | 0.023 |
| ≥2.5 | 24 | 0.43±0.21 | |
| 肿瘤累及范围 | |||
| T1-T2 | 25 | 0.69±0.25 | 0.021 |
| T3-T4 | 11 | 0.27±0.12 | |
| 淋巴结转移 | |||
| N0 | 26 | 0.67±0.26 | 0.012 |
| N1 | 10 | 0.26±0.11 | |
| 远处转移 | |||
| M0 | 30 | 0.62±0.37 | 0.020 |
| M1 | 6 | 0.25±0.12 | |
| 临床分期 | |||
| Ⅰ-Ⅱ | 17 | 0.76±0.33 | 0.013 |
| Ⅲ-Ⅳ | 19 | 0.38±0.17 |
将胰腺癌中JDP2的表达水平与术后生存时间进行分析, 发现该蛋白的表达水平和癌旁组织相比降低至0.56倍以下时, 术后生存时间明显缩短(P<0.01, 图2).
胰腺癌作为临床上较常见的消化系统恶性肿瘤, 早期即可局部或远处转移, 大部分患者都无法获得根治性治疗, 预后很差[8-9]. 深入阐明胰腺癌侵袭和转移的分子机制, 在胰腺癌的诊断和治疗中具有重要的临床意义.
Heinrich et al发现, 在他们检测的53例取自七种不同类型恶性肿瘤的标本中, JDP2的表达水平在35.8%的癌组织标本呈不同程度下降, 而只有在5.8%的样品显示相反的结果, 提示JDP2很可能具有抑癌作用[10]. 而JDP2在胰腺癌中的表达研究, 国内外未见报道. 在本研究中, 我们利用Western blot检测JDP2在胰腺癌组织中的表达情况, 结果表明JDP2与邻近的癌旁组织相比, 蛋白表达水平明显下降. 通过统计学分析发现JDP2的表达与肿瘤大小、病理分级、肿瘤累及范围、淋巴结转移、远处转移和临床分期明显相关. 这些结果提示JDP2可能与胰腺癌的增殖、侵袭和转移密切相关. 胰腺癌的发生发展与某些癌基因的激活和抑癌基因的失活以及与诸多生长因子和细胞因子的异常表达有关[1,11-12], 在这些诸多因素中, JDP2很可能作为抑癌基因与Ras, P16, 转化生长因子(transforming growth factor-β, TGF-β), 表皮生长因子(epidermal growth factor, EGF)及白介素-8(interleukin-8, IL-8)的调控有关. Heinrich et al发现JDP2能够明显抑制由Ras诱导的NIH3T3细胞的转化[10]; 另外, 在人角质细胞JDP2可以抑制由Ras和TGF-α协同引起的上皮间质转化(epithelial-to-mesenchymal transition, EMT), 而EMT被认为与肿瘤细胞的高侵袭性有关[13]. 在前列腺癌细胞系, 外源JDP2可通过减少c-Jun诱导JunB的表达, 从而抑制前列腺癌细胞的增殖[11]. 由于JunB能够增加P16的表达[14], JDP2有可能通过调解JunB来维持P16的正常表达. 研究表明, 在胰腺癌细胞系低pH环境可诱导IL-8的持续表达增高, 而如果去除IL-8基因调节区域中的AP-1结合序列, 其表达就没有改变, 说明AP-1是IL-8的关键调控蛋白[15]. 这一结果提示, 作为AP-1的抑制蛋白, JDP2有可能通过抑制IL-8来参与抑制胰腺癌的转移.
除此之外, 本研究发现JDP2的表达水平与胰腺癌术后生存时间密切相关. 因此JDP2有可能成为胰腺癌预后的标志物. 胰腺癌作为一种高度恶性的消化系肿瘤, 进一步阐明JDP2的作用机制和意义可以深入了解胰腺癌恶性生物学行为的机制, 进而采取针对性的干预方案.
JDP2作为AP-1的家族成员之一, 自身以及c-Jun、JunB、JunD或ATF-2形成二聚体, 是一种广泛的AP-1抑制蛋白, 在细胞凋亡, 细胞分化等方面发挥重要作用. 近些年研究表明JDP2可能与肿瘤的发生发展相关, 但至今尚无JDP2与胰腺癌关系的研究.
郝纯毅, 主任医师, 北京肿瘤医院肿瘤外科; 巩鹏, 教授, 大连医科大学附属第一医院普外二科
Heinrich et al发现, 在他们检测的53例取自7种不同类型恶性肿瘤的标本中, JDP2的表达水平在35.8%的癌组织标本呈不同程度下降, 而只有在5.8%的样品显示相反的结果, 提示JDP2很可能具有抑癌作用.
本文探讨JDP2在胰腺癌组织中的表达情况及其与胰腺癌临床病理特征的关系, 为胰腺癌治疗提供新的靶点和预后标志物.
本研究设计合理, 结果可信, 内容具有一定的价值及意义.
编辑: 李军亮 电编:何基才
| 1. | Aronheim A, Zandi E, Hennemann H, Elledge SJ, Karin M. Isolation of an AP-1 repressor by a novel method for detecting protein-protein interactions. Mol Cell Biol. 1997;17:3094-3102. [PubMed] |
| 2. | Jin C, Ugai H, Song J, Murata T, Nili F, Sun K, Horikoshi M, Yokoyama KK. Identification of mouse Jun dimerization protein 2 as a novel repressor of ATF-2. FEBS Lett. 2001;489:34-41. [PubMed] [DOI] |
| 3. | Matthews CP, Colburn NH, Young MR. AP-1 a target for cancer prevention. Curr Cancer Drug Targets. 2007;7:317-324. [PubMed] [DOI] |
| 4. | Moore-Carrasco R, Busquets S, Figueras M, Palanki M, López-Soriano FJ, Argilés JM. Both AP-1 and NF-kappaB seem to be involved in tumour growth in an experimental rat hepatoma. Anticancer Res. 2009;29:1315-1317. [PubMed] |
| 5. | Hasegawa H, Senga T, Ito S, Iwamoto T, Hamaguchi M. A role for AP-1 in matrix metalloproteinase production and invadopodia formation of v-Crk-transformed cells. Exp Cell Res. 2009;315:1384-1392. [PubMed] [DOI] |
| 6. | Lerdrup M, Holmberg C, Dietrich N, Shaulian E, Herdegen T, Jäättelä M, Kallunki T. Depletion of the AP-1 repressor JDP2 induces cell death similar to apoptosis. Biochim Biophys Acta. 2005;1745:29-37. [PubMed] |
| 7. | Ostrovsky O, Bengal E, Aronheim A. Induction of terminal differentiation by the c-Jun dimerization protein JDP2 in C2 myoblasts and rhabdomyosarcoma cells. J Biol Chem. 2002;277:40043-40054. [PubMed] [DOI] |
| 8. | Yachida S, Iacobuzio-Donahue CA. The pathology and genetics of metastatic pancreatic cancer. Arch Pathol Lab Med. 2009;133:413-422. [PubMed] |
| 9. | Embuscado EE, Laheru D, Ricci F, Yun KJ, de Boom Witzel S, Seigel A, Flickinger K, Hidalgo M, Bova GS, Iacobuzio-Donahue CA. Immortalizing the complexity of cancer metastasis: genetic features of lethal metastatic pancreatic cancer obtained from rapid autopsy. Cancer Biol Ther. 2005;4:548-554. [PubMed] |
| 10. | Heinrich R, Livne E, Ben-Izhak O, Aronheim A. The c-Jun dimerization protein 2 inhibits cell transformation and acts as a tumor suppressor gene. J Biol Chem. 2004;279:5708-5715. [PubMed] [DOI] |
| 11. | Ghaneh P, Costello E, Neoptolemos JP. Biology and management of pancreatic cancer. Gut. 2007;56:1134-1152. [PubMed] |
| 12. | Schneider G, Hamacher R, Eser S, Friess H, Schmid RM, Saur D. Molecular biology of pancreatic cancer--new aspects and targets. Anticancer Res. 2008;28:1541-1550. [PubMed] |
| 13. | Davies M, Robinson M, Smith E, Huntley S, Prime S, Paterson I. Induction of an epithelial to mesenchymal transition in human immortal and malignant keratinocytes by TGF-beta1 involves MAPK, Smad and AP-1 signalling pathways. J Cell Biochem. 2005;95:918-931. [PubMed] [DOI] |
| 14. | Eferl R, Wagner EF. AP-1: a double-edged sword in tumorigenesis. Nat Rev Cancer. 2003;3:859-868. [PubMed] [DOI] |
| 15. | Ju KD, Yu JH, Kim H, Kim KH. Role of mitogen-activated protein kinases, NF-kappaB, and AP-1 on cerulein-induced IL-8 expression in pancreatic acinar cells. Ann N Y Acad Sci. 2006;1090:368-374. [PubMed] [DOI] |