修回日期: 2009-07-16
接受日期: 2009-07-20
在线出版日期: 2009-08-28
目的: 探讨血管紧张素原(angiotensinogen, AGT)基因M235T分子变异与肝硬化的关系.
方法: 提取肝硬化患者和正常人白细胞基因组DNA, 通过PCR、限制性片段长度多态性和测序等技术, 观察在正常组和肝硬化组的不同基因型的分布和等位基因频率的差异.
结果: AGT基因 M235T 位点MM、MT和TT基因型的分布在肝硬化组和正常组分别为: 7.8%、40.6%、51.6%与8.0%、59.7%、32.3%, 两组之间不存在差异(χ2 = 5.120, P>0.05).
结论: AGT基因M235T变异可能与肝硬化没有显著关系.
引文著录: 宋淑静, 田敬华, 赵辉, 刘亚楠, 郭杰, 马小亮, 王慧珠. 血管紧张素原基因M235T变异与HBV感染后肝硬化形成的关系. 世界华人消化杂志 2009; 17(24): 2512-2514
Revised: July 16, 2009
Accepted: July 20, 2009
Published online: August 28, 2009
AIM: To study the relationship between M235T variants of angiotensinogen (AGT) gene and hepatocirrhosis.
METHODS: The genomic DNA of leukocytes was extracted from patients with hepatocirrhosis and normal people to observe the distribution of different genotypes and differences of allele frequencies between the normal and the hepatocirrhosis groups by polymerase chain reaction (PCR), restriction fragment length polymorphism (RFLP) and automatic sequencing.
RESULTS: There was no difference in the distributions of genotypes MM, MT and TT at locus M235T of AGT gene between the hepatocirrhosis group (7.8%, 40.6%, 51.6%) and the control group (8.0%, 59.7%, 32.3%), χ2 = 5.120, P > 0.05.
CONCLUSION: The polymorphism of M235T of the AGT gene may not be involved in the hepatocirrhosis.
- Citation: Song SJ, Tian JH, Zhao H, Liu YN, Guo J, Ma XL, Wang HZ. Association of M235T variants of angiotensinogen gene with hepatocirrhosis. Shijie Huaren Xiaohua Zazhi 2009; 17(24): 2512-2514
- URL: https://www.wjgnet.com/1009-3079/full/v17/i24/2512.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i24.2512
人血管紧张素原(angiotensinogen, AGT)基因全长13 kb, 含5个外显子和4个内含子[1]. AGT主要在肝脏合成, 其合成不仅受多种激素调节, 更主要的是受基因转录水平的调控. 位于AGT基因的第二外显子的M235T变异与多种疾病相关, 如原发性高血压、冠心病、心肌梗死、肾病、心血管疾病等[2-6]. 近期研究发现, 组织局部肾素-血管紧张素系统的激活与肝纤维化的发生有关[7-8]. 因此, 本研究通过对AGT基因M235T分子变异分析, 试图探讨慢性乙型肝炎病毒(hepatitis B virus, HBV)感染后AGT基因突变与肝硬化发生的关系.
收集2005-06/2005-12北京地坛医院住院的慢性HBV感染后肝硬化患者64例, 年龄40±10岁, 其中男45例, 女19例. 正常人全血标本62例, 年龄35±10岁, 其中男35例, 女27例. 患者的诊断符合2000年西安第十次全国病毒性肝炎及肝病学术会议制定的《病毒性肝炎防治方案》中的相关标准.
1.2.1 基因组DNA提取: 人基因组DNA样品取自实验对象外周血. 采用全血基因组DNA提取试剂盒(北京华美生物公司)提取白细胞基因组DNA, -2℃放置, 备用.
1.2.2 DNA片段的扩增: 扩增体系含各引物1 μmol/L, dNTP浓度各为200 μmol/L, Mg2+浓度为2.0 mmol/L, Taq DNA聚合酶2.5 U, 10×缓冲液2.5 μL(深圳晶美生物工程有限公司), 模板DNA 约0.1 μg, 加灭菌去离子水补足体积为25 μL. 按下述程序进行DNA扩增反应: 94℃预变性5 min, 94℃变性30 s, 63.5℃退火30 s, 72℃延伸40 s, 循环35次后于72℃继续延伸7 min. 20 g/L琼脂糖凝胶电泳, 紫外灯下观察扩增结果. 引物序列见表1.
| 变异位点 | 引物序列 | 产物大小(bp) | 限制性内切酶 |
| M235T | CCGTTTGTGCAGGGCCTGGCTCTCT | 167 | TtHⅡ |
| CAGGGTGCTGTCCACACTGGACCCC |
1.2.3 PCR产物的RFLP分析: PCR扩增产物8 μL, 10×缓冲液2 μL, 限制性内切酶12 U, 加灭菌去离子水补足体积至20 μL. 酶切反应在37℃进行12 h. 酶切产物在3%琼脂糖凝胶电泳. 凝腔成像系统仪下观察并保存结果. RFLP分析使用的限制性内切酶见表1.
统计学处理 计数资料组间比较采用χ2检验, 以P<0.05为组间有显著差异.
电泳结果显示PCR产物大小与理论设计片段大小基本一致.
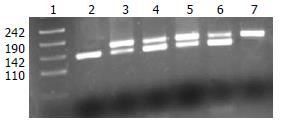
M235T变异样品经TtHⅡ酶切, 电泳结果显示出现3种带型. 带型167 bp为MM纯合型; 带型167 bp, 140 bp为MT杂合型; 带型140 bp为TT纯合型(图1). PCR产物直接测序结果进一步验证了以上结果.
实验样本基因型分布符合Hardy-Weinberg平衡. 采用χ2统计, 对64例肝硬化样品和62例正常人样品AGT基因M235T多态性进行分析(表2), 发现携带AGT基因(+4027)位点MM、MT、TT基因型的样品数目分别为5(7.8%)、26(40.6%)、33(51.6%)和5(8.0%)、37(59.7%)、20(32.3%), 基因型分布差异没有显著性意义(χ2 = 5.120, P>0.077). M、T等位基因频率分别为28%、72%和38%、62%, 两者之间的差异没有统计学意义(χ2 = 2.261, P = 0.077).
| 分组 | 基因型 | 等位基因频率(%) | ||||
| MM(%) | MT(%) | TT(%) | 合计 | M | T | |
| 肝硬化 | 5(7.8) | 26(40.6) | 33(51.6) | 64 | 28 | 72 |
| 对照组 | 5(8.0) | 37(59.7) | 20(32.3) | 62 | 38 | 62 |
| χ2 = 5.120 P = 0.077 | χ2 = 2.261 P = 0.133 | |||||
AGT是肾素的唯一底物, 主要在肝脏合成. 原位杂交结果显示人AGT基因位于染色体lq42-43. 人类AGT cDNA由1455个核苷酸组成, 编码485个氨基酸[9]. 近期研究发现, 组织局部肾素-血管紧张素系统的激活与肝纤维化的发生有关[7-8].
我们采用PCR、PCR/RFLP、测序等方法分析肝硬化和正常人血液标本. AGT基因M235T位点MM、MT、TT基因型的频率在慢性HBV感染后的肝硬化组和正常组分别为7.8%、40.6%、51.6%和8.0%、59.7%、32.3%, 两组之间不存在差异(χ2 = 5.120, P>0.05). M、T等位基因频率分别为28%、72%和38%、62%, 两者之间的差异没有统计学意义(χ2 = 2.261, P>0.05). 分析表明, HBV感染后肝硬化的形成可能与AGT基因M235T分子变异无关.
近年来, AGT基因多态性对肝硬化形成的影响日益受到关注. Powell et al[10]报道, HCV感染后, AGT(-6)A-G突变的患者往往导致慢性化, 并表现为进行性肝纤维化(P = 0.030). 近期我们的研究报告也显示, AGT基因核心启动子区域A-6G和A-20C的多态性与HBV感染后肝硬化相关(A-6G, P = 0.042; A-20C, P = 0.007). 而启动子区的另外2个位点的多态性则与HBV感染后肝硬化的形成无关(AGT-217, P = 0.615; AGT-152, P = 0.170)[11]. Forrest et al[12]对195名慢性HCV感染后的肝纤维化患者的AGT基因M235T分子变异分析表明, AGT基因M235T分子变异与HCV感染后的肝纤维化的发展无直接相关性(P>0.05), 这与我们的结果相符. 综合以上的研究结果, 我们不难发现AGT核心启动子变异的患者更容易发生肝纤维化.
AGT基因核心启动子区域上存在一个顺式作用元件AGCE1, 该元件位于TATA盒和转录起始位点之间, 对AGT基因转录表达起重要调控作用. AGCE1在激活AGT转录, 特别是对下游核心元件激活AGT转录具有增强作用. 该区域存在的突变影响AGT基因转录, 从而上调AGT基因表达[13]. 血清和组织里的AGT浓度直接影响体内血管紧张素Ⅰ(angiotensinⅠ, AngⅠ)和AngⅡ的合成, 从而影响肾素-血管紧张素系统激活的程度[14], 并进一步引起肝纤维化的发生[7-8]. 以上也许就是AGT核心启动子变异的患者更容易发生肝纤维化的主要原因. 至于其具体作用机制, 还需要深入的研究.
AGT基因多态性与多种疾病相关, 包括高血压、脑梗塞、冠心病, 肝纤维化等. AGT基因核心启动子区的变异与乙肝感染后的肝硬化相关, 但血管紧张素原基因T174M变异与肝硬化没有显著关系.
胡和平, 教授, 中国人民解放军第二军医大学附属东方肝胆医院消化科
最新的研究表明AGT基因核心启动子区的变异与乙型肝炎感染后的肝硬化相关, 但血管紧张素原基因 T174M变异与肝硬化没有显著关系.
多项研究表明组织局部肾素-血管紧张素系统的激活与肝纤维化的发生有关. 作为肾素-血管紧张素系统的唯一初始底物, AGT基因核心启动子区的变异与乙肝感染后的肝硬化相关, 但血管紧张素原基因外显子T174M变异与肝硬化没有显著关系.
本文探讨AGT基因M235T多态性与HBV相关性肝硬化的关系, 对肝硬化形成机制的探讨有一定意义.
编辑: 李军亮 电编:何基才
| 1. | Kageyama R, Ohkubo H, Nakanishi S. Induction of rat liver angiotensinogen mRNA following acute inflammation. Biochem Biophys Res Commun. 1985;129:826-832. [PubMed] [DOI] |
| 2. | Sethi AA, Nordestgaard BG, Grønholdt ML, Steffensen R, Jensen G, Tybjaerg-Hansen A. Angiotensinogen single nucleotide polymorphisms, elevated blood pressure, and risk of cardiovascular disease. Hypertension. 2003;41:1202-1211. [PubMed] [DOI] |
| 3. | Wang JH, Lin CM, Wang LS, Lai NS, Chen DY, Cherng JM. Association between molecular variants of the angiotensinogen gene and hypertension in Amis tribes of eastern Taiwan. J Formos Med Assoc. 2002;101:183-188. [PubMed] |
| 4. | Chang HR, Cheng CH, Shu KH, Chen CH, Lian JD, Wu MY. Study of the polymorphism of angiotensinogen, anigiotensin-converting enzyme and angiotensin receptor in type II diabetes with end-stage renal disease in Taiwan. J Chin Med Assoc. 2003;66:51-56. [PubMed] |
| 5. | Xu MQ, Ye Z, Hu FB, He L. Quantitative assessment of the effect of angiotensinogen gene polymorphisms on the risk of coronary heart disease. Circulation. 2007;116:1356-1366. [PubMed] [DOI] |
| 6. | Jurkovicova D, Sedlakova B, Riecansky I, Goncalvesova E, Penesova A, Kvetnansky R, Krizanova O. Cardiovascular diseases and molecular variants of the renin-angiotensin system components in Slovak population. Gen Physiol Biophys. 2007;26:27-32. [PubMed] |
| 9. | Campbell DJ. Tissue renin-angiotensin system: sites of angiotensin formation. J Cardiovasc Pharmacol. 1987;10Suppl 7:S1-S8. [PubMed] |
| 10. | Powell EE, Edwards-Smith CJ, Hay JL, Clouston AD, Crawford DH, Shorthouse C, Purdie DM, Jonsson JR. Host genetic factors influence disease progression in chronic hepatitis C. Hepatology. 2000;31:828-833. [PubMed] [DOI] |
| 11. | Xiao F, Wei H, Song S, Li G, Song C. Polymorphisms in the promoter region of the angiotensinogen gene are associated with liver cirrhosis in patients with chronic hepatitis B. J Gastroenterol Hepatol. 2006;21:1488-1491. [PubMed] |
| 12. | Forrest EH, Thorburn D, Spence E, Oien KA, Inglis G, Smith CA, McCruden EA, Fox R, Mills PR. Polymorphisms of the renin-angiotensin system and the severity of fibrosis in chronic hepatitis C virus infection. J Viral Hepat. 2005;12:519-524. [PubMed] [DOI] |
| 13. | Yanai K, Nibu Y, Murakami K, Fukamizu A. A cis-acting DNA element located between TATA box and transcription initiation site is critical in response to regulatory sequences in human angiotensinogen gene. J Biol Chem. 1996;271:15981-15986. [PubMed] [DOI] |
| 14. | Cumin F, Le-Nguyen D, Castro B, Menard J, Corvol P. Comparative enzymatic studies of human renin acting on pure natural or synthetic substrates. Biochim Biophys Acta. 1987;913:10-19. [PubMed] |