修回日期: 2009-07-20
接受日期: 2009-07-27
在线出版日期: 2009-08-28
目的: 探讨基质金属蛋白酶3(matrix metalloproteinase 3, MMP3)基因外显子2中Lys45Glu(rs679620)单核苷酸多态性与食管癌遗传易感的关系.
方法: Chelex-100法提取DNA模板; PCR-RFLP方法对1127例包括湖北省、河南省食管鳞癌患者与两地正常人对照及河南移民样本的该SNP进行基因分型正常对照人群.
结果: 河南高发易感移民人群组与湖北正常人群对照组在GG、GA、AA 3种基因型频率上均有极显著差异(均P<0.01); 河南高发区鳞癌组与湖北正常人群对照组在A/A基因型频率上有显著差异(P<0.05); 湖北人群与河南人群在GG和AA基因型频率上差异极显著(43.1% vs 54.5%; 14.8% vs 8.5%, 均P<0.01).
结论: MMP3基因外显子2中Lys45Glu单核苷酸多态性与食管鳞癌的遗传易感性似有明显相关.
引文著录: 欧阳刚, 姚品芳, 胡文娟, 黄环元, 王红, 王朝元, 陈思礼, 王立东, 李劲. MMP3基因Lys45Glu单核苷酸多态性与食管鳞癌遗传易感性的关系. 世界华人消化杂志 2009; 17(24): 2456-2462
Revised: July 20, 2009
Accepted: July 27, 2009
Published online: August 28, 2009
AIM: To investigate the association of genetic susceptibility to esophageal squamous cell carcinoma (ESCC) with the single nucleotide polymorphism (SNP) rs679620 (Lys45Glu) in exon 2 of the matrix metalloproteinase-3 (MMP3) gene.
METHODS: The SNP rs679620 (Lys45Glu) in exon 2 of the MMP3 gene was genotyped by PCR-RFLP analysis in 1127 samples, of which 317 were collected from ESCC patients (227 from Henan Province and 90 from Hubei Province) and 810 were collected from control populations (432 from Hubei Province, 197 from Henan Province and 181 from Henan emigrants in Hubei Province).
RESULTS: The frequencies of G/G, G/A and AA genotypes in SNP rs679620 were significantly different between emigrants from an area of high incidence of ESCC in Henan Province and healthy population in Hubei Province (all P < 0.01). A significant difference was observed in the AA genotype frequency between ESCC patients from Henan Province and healthy controls from Hubei Province (P < 0.05). Significant differences were also noted in the frequencies of GG and AA genotypes between healthy controls from Hubei Province and Henan Province (43.1% vs 54.5% and 14.8% vs 8.5%, respectively; both P < 0.01).
CONCLUSION: The SNP rs679620 (Lys45Glu) in exon 2 of the MMP3 gene may be associated with susceptibility to ESCC.
- Citation: Ouyang G, Yao PF, Hu WJ, Huang HY, Wang H, Wang CY, Chen SL, Wang LD, Li J. Association of the single nucleotide polymorphism (Lys45Glu) in exon 2 of the matrix metalloproteinase-3 gene with susceptibility to esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2009; 17(24): 2456-2462
- URL: https://www.wjgnet.com/1009-3079/full/v17/i24/2456.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i24.2456
基质金属蛋白酶(matrix metalloproteinases, MMPs)是一类依赖锌离子的蛋白水解酶, 迄今为止在人基因组中已经发现了26种. MMPs可在细胞核内通过对基因的转录调控调节细胞的生长和凋亡, 影响血管生成和免疫监视等途径, 在肿瘤发生早期起重要作用[1-2]; 也能够降解细胞外基质和基底膜, 涉及肿瘤浸润和转移, 在肿瘤的发展中起关键作用. MMP3基因位于人染色体11q22.3, 因为其启动子区-1171存在5A和6A的基因多态性与肿瘤易感性相关, 国内外对其进行了大量研究. Ghilardi et al[3]研究结果表明, 5A基因型与乳腺癌易感性相关. Zinzindohoué et al[4]认为, 5A基因型与头部和颈部鳞状细胞癌易感性相关. Tu et al[5]研究结果表明, 5A基因型与口腔黏膜下纤维化(oral submucous fibrosis, OSF)患病风险相关, 与口腔鳞状细胞癌(oral squamous cell carcinoma, OSCC)患病风险不相关. 国内学者Zhang et al[6]研究结果表明, 5A基因型与食管鳞癌(esophageal squamous cell carcinoma, ESCC)易感呈相关性, 但他与贲门癌(gastric cardiac adenocarcinoma, GCA)易感性不相关. 因此, 作为癌症遗传易感候选基因, MMP3应被更深入研究. 利用NCBI数据库查询MMP3基因, 8个外显子上共有10个cSNP(coding SNP), 其中存在氨基酸变化的SNP有4个, 他们分别是Lys45Glu、Trp109Gly、His113Pro及Arg248Trp. MMP3含有的多个核定位信号(nuclear localization signal, NLS)介导MMP3的细胞核内定位, MMP3第44-56位氨基酸的NLS0(LKKDVKQFVRRKD)中含有SNP Lys45Glu(rs679620). MMP3第25-87位氨基酸区域是一种重要的蛋白多糖结合域(putative peptidoglycan binding domain, PG_binding_1), 该结合域有3个α螺旋, 具有PG_binding_1功能, N端为基质催化结合域[7-9]. 在MMP3基因外显子2中, 第45位氨基酸, 存在一个Lys变为Glu(SNP编号为rs679620)的多态性位点, 其中Lys为带正电荷的氨基酸, Glu是带负电荷氨基酸. 第45位氨基酸正好在PG_binding_1中, 这种存在于编码区中的带电荷氨基酸和电荷性质的明显改变有可能会导致MMP3蛋白结构的改变和功能的异常[6]. 然而, MMP3基因外显子2中Lys45Glu的SNP多态性与食管癌的相关性尚未见报道. 本研究利用PCR-RFLP技术, 对湖北省食管鳞癌散发患者、高发易感移民人群及正常人群和河南省高发区食管鳞癌患者的SNP分型进行分析, 研究MMP3基因外显子2中Lys45Glu单核苷酸多态性与食管鳞癌的遗传易感性的关系.
湖北省ESCC散发患者的EDTA抗凝静脉血, 由湖北省肿瘤医院收集, 患者病理检查证实均为ESCC; 湖北省钟祥的河南高发区(淅川)移民人群的EDTA抗凝静脉血, 由湖北省肿瘤医院收集, 经胃镜检查和活检病理证实为无食管炎等食管良性疾病; 河南高发区(安阳)食管癌患者和当地正常对照人群的EDTA抗凝静脉血, 由郑州大学基础医学院癌症研究室提供, 患者病理检查证实均为ESCC; 湖北正常对照为在中国人民解放军广州军区武汉总医院和武汉市中医院收集的EDTA抗凝静脉血, 为非癌症患者并经胃镜检查和活检病理证实为无食管炎等食管良性疾病. 所有标本均于-70℃保存. Chelex-100为Sigma分装, 引物由上海赛百盛基因技术有限公司合成, dNTP是ToYoBo的产品, Taq聚合酶购于天根生化科技(北京)公司, TaqⅠ限制性内切酶购于TaKaRa公司.
1.2.1 分组: 本研究所用血样样本按来源和病理诊断共分5组. 其中, 河南高发区(安阳)的ESCC患者有227例(男163例, 女64例); 河南高发区(安阳)的正常对照样本有197例(男135例, 女62例); 湖北省内河南淅川移民(来自2个移民自然村)正常对照样本有181例(男129例, 女52例); 湖北散发ESCC患者有90例(男65例, 女25例); 湖北的正常对照样本有432例(男281例, 女151例). 各实验组的个体年龄均大于40岁. 各肿瘤组与各对照组相互间在性别、年龄的分布上均无统计学意义差异(P>0.05).
1.2.2 基因多态性分析: (1)引物设计及PCR模板制备: 正向引物为5'-CAACACCATAGCAGTAGCAGC-3'; 反向引物为5'-CAGCCTCTCCTTCATACAGCC-3'. Chelex-100法制备PCR模板见参考文献[10-13]. (2)PCR反应体系及反应程序: 按照Taq聚合酶使用说明书配制反应体系. PCR反应循环程序为: 94℃预变性5 min, 94℃变性1 min, 56℃退火30 s, 72℃延伸1 min, 35个循环, 72℃延伸10 min. (3)PCR产物酶切及琼脂糖凝胶电泳检测: 分别取食管癌散发患者、高发易感移民人群、高发区患者和对照组正常人群的抗凝全血提取DNA, 进行PCR扩增, 按TaqⅠ限制内切酶使用说明书配制反应体系, PCR产物酶切后经琼脂糖凝胶电泳鉴定带型. PCR产物酶切非变性聚丙烯酰胺凝胶电泳及其银染检测见参考文献[14-18].
统计学处理 各实验组的基因型分布利用Hardy-Weinberg平衡软件进行遗传平衡检验, 患者及对照组SNP基因型分布比较采用软件进行χ2检验. 将5个组3个分型的结果进行分类统计, 计算和比较各实验组基因型频率和基因频率. 并与NCBI数据库中已知的不同人群G:A比值作比较(NCBI数据库中ss38804849和ss52088121所提供的中国北京市人群G:A比值为0.689:0.311; 欧洲人群G:A比值为0.433:0.567).
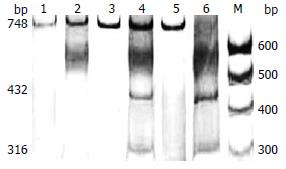
本研究通过对湖北ESCC散发人群组, 河南高发易感移民人群组, 河南高发区ESCC人群组和湖北及河南正常人群对照组大量样本进行PCR-RFLP分析, 由于人类等位基因的存在, 样本中特异扩增的PCR产物经TaqⅠ完全酶切后可产生3种结果: (1)3种片段748、432、316 bp, 即杂合型半数酶切; (2)2种片段432、316 bp, 即纯和型完全酶切; (3)1种片段748 bp, 即纯和型不能酶切. 在图1中分别显示为2、4、6号泳道的带型. 其中, 随机抽样上述3种PCR产物的10%进行DNA测序验证, 其结果与酶切结果相符合. 因此, 根据酶切结果产生片段可判断样品的基因型, 即在所研究的SNP位点处等位基因有GA、GG、AA分型.
2号泳道的基因型为纯合型, 2个等位基因为AA; 4号泳道的基因型为杂合型, 即2个等位基因为GA; 6号泳道的基因型为另一种纯合型, 即2个等位基因为GG. 对照实验显示, 图2中500 bp和600 bp之间的略弥散条带, 是由酶切反应体系中的限制性内切酶TaqⅠ经银染后产生的.
MMP3 SNP rs679620基因多态性Lys45Glu在除河南淅川高发易感移民人群组外的其他各人群组基因型分布均符合Hardy-Weinberg平衡(P>0.05), 他表明实验中随机选择的湖北、河南两地正常对照和ESCC患者人群均能反映各对应人群的MMP3基因SNP Lys45Glu(rs679620)的基因型频率的自然分布状况. 由表1的统计结果可知, 湖北正常人群的MMP3 SNP Lys45Glu(rs679620)基因频率G:A为0.651:0.349, 湖北散发病例的G:A为0.600:0.400; 河南安阳高发区正常人群的G:A为0.751:0.249, 河南安阳高发区病例的G:A为0.711:0.289, 安阳人群的G:A值偏高; 而河南淅川高发易感移民人群的G:A为0.621:0.378, 其比例偏低.
| 分组 | n | GG | GA | AA | Hardy-Weinberg平衡(P值) | G∶A | |||
| n | % | n | % | n | % | ||||
| 湖北正常人群 | 432 | 192 | 44.4 | 178 | 41.2 | 62 | 14.4 | 0.0511 | 0.651∶0.349 |
| 湖北散发病例 | 90 | 33 | 36.7 | 42 | 46.6 | 15 | 16.7 | 0.0694 | 0.600∶0.400 |
| 河南高发区正常 | 197 | 116 | 58.9 | 64 | 32.5 | 17 | 8.6 | 0.0665 | 0.751∶0.249 |
| 河南高发区病例 | 227 | 115 | 50.6 | 93 | 41.0 | 19 | 8.4 | 0.9741 | 0.711∶0.289 |
| 高发易感移民人群 | 181 | 54 | 29.8 | 117 | 64.6 | 10 | 5.5 | 4.86E-07 | 0.621∶0.378 |
经χ2检验, (1)河南高发区癌症组与湖北正常人群对照组在AA基因型频率上有显著差异(P<0.05); 河南高发区癌症组与湖北散发癌症组在AA基因型频率上也有显著差异(P<0.05). (2)河南高发易感移民人群组与湖北正常人群对照组在GG、GA、AA基因型频率上均有极显著差异(P<0.01); 并且河南高发易感移民人群组与湖北散发癌症组在除GG外的GA、AA基因型频率上也有显著极差异(P<0.01). (3)而湖北正常人群对照组与湖北散发癌症组及河南高发区正常人群对照组和河南高发区病例组在GG、GA、AA基因型频率上均无显著差异(P>0.05); 但河南高发区的正常人群和病例组与河南高发易感移民人群组在AA基因型频率上无显著差异(P>0.05, 表2).
| 组间比较 | GG | GA | AA | ||||
| P值 | χ2值 | P值 | χ2值 | P值 | χ2值 | ||
| 湖北散发病例组 | 湖北正常组 | >0.05 | 1.84 | >0.05 | 0.91 | >0.05 | 0.32 |
| 河南高发区病例组 | 河南高发区正常组 | >0.05 | 2.88 | >0.05 | 3.25 | >0.05 | 0.01 |
| 湖北正常组 | 河南高发区正常组 | <0.01 | 11.29 | >0.01 | 4.34 | >0.01 | 4.03 |
| <0.05 | <0.05 | ||||||
| 湖北正常组 | 河南高发区病例组 | >0.05 | 2.31 | >0.05 | 0.00 | >0.01 | 4.94 |
| <0.05 | |||||||
| 湖北散发病例组 | 河南高发区正常组 | <0.01 | 12.21 | >0.01 | 5.33 | >0.01 | 4.03 |
| <0.05 | <0.05 | ||||||
| 湖北散发病例组 | 河南高发区病例组 | >0.01 | 5.07 | >0.05 | 0.86 | >0.01 | 4.63 |
| <0.05 | <0.05 | ||||||
| 湖北散发病例组 | 高发易感移民组 | >0.05 | 1.29 | <0.01 | 8.01 | <0.01 | 8.91 |
| 湖北正常组 | 高发易感移民组 | <0.01 | 11.33 | <0.01 | 28.07 | <0.01 | 10.77 |
| 河南高发区病例组 | 高发易感移民组 | <0.01 | 18.00 | <0.01 | 22.59 | >0.05 | 1.23 |
| 河南高发区正常 | 高发易感移民组 | <0.01 | 32.17 | <0.01 | 39.08 | >0.05 | 1.23 |
表3显示的人群基因型频率中, 河南人群的A/A纯合型较湖北人群偏少(8.5% vs 14.8%), 而河南人群的G/G纯合型偏多, 湖北人与河南人的总G/A是1.8:2.7. 两地人群在GG和AA基因型频率上差异极显著, 在GA型上无差异.
| 分组 | n | GG | GA | AA | Hardy-Weinberg平衡(P值) | G∶A | |||
| n | % | n | % | n | % | ||||
| 湖北人群(湖北病例+正常人群) | 522 | 225 | 43.1 | 220 | 42.1 | 77 | 14.8 | 0.0567 | 0.642∶0.358(1.8) |
| 河南人群(河南病例+正常人群) | 424 | 231 | 54.5 | 157 | 37.0 | 36 | 8.5 | 0.2108 | 0.730∶0.270(2.7) |
| P值 | <0.01 | >0.05 | <0.01 | ||||||
| χ2值 | 12.13 | 2.56 | 8.72 | ||||||
湖北与河南两地人群的3种基因型频率与北京人群相比均无明显差异; 但与NCBI数据库提供的美国黑人和欧洲人基因频率G:A比0.597:0.403和0.433:0.567相比有明显不同. 表4中不同自然人群MMP3基因SNP Lys45Glu(rs679620)的基因型频率和基因频率呈现出由小到大的规律性排序. 除GA型北京人群(35.6%)与河南人群(37.0%)的基因型频率很接近而可认为差别不大外, 其余的排序皆为: 河南人群→北京人群→湖北人群→美国黑人→欧洲人群(表4).
| 分组 | n | GG | GA | AA | Hardy-Weinberg平衡(P值) | G∶A | |||
| n | % | n | % | n | % | ||||
| 北京人(NCBI) | 90 | 46 | 51.1 | 32 | 35.6 | 12 | 13.3 | 0.1057 | 0.689∶0.311 |
| 美国黑人(NCBI) | 124 | 44 | 35.5 | 60 | 48.4 | 20 | 16.1 | 0.9520 | 0.597∶0.403 |
| 欧洲人(NCBI) | 120 | 16 | 13.3 | 72 | 60.0 | 32 | 26.7 | 0.0151 | 0.433∶0.567 |
湖北省钟祥柴湖乡在50多年前因整体迁入河南淅川食管癌高发区居民(约4万人)而成为一个新的相对封闭的食管癌高发区. 这一特殊的人群为研究环境、遗传与食管癌的关系提供了极佳的样本. 2004年初湖北省肿瘤医院对钟祥柴湖乡进行的流行病学调查结果显示, 该迁移人群人口已增长至10万多人, 其食管癌的发病率、死亡率较20世纪70年代仍呈上升趋势(>131/10万)[19-20]. 在普查的过程中, 利用电子内窥镜检查发现, 移民村的居民与湖北当地的土著居民相比较食管生理结构存在明显异常. 对湖北钟祥柴湖乡河南移民居住地的饮用的地下水情况和上千份的流行病学问卷调查初步显示, 地下水各项指标经专业部门检测未见污染超标, 该人群的生活习惯和生活水平也与40多年前有较大改变. 仅少数人喜食腌菜和烫食. 尤为突出的是家族食管癌高发现象, 一些家族食管癌的发病率、死亡率远远高于131/10万. 与环境因素相比, 极为明显的食管癌的家族聚集趋势提示家系遗传因素在食管癌变过程中起着重要作用[19-20].
显著的地域性分布差异是食管癌显著的流行病学特征, 高低发区发病率和死亡率可相差500倍. 环境和遗传因素在食管癌发病中起重要作用. 国内学者王立东 et al为了进一步探讨遗传和环境因素对食管和贲门癌变的影响, 对河南林州居民和山西长治林州移民食管、贲门和胃窦部癌前病变和癌的发生情况进行了检测分析[21]. 他们发现, 移居到200 km以外的山西长治韩店镇的林州居民后裔的食管癌和贲门癌的人群检出率与河南食管癌高发区林州市姚村镇相似, 而韩店镇移民贲门重度癌前病变DYS和IM检出率高于林州居民. 这些居民已在山西长治连续4代居住100年, 生活习惯、环境已与山西当地情况相似, 与林州地区的生活环境已有较大变化. 说明环境和时间变化未明显影响食管和贲门癌前病变和癌的发生率, 提示遗传因素对食管和贲门癌变起重要作用. 了解这些移民的食管癌和癌前病变的发生状况, 并与林州地区和移民当地居民进行比较, 将提供非常有价值的有关食管癌发病因素的信息[21].
MMP3又叫间质溶素1, 其基因位于11q22, 作用于细胞外基质(extra cell matrix, ECM)和基底膜(basement membrane, BM)中的Ⅳ型胶原, 并可激活其他MMPs如激活MMP1前体成为MMP1, 而MMP1可降解Ⅰ、Ⅱ、Ⅲ型胶原, 所以 MMP3在肿瘤的浸润、 转移中起重要作用[22]. 早期认为, MMPs仅参与肿瘤的侵袭和转移, 近年研究显示, MMPs可通过调节细胞生长和凋亡、影响血管生成和免疫监视等途径, 在肿瘤形成早期起重要作用[1]. MMP3可以降解层粘连蛋白和纤粘连蛋白, 对肿瘤发生和肿瘤生长具有重要意义.
近来有学者报道, MMP3也存在于肝细胞核内并且参与细胞凋亡的过程[2]. 进一步的研究表明, MMP3含有的多个NLS介导MMP3的细胞核内定位; 其多肽链C末端的PEX区域参与核内DNA的结合, 并证实了MMP3作为反式因子参与细胞核内基因的转录调控[23]. 其中, MMP3第44-56位氨基酸的NLS0(LKKDVKQFVRRKD)中含有SNP Lys45Glu(rs679620), 他的多态性对NLS0的影响及其后续的转录调控和细胞凋亡的改变可能与癌症的发生和发展相关.
已发现MMP1、MMP2、MMP3基因多态性与一些肿瘤的遗传易感性相关, 进一步研究MMPs家族其他成员与肿瘤易感性的关系将为肿瘤的预防和早期诊断及治疗提供更完善的分子生物学基础[22]. 随着MMPs在肿瘤发生、发展和转移中的作用机制研究的进展, 将会进一步了解有关基因编码区单核苷酸多态性对MMPs蛋白功能、酶活性和在细胞代谢调控中的影响, 进而揭示其在诱发肿瘤及其导致肿瘤转移中的作用机制. 迄今为止, 对MMPs与肿瘤的关系的研究大都集中在研究基因启动子区域的SNP现象, 比如MMP1、MMP3、MMP9, 而对结构基因的SNP筛查和研究报道甚少[24].
利用NCBI数据库查询发现, MMP3的第25-87位氨基酸是一个重要的PG_binding_1. 利用NCBI和网上生物软件motif scan(网址: http://hits.isb.ch/cgi-bin/motif scan)分析MMP3的氨基酸序列, 在PG_binding_1涵盖的25-87位氨基酸中发现3个重要的位点, 他们分别为: 第36-42位氨基酸为酪氨酸蛋白激酶磷酸化位点; 第54-57位氨基酸为cAMP磷酸化位点; 第76-78位氨基酸为蛋白激酶C磷酸化位点. 基因多态位点Lys45Glu恰好位于PG_binding_1内, 并且在第36-42位氨基酸为酪氨酸蛋白激酶磷酸化位点附近, Lys为带正电荷的氨基酸, Glu是带负电荷氨基酸, 这种存在于编码区的通常参与信号转导过程的氨基酸的电荷的改变可能会导致MMP3蛋白相应三维结构的变化, 从而引起其功能的改变, 如信号转导异常, 最终导致个体对特定环境或病因的反应敏感性改变[6].
本研究统计结果显示, 除河南淅川高发易感移民人群组外的其他各人群组基因型分布均符合Hardy-Weinberg平衡(P>0.05). 他表明实验中随机选择的湖北、河南两地正常对照人群和两地ESCC患者人群均能反映各对应人群的MMP3基因SNP Lys45Glu(rs679620)的基因型频率的自然分布状况. 但河南淅川高发易感移民人群组的遗传不平衡结果结合我们在当地的流行病学调查的情况, 反映出与其人群的相对封闭狭小(2个全河南人的移民自然村)和普遍的族群内部通婚(大多为沙姓大家族)引起的遗传漂移有关. 两村40岁以上200多人的电子胃镜普查发现有2例ESCC原位癌加上食管组织轻度及重度增生各1例; 与大多土著湖北人食管壁较光滑不同, 很多被筛查的移民自然村村民的食管壁呈现较多小突起状颗粒. 值得注意的是, 河南淅川移民人群与河南高发区(安阳)癌症组和正常组在基因型GG和GA上有显著差异(P<0.01), 但在AA基因型上无差异(P>0.05)且移民人群组AA型比例最低(5.5%).
河南高发易感移民人群组(河南淅川4万人移民至湖北柴湖[19])与湖北正常人群对照组在GG、GA、AA 3种基因型频率上均有极显著差异(P<0.01); 河南高发区癌症组与湖北正常人群对照组在AA基因型频率上有显著差异(P<0.05). 提示SNP(Lys45Glu)与食管癌的遗传易感性有明显相关. 河南高发区正常组与河南高发区病例组在GG、GA、AA 3种基因型频率上均无显著差异(P>0.05); 同样, 湖北正常人群对照组与湖北散发癌症组在GG、GA、AA 3种基因型频率上也无显著差异(P>0.05); 并且湖北散发癌症组与河南高发易感移民人群组在除GG外的GA、AA 2种基因型频率上都有极显著差异. 似乎提示, 非SNP(-Lys45Glu-)因素(环境因素或其他遗传因素)是湖北散发癌症组人群患食管癌的原因, 也即湖北与河南人群罹患食管癌的机制可能是有所不同的. 统计结果显示湖北与河南两地人群(包括正常组与癌症组)在MMP3 SNP(rs679620)的GG和AA基因型频率上差异极显著, 也提示ESCC的河南人高发群发机制与湖北人低发散发的机制是有所不同的.
河南高发易感移民人群组(淅川)与河南高发区癌症组(安阳)在SNP(rs679620)基因型GG和GA上有显著差异, 在AA基因型上无显著差异; 结合湖北人群(包括正常人群和散发癌症患者)在A/A基因型上与河南人群(包括淅川正常人群和安阳散发癌症患者)的显著差异(14.9% vs 5.42%), 表明河南人群在MMP3基因外显子-2的SNP Lys45Glu中具有明显较低的AA基因型频率可能与其食管鳞癌的遗传易感有一定的关联性. 这种不同人群中SNP的由G变为A的改变导致MMP3氨基端的PG_binding_1中带正电荷的Lys改变为带负电荷的Glu, 暗示其对MMP3在细胞核内定位、核内基因的转录调控和细胞凋亡的过程中作用的影响及其与肿瘤的高发和易感性有某种关联. 而河南人群较高的GG基因型频率似乎提示他可能与ESCC的浸润和转移及预后很差有关.
另外, 河南高发区癌症组(安阳)与湖北散发癌症组在GG、GA 2种基因型频率上均无显著差异(P>0.05), 可能与湖北散发癌症组的样本数量(90例)较少而存在统计误差有关, 他会在以后的研究深入过程中, 通过扩大样本的收集量而得到修正.
本研究结果与已报道的这些不同人群的ESCC的发病率和易感性从高到低的排列顺序相吻合[25]. 这种趋势似乎提示, GG型MMP3对食管鳞癌的发生和发展有某种促进作用, 而AA型MMP3则正好相反. 当然, 这还需进一步的实验来证实.
总之, 通过对1127例食管癌和正常对照样本的SNP分型及统计分析表明, MMP3基因外显子2中Lys45Glu单核苷酸多态性与ESCC的部分人群高发和遗传易感性呈现明显的相关性.
食管癌是世界十大恶性肿瘤之一, 在我国食管癌居癌症死因第4位. 我国的河南、河北、山西3省交界的太行山区(林县、磁县、阳城县), 其发病率高达100/10万以上.
刘彬彬, 副研究员, 复旦大学附属中山医院、复旦大学肝癌研究所
食管癌的发生与遗传、环境、饮食及某些微生物的感染密切相关, 食管癌是多因素作用, 多基因参与, 多阶段发展的疾病. 对食管癌的发生和发展的分子遗传机制的研究是我国癌症研究的热点之一.
国内学者王立东 et al为了进一步探讨遗传和环境因素对食管和贲门癌变的影响, 对河南林州居民和山西长治林州移民食管、贲门和胃窦部癌前病变和癌的发生情况进行了检测分析, 提示环境和时间变化未明显影响食管和贲门癌前病变和癌的发生率, 提示遗传因素对食管和贲门癌变起重要作用.
本研究发现在基质金属蛋白酶3的第45个氨基酸的同一位置上拥有赖氨酸的人比具有谷氨酸的人更容易患食管癌并且也更快的导致癌症的转移. 这也是食管癌高发区特别是一些高发家族里有较多人患食管癌并且预后很差的原因之一.
本研究样本量大, 结果可信, 表述清晰, 具有较好的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Egeblad M, Werb Z. New functions for the matrix metalloproteinases in cancer progression. Nat Rev Cancer. 2002;2:161-174. [PubMed] [DOI] |
| 2. | Si-Tayeb K, Monvoisin A, Mazzocco C, Lepreux S, Decossas M, Cubel G, Taras D, Blanc JF, Robinson DR, Rosenbaum J. Matrix metalloproteinase 3 is present in the cell nucleus and is involved in apoptosis. Am J Pathol. 2006;169:1390-1401. [PubMed] [DOI] |
| 3. | Ghilardi G, Biondi ML, Caputo M, Leviti S, DeMonti M, Guagnellini E, Scorza R. A single nucleotide polymorphism in the matrix metalloproteinase-3 promoter enhances breast cancer susceptibility. Clin Cancer Res. 2002;8:3820-3823. [PubMed] |
| 4. | Zinzindohoué F, Blons H, Hans S, Loriot MA, Houllier AM, Brasnu D, Laccourreye O, Tregouet DA, Stucker I, Laurent-Puig P. Single nucleotide polymorphisms in MMP1 and MMP3 gene promoters as risk factor in head and neck squamous cell carcinoma. Anticancer Res. 2004;24:2021-2026. [PubMed] |
| 5. | Tu HF, Liu CJ, Chang CS, Lui MT, Kao SY, Chang CP, Liu TY. The functional (-1171 5A-->6A) polymorphisms of matrix metalloproteinase 3 gene as a risk factor for oral submucous fibrosis among male areca users. J Oral Pathol Med. 2006;35:99-103. [PubMed] [DOI] |
| 6. | Zhang J, Jin X, Fang S, Li Y, Wang R, Guo W, Wang N, Wang Y, Wen D, Wei L. The functional SNP in the matrix metalloproteinase-3 promoter modifies susceptibility and lymphatic metastasis in esophageal squamous cell carcinoma but not in gastric cardiac adenocarcinoma. Carcinogenesis. 2004;25:2519-2524. [PubMed] [DOI] |
| 7. | Foster SJ. Cloning, expression, sequence analysis and biochemical characterization of an autolytic amidase of Bacillus subtilis 168 trpC2. J Gen Microbiol. 1991;137:1987-1998. [PubMed] |
| 8. | Dideberg O, Charlier P, Dive G, Joris B, Frère JM, Ghuysen JM. Structure of a Zn2+-containing D-alanyl-D-alanine-cleaving carboxypeptidase at 2.5 A resolution. Nature. 1982;299:469-470. [PubMed] [DOI] |
| 9. | Gooley PR, O'Connell JF, Marcy AI, Cuca GC, Salowe SP, Bush BL, Hermes JD, Esser CK, Hagmann WK, Springer JP. The NMR structure of the inhibited catalytic domain of human stromelysin-1. Nat Struct Biol. 1994;1:111-118. [PubMed] [DOI] |
| 10. | 欧阳 刚, 胡 文娟, 姚 品芳, 王 红, 陈 思礼, 王 朝元, 李 劲. PCR-RFLP中Chelex-100制备DNA模板的方法建立及其条件的优化. 中南民族大学学报(自然科学版). 2009;28:38-41. |
| 15. | Bassam BJ, Caetano-Anollés G, Gresshoff PM. Fast and sensitive silver staining of DNA in polyacrylamide gels. Anal Biochem. 1991;196:80-83. [PubMed] [DOI] |
| 19. | 姚 品芳, 黄 环元, 付 由高, 李 广灿, 夏 和顺, 杨 小玲, 王 瑞勤, 王 锡印, 沙 聚伟. 湖北钟祥河南移民与湖北本地居民食管鳞状细胞癌组织中HPV感染的比较. 肿瘤防治研究. 2005;32:46-48. |
| 20. | Yao PF, Li GC, Li J, Xia HS, Yang XL, Huang HY, Fu YG, Wang RQ, Wang XY, Sha JW. Evidence of human papilloma virus infection and its epidemiology in esophageal squamous cell carcinoma. World J Gastroenterol. 2006;12:1352-1355. [PubMed] |
| 21. | 王 立东, 刘 宾, 冯 常炜, 张 延瑞, 张 彦霞, 李 苹娟, 常 扶保, 李 吉林, 高 福生, 冯 笑山. 山西长治林州移民与河南林州居民食管、贲门和胃窦内镜病理结果比较. 郑州大学学报(医学版). 2006;41:5-9. |
| 23. | Eguchi T, Kubota S, Kawata K, Mukudai Y, Uehara J, Ohgawara T, Ibaragi S, Sasaki A, Kuboki T, Takigawa M. Novel transcription-factor-like function of human matrix metalloproteinase 3 regulating the CTGF/CCN2 gene. Mol Cell Biol. 2008;28:2391-2413. [PubMed] [DOI] |