修回日期: 2009-07-30
接受日期: 2009-08-03
在线出版日期: 2009-08-18
目的: 探讨吲哚乙酸(IAA)与辣根过氧化物酶(HRP)在体外共同作用对人涎腺腺样囊性癌细胞SACC-2生长抑制的影响.
方法: 用不同浓度的IAA/HRP(IAA 20、40、60 、80、100 µmol/L+HRP 1.2 mg/L)与SACC-2细胞共同培养48 h后, 光镜下观察癌细胞的生长; CCK-8法测定细胞生长抑制率; 半定量RT-PCR技术检测caspase-3 mRNA水平.
结果: 与阴性对照组比较, 48 h后 SACC-2细胞皱缩, 变小变圆, 空泡明显; 40、60、80、100 µmol/L IAA组的细胞生长抑制率明显增高(31.8%, 38.71%, 60.57%, 80.18%, 均P<0.05); 半定量RT-PCR结果显示, 60、100 µmol/L IAA与1.2 mg/L HRP联合作用可上调caspase-3 mRNA水平(0.835±0.019, 1.667±0.022 vs 0.242±0.025, 均P<0.01).
结论: IAA/HRP对人涎腺腺样囊性癌细胞SACC-2生长有明显的抑制作用, 可通过激活caspase-3 mRNA的表达, 诱导凋亡.
引文著录: 吕继连, 高宁, 李方, 何巍, 尚君兰. 吲哚乙酸联合辣根过氧化物酶对人SACC-2细胞的抑制作用. 世界华人消化杂志 2009; 17(23): 2413-2416
Revised: July 30, 2009
Accepted: August 3, 2009
Published online: August 18, 2009
AIM: To investigate the effects of combined use of indole-3-acetic (IAA) and horseradish peroxidase (HRP) on the growth of human adenoid cystic carcinoma SACC-2 cells in vitro.
METHODS: After HRP (1.2 mg/L) and IAA at different concentrations (20, 40, 60, 80 and 100 μmol/L) were co-incubated with SACC-2 cells for 48 h, the changes in cell morphology were observed under light microscopy, the growth inhibition rate was measured by the CCK-8 assay, and the expression level of caspase-3 mRNA was determined by semiquantitative RT-PCR.
RESULTS: Compared with negative control cells, cells incubated with IAA/HRP underwent shrinkage, became small and round, and showed significant vacuole formation. The growth inhibition rates achieved in cells incubated with HRP (1.2 mg/L) and IAA at 40, 60, 80 and 100 μmol/L were significantly higher than that in control cells (31.8%, 38.71%, 60.57% and 80.18% vs 0%, respectively; all P < 0.05). Combined use of HRP (1.2 mg/L) and IAA at 60 and 100 μmol/L could significantly upregulate the expression of caspase-3 mRNA when compared to control cells (0.835 ± 0.019 and 1.667 ± 0.022 vs 0.242 ± 0.025, respectively; both P < 0.01).
CONCLUSION: Combined use of IAA and HRP is able to significantly inhibit the growth of SACC-2 cells in vitro perhaps through upregulation of caspase-3 mRNA expression to induce cell apoptosis.
- Citation: Lv JL, Gao N, Li F, He W, Shang JL. Combined use of indole-3-acetic acid and horseradish peroxidase inhibits the growth of human adenoid cystic carcinoma SACC-2 cells. Shijie Huaren Xiaohua Zazhi 2009; 17(23): 2413-2416
- URL: https://www.wjgnet.com/1009-3079/full/v17/i23/2413.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i23.2413
涎腺腺样囊性癌是口腔颌面部常见的恶性肿瘤, 手术是其主要的治疗方法, 但其高侵袭及转移的生物学特性, 使患者5年生存率不足50%, 10年生存率不足20%[1], 因此寻找新的治疗方法和有效抗癌药物势在必行. 吲哚乙酸(indole-3-acetic, IAA)是一种植物生长激素, 主要调节植物细胞的分化、生长和分裂增殖[2]. 辣根过氧化物酶(horseradish peroxidase, HRP)是一种亚铁血红素酶, 能氧化包括IAA在内的一系列底物[3-4]. 近年来研究表明, IAA的作用浓度取值不同, 但HRP 的浓度一定, IAA/HRP共同作用时具有抑制肿瘤细胞生长, 并可诱导凋亡等作用, 而当IAA和HRP以二者联合作用时的相同浓度单独作用时, 则不会产生任何毒性效应[5]. 鉴于不同细胞对其敏感性存在差异, 本研究选择人涎腺腺样囊性癌细胞系SACC-2进行体外实验, 观察其对SACC-2细胞的生长抑制效果, 旨在探索腺样囊性癌新的治疗方法.
1 材料和方法
人腺样囊性癌细胞系SACC-2(华西口腔医学院惠赠); Cell counting kit-8(日本同仁研究所); IAA, HRP与琼脂糖(美国Sigma公司); RPMI 1640(美国Gibco公司); 胎牛血清(杭州四季青公司); 二甲基亚砜(上海化学试剂厂); TRIzol(上海晶天生物科技有限公司). 酶标仪(美国Thermo), 超净工作台(苏州净化), PCR仪(德国Biometra), 凝胶成像系统(Synoptics Ltd), 消毒柜(日本Tomy公司), 显微镜(中国Nikon). RT-PCR引物序列由北京博尚生物工程有限公司合成. 扩增产物大小: 人caspase-3 173 bp, 正向引物5-GAGGCCGACTTCTTGTATGC-3, 反向引物: 5-AATTCTGTTGCCACTTTGG-3; 人β-actin 409 bp, 正向引物5-ACCAACTGGGACGACATGGAGAAAATC-3, 反向引物5-GTAGCCGCGCTCGGTGAGGATCTTCAT-3.
1.2.1 细胞培养: 人涎腺腺样囊性癌细胞SACC-2培养于含100 mL/L胎牛血清的RPMI 1640培养基中, 置37℃、50 mL/L的CO2培养箱中. 待细胞生长状态处于对数生长期进行传代, 当细胞达到足够量时开始实验.
1.2.2 光镜观察IAA/HRP对SACC-2细胞形态影响: 取对数生长期的SACC-2细胞, 用胰酶消化成单细胞悬液, 计数, 以细胞密度为5×107个/L, 2 mL/孔接种于6孔培养板中, 贴壁24 h后弃去原培养液, 分别加入对照组(完全培养基)和实验组(IAA 20、40、60 、80、100 µmol/L+HRP 1.2 mg/L)的培养基, 于48 h在光镜下观察实验组和对照组肿瘤细胞的形态变化, 并摄片记录.
1.2.3 CCK-8法测IAA/HRP对SACC-2细胞增殖的影响: 取对数生长期的SACC-2细胞, 接种于96孔平底细胞培养板中, 每孔细胞接种的终浓度为2×107个/L, 每孔100 µL. 4-6 h细胞贴壁后, 加入不同浓度的IAA和HRP, 使不同组的IAA终浓度分别为20、40、60、80、100 µmol/L, HRP的终浓度均为1.2 mg/L, 并设加等浓度细胞和培养基的对照孔, 只加培养基的调零孔, 每组设5个复孔, 置37℃、50 mL/L的CO2培养箱中培养48 h后加10 µL CCK-8溶液, 充分震荡后, 置37℃、50 mL/L的CO2培养箱中孵育1 h, 置450 nm波长酶标仪中测定A450值, 生长抑制率IR(%) = (1-实验组A450/对照组A450)×100%.
1.2.4 RT-PCR检测凋亡相关基因caspase-3 mRNA表达: (1)总RNA提取与保存: TRIzol一步法提取总RNA, 具体步骤参照TRIzol说明书, 30 µL DEPT(1%)水溶液置于液氮中贮存, RNA纯度为1.7-1.9, 浓度为0.83-3.35 g/L. (2)逆转录合成cDNA: 根据逆转录试剂盒操作步骤合成cDNA. (3)PCR扩增反应体系: 反应体系为50 µL. PCR反应参数: 95℃预变性5 min, 94℃变性50 s, 58℃退火30 s, 72℃延伸60 s, 29个循环; 72℃ 10 min, 然后于-20℃保存. (4)PCR产物电泳: 取10 µL左右PCR产物在10 g/L琼脂糖凝胶中电泳, 紫外灯下观察扩增产物, 凝胶成像分析系统扫描扩增带, 以β-actin为内参照, 与目的基因PCR产物条带灰度Volume之比作为反映目的基因mRNA水平的相对指标.
统计学处理 实验数据以mean±SD表示, 采用统计软件SPSS14.0进行单因素方差分析, 组间两两比较用LSD检验.
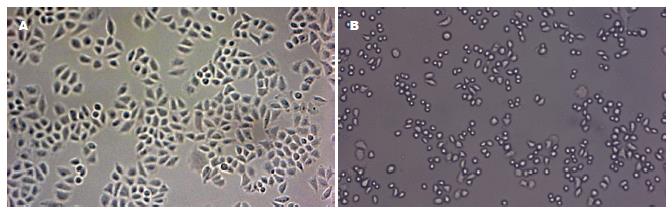
对照组细胞呈梭形, 核浆比例大, 核大深染, 可见较多的核分裂相, 细胞异型性明显, 大小与形态不一(图1A). 实验组20 µmol/L IAA+1.2 mg/L HRP处理48 h后, 细胞数量有所减少, 形态变化不明显; 100 µmol/L IAA组可见大部分细胞皱缩, 变小变圆, 胞内出现空泡, 核浆比减小, 核浆难分清(图1B).
与对照组相比, 除20 µmol/L组无统计学意义外, 40 µmol/L浓度以上的IAA与HRP结合均可抑制SACC-2细胞的增殖, 随着浓度的增加, 细胞增殖能力下降, 其生长抑制率分别为31.8%、38.71%、60.57%及80.18%(表1), 与对照组相比差异有统计学意义(P<0.05). 结果说明IAA/HRP可抑制SACC-2细胞生长, 且其抑制作用呈较明显的时间-剂量依赖性.
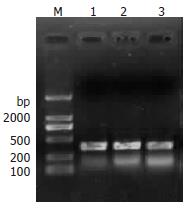
A260/A280为1.8-2.0, 说明所提取的RNA纯度较好.不同浓度IAA作用SACC-2 48 h后, 细胞caspase-3基因半定量分析结果显示(图2): 各浓度的IAA处理组及对照组细胞都有等量的β-actin扩增, 而caspase-3扩增结果却不同, 对照组的表达量非常低, 只有0.242±0.025; 随着IAA浓度的增高, caspase-3表达量依次上升, 60 µmol/L及100 µmol/L组表达量分别为0.835±0.019, 1.667±0.022, 两组间比较差异均有统计学意义(P<0.01). IAA/HRP能有效上调SACC-2 caspase-3 mRNA的表达, 诱导凋亡.
3 讨论
IAA作为一种植物激素, 被HRP氧化后会产生包括活性氧自由基(ROS), 如H2O2在内的自由基. 自由基会导致脂质过氧化, 引起细胞膜结构改变, 导致细胞内损伤和凋亡[6-7]. 体外实验表明吲哚乙酸联合辣根过氧化物酶对多种肿瘤细胞有抑制或杀伤作用[8-9], 对Bxpc_3、K562、G361、LSCC细胞有明显的抑制作用, 并能诱导分化和凋亡, 且对正常细胞的损伤甚微[10]. 本实验发现, 40 µmol/L以上的吲哚乙酸联合辣根过氧化物酶即可对SACC-2细胞造成抑制(P<0.05), 并且随着浓度和时间的增加存在量效和时效关系. 光镜下可见细胞形态发生明显改变, 细胞皱缩, 变小变圆, 空泡明显, 部分细胞脱落悬浮于培养液中.
恶性肿瘤的发生是多因素、多基因相互作用, 且在多阶段发挥作用的极为复杂的生物学过程. 高度增殖和无限分化是恶性肿瘤的重要生物学特性之一, 也是临床患者复发和转移的主要原因. 因此, 对肿瘤生长抑制的研究已经成为肿瘤治疗学研究的主要内容. 涎腺腺样囊性癌是口腔颌面部常见的恶性肿瘤, 其高侵袭及转移的生物学特性多年来一直困扰着临床治疗工作, 寻找新的高效低毒的抗癌药仍是目前研究的热点. 细胞持续分裂和不断增殖是肿瘤区别于正常细胞的一个重要特征, 因此观察对肿瘤细胞的增殖活性的抑制作用是筛选抗癌药的基本指标. CCK-8是测定单个细胞增殖能力及检测细胞存活和生长的有效方法, 其原理类似于MTT, 由于MTT法形成的甲臢物是非水溶性的, 需要加有机溶剂溶解, 这不仅增加了工作量, 也给实验带来了一定的误差. CCK-8法较MTT反应灵敏、快捷, 重复性好[11]. 本研究显示, 除20 µmol/L IAA组外, 其余各组与对照组相比, 差异均有统计学意义(P<0.05), 且随着药物浓度的增加, 其生长抑制率明显增高. 这与其他的研究报道IAA作用最适浓度为50 µmol/L或100 µmol/L的结论基本一致[12-13].
细胞凋亡(apoptosis)是一种由遗传决定的细胞自杀程序活化所致的生理性细胞死亡, 在细胞发育和内环境稳定中起着重要的生物学作用[14]. caspases家族属于天冬氨酸特异的半耽氨酸蛋白酶, 是凋亡的执行者. 本研究又对在凋亡执行阶段起中心作用的caspase-3 mRNA进行了检测. 统计数据表明, caspase-3 mRNA在48 h时表达较高; 同一时间点, 不同浓度的IAA/HRP实验组caspase-3 mRNA表达存在显著性差异(P<0.01). 这与国内外研究报道caspase-3在口腔正常黏膜、癌前病变及口腔癌表达基本相符[15-16]. 这说明IAA/HRP作用后SACC-2细胞增殖能力下降, 其中caspase-3 mRNA表达增高, 从而启动细胞凋亡.
综合以上结果分析表明, 植物激素中的IAA联合HRP与其他抗癌药物一样, 对SACC-2细胞有抑制作用, 并且随浓度的增加其抑制作用明显增强. 其主要效应机制是启动细胞凋亡, 这为进一步研究IAA联合HRP对口腔癌治疗作用奠定了实验基础.
涎腺腺样囊性癌是最常见的口腔颌面部恶性肿瘤之一, 严重的威胁了患者的健康. 近年来的研究证实, 吲哚乙酸(IAA)被辣根过氧化物酶(HRP)氧化后会产生细胞毒特性, 可作为一种新的肿瘤治疗药物. 通过对其作用机制的探讨, 有望寻找到治疗涎腺腺样囊性癌的分子靶点.
王文跃, 主任医师, 中日友好医院普通外科.
目前公认的治疗涎腺腺样囊性癌的方法是以手术为主、辅以化疗、放疗, 免疫治疗以及其他支持治疗的综合方案. 但术后复发和转移是患者死亡的重要原因. 因此, 筛选出涎腺腺样囊性癌治疗的靶向药物, 减轻患者的痛苦是目前研究的热点及重点.
Kim et al报道在一定的浓度范围内, 激活的吲哚乙酸对人黑色素瘤G361细胞生长有较强的抑制作用, Liao et al认为IAA/HRP的杀伤作用可能主要发生在细胞增殖期.
该实验选用IAA和HRP共同作用于涎腺腺样囊性癌细胞, 观察其对细胞的抑制作用.
本研究表明IAA联合HRP对涎腺腺样囊性癌细胞有抑制作用, 其主要效应机制是启动细胞凋亡, 为其进一步开发应用奠定了基础.
活性氧(ROS): 自由基的一种, 其可以通过引起细胞脂质过氧化、DNA损伤、降低 Bcl-2活性以及激活凋亡相关基因而诱导凋亡过程.
本文实验设计合理, 结果详实可靠, 结论有一定的说服力.
编辑: 李军亮 电编:吴鹏朕
| 1. | Esmaeli B, Ahmadi MA, Youssef A, Diba R, Amato M, Myers JN, Kies M, El-Naggar A. Outcomes in patients with adenoid cystic carcinoma of the lacrimal gland. Ophthal Plast Reconstr Surg. 2004;20:22-26. [PubMed] [DOI] |
| 2. | Goldsmith MH. Cellular signaling: new insights into the action of the plant growth hormone auxin. Proc Natl Acad Sci U S A. 1993;90:11442-11445. [PubMed] [DOI] |
| 3. | Kim DS, Jeon SE, Park KC. Oxidation of indole-3-acetic acid by horseradish peroxidase induces apoptosis in G361 human melanoma cells. Cell Signal. 2004;16:81-88. [PubMed] [DOI] |
| 4. | Veitch NC. Horseradish peroxidase: a modern view of a classic enzyme. Phytochemistry. 2004;65:249-259. [PubMed] [DOI] |
| 5. | Greco O, Rossiter S, Kanthou C, Folkes LK, Wardman P, Tozer GM, Dachs GU. Horseradish peroxidase-mediated gene therapy: choice of prodrugs in oxic and anoxic tumor conditions. Mol Cancer Ther. 2001;1:151-160. [PubMed] |
| 6. | Kim DS, Jeon SE, Jeong YM, Kim SY, Kwon SB, Park KC. Hydrogen peroxide is a mediator of indole-3-acetic acid/horseradish peroxidase-induced apoptosis. FEBS Lett. 2006;580:1439-1446. [PubMed] [DOI] |
| 7. | Yang L, Song TS, Huang C, Liu LY, Luo Y, Ni L, Si LS. [Mechanism of apoptosis induced by indole-3-acetic acids combined with horseradish peroxidase in leukemia cell line K562]. Zhongguo Shiyan Xueyexue Zazhi. 2005;13:769-773. [PubMed] |
| 8. | Wardman P. Indole-3-acetic acids and horseradish peroxidase: a new prodrug/enzyme combination for targeted cancer therapy. Curr Pharm Des. 2002;8:1363-1374. [PubMed] [DOI] |
| 9. | Kim SY, Kim MK, Kwon SB, Na JI, Park KC, Kim DS. Tumor apoptosis by indole-3-acetic acid/light in B16F10 melanoma-implanted nude mice. Arch Dermatol Res. 2009;301:319-322. [PubMed] [DOI] |
| 10. | Liao Z, Huang C, Zhou F, Xiong J, Bao J, Zhang H, Sun W, Xie C, Zhou Y. Radiation enhances suicide gene therapy in radioresistant laryngeal squamous cell carcinoma via activation of a tumor-specific promoter. Cancer Lett. 2009;283:20-28. [PubMed] [DOI] |
| 12. | Huang C, Liu LY, Song TS, Ni L, Yang L, Hu XY, Hu JS, Song LP, Luo Y, Si LS. Apoptosis of pancreatic cancer BXPC-3 cells induced by indole-3-acetic acid in combination with horseradish peroxidase. World J Gastroenterol. 2005;11:4519-4523. [PubMed] |
| 13. | Folkes LK, Greco O, Dachs GU, Stratford MR, Wardman P. 5-Fluoroindole-3-acetic acid: a prodrug activated by a peroxidase with potential for use in targeted cancer therapy. Biochem Pharmacol. 2002;63:265-272. [PubMed] [DOI] |
| 14. | Wang H, Yang X, Zhang Z, Xu H. Both calcium and ROS as common signals mediate Na(2)SeO(3)-induced apoptosis in SW480 human colonic carcinoma cells. J Inorg Biochem. 2003;97:221-230. [PubMed] [DOI] |
| 15. | Abdel-Latif AM, Abuel-Ela HA, El-Shourbagy SH. Increased caspase-3 and altered expression of apoptosis-associated proteins, Bcl-2 and Bax in lichen planus. Clin Exp Dermatol. 2009;34:390-395. [PubMed] [DOI] |
| 16. | Lee J, Lee HJ, Park JD, Lee SK, Lee SI, Lim HD, Lee YM, Yun YG, Jeon BH, Ree IS. Anti-cancer activity of highly purified sulfur in immortalized and malignant human oral keratinocytes. Toxicol In Vitro. 2008;22:87-95. [PubMed] [DOI] |