修回日期: 2009-07-29
接受日期: 2009-08-03
在线出版日期: 2009-08-18
目的: 观察β-Catenin蛋白在散发性结直肠癌(SCRC)中胞质胞核异常表达特征和基因突变发生率, 并探讨其与临床病理的相关性.
方法: 用免疫组织化学EnVision二步法检测90例SCRC与22例散发性结直肠腺瘤标本的β-Catenin蛋白在胞质胞核中的异常表达. 以PCR扩增和直接测序检测上述标本中β-Catenin基因突变.
结果: 正常结直肠黏膜中β-Catenin蛋白表达定位于细胞膜上,未见胞质胞核中的异常表达. SCRC中β-Catenin蛋白在胞质与胞核的异常表达率显著高于散发性腺瘤中的异常表达率(88.9% vs 59.1%, 41.1% vs 18.2%, P<0.05). SCRC的β-Catenin异常胞质表达率与肿瘤生长方式, 分化程度相关(P<0.05); 胞核异常表达率在溃疡型生长高于在隆起型生长(50.0% vs 26.5%, P<0.05). 胞核异常表达往往出现在肿瘤的浸润前沿. 90例SCRC中仅发现1例β-Catenin基因突变; 22例散发性结直肠腺瘤中未检测出突变.
结论: β-Catenin蛋白胞质胞核异常表达可能在SCRC的发生发展中起重要作用. 在SCRC中β-Catenin基因突变可能不是β-Catenin蛋白异常表达的主要原因.
引文著录: 覃业军, 周晓燕, 施达仁. β-Catenin蛋白在散发性结直肠癌中的异常表达和基因突变. 世界华人消化杂志 2009; 17(23): 2385-2390
Revised: July 29, 2009
Accepted: August 3, 2009
Published online: August 18, 2009
AIM: To observe the aberrant expression and mutation of β-catenin in sporadic colorectal cancer (SCRC) and explore their correlation with clinicopathological features.
METHODS: Ninety SCRC samples and 22 sporadic colorectal adenoma samples were used in this study. The aberrant expression of β-catenin was detected by immunohistochemistry. PCR amplification and direct DNA sequencing were used to identify β-catenin gene mutations.
RESULTS: In normal colorectal mucosa, β-catenin was distributed on the plasma membrane, without aberrant cytoplasmic and nuclear accumulation. The aberrant cytoplasmic and nuclear expression rates of β-catenin in SCRC were higher than those in sporadic colorectal adenomas (88.9% vs 59.1% and 41.1% vs 18.2%, respectively, P < 0.05), respectively. The aberrant cytoplasmic expression of β-catenin was significantly correlated with tumor growth pattern and differentiation (P < 0.05). The aberrant nuclear expression rate of β-catenin in ulcerative lesions was higher than that in protruding lesions (50.0% vs 26.5%, P < 0.05). Aberrant nuclear expression of β-catenin was frequently observed in the invasive front of SCRC. β-catenin gene mutation was identified in one out of 90 SCRC samples, but was not identified in all sporadic colorectal adenoma samples.
CONCLUSION: Aberrant cytoplasmic and nuclear expression of β-catenin may play an important role in the development and progression of SCRC. β-catenin mutation may not be the primary cause of aberrant β-catenin expression in SCRC.
- Citation: Qin YJ, Zhou XY, Shi DR. Aberrant expression and mutation of β-catenin in sporadic colorectal cancer. Shijie Huaren Xiaohua Zazhi 2009; 17(23): 2385-2390
- URL: https://www.wjgnet.com/1009-3079/full/v17/i23/2385.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i23.2385
β-Catenin是一个多功能蛋白, 一方面通过与钙黏蛋白结合介导同型细胞间相互黏附; 另一方面作为重要的信号转导分子参与Wnt通路的信号转导. 在正常分化的上皮细胞, 胞质内游离的β-Catenin蛋白与多蛋白复合体(由APC、Axin和GSK3β形成)结合, 因其氨基端保守的丝氨酸/苏氨酸残基被GSK3β磷酸化而被蛋白酶降解; 异常情况下, 如APC、Axin和GSK3β基因突变或β-Catenin基因自身突变使得β-Catenin蛋白不能被磷酸化而变得稳定, 导致其胞质内聚集, 然后移位到核内与Tcf/Lef结合激活靶基因的转录而引起肿瘤的发生[1-2]. 虽然在结直肠癌的发生中Wnt信号通路起着重要的作用, 而且β-Catenin蛋白作为该通路的关键分子备受关注, 但是关于结直肠癌中β-Catenin蛋白的胞质胞核异常表达及其与临床病理参数的关系各家报道不一[3-6]. 至于结直肠癌中β-Catenin基因突变, 文献报道在遗传性非息肉病性结直肠癌(hereditary nonpolyposis colorectal cancer, HNPCC)中突变高达43%[7]; 而散发性结直肠癌(sporadic colorectal cancer, SCRC)中的β-Catenin基因突变, 国外报道突变率约0%-1%[8-9], 国内有报道突变率高达28%[10], 是否存在种族差异尚需进一步研究. 本实验采用免疫组织化学方法检测SCRC中β-Catenin蛋白的异常表达状况并分析其与临床病理参数的关系; 以PCR扩增和直接测序方法检测SCRC中β-Catenin基因第3外显子的突变并分析其在SCRC发生发展中的作用.
1 材料和方法
连续收集了复旦大学附属肿瘤医院2004-07/10手术切除的结直肠癌新鲜标本90例, 其中男47例, 女43例, 年龄33-82(平均58)岁. 标本取材后立即置入液氮保存备用. 同时取材做石蜡包埋以获病理诊断结果. 正常标本25例取自癌肿旁至少大于10 cm处的黏膜, 分别作液氮冷冻和石蜡包埋. 散发腺瘤标本为2004年石蜡包埋标本22例, 男13例, 女9例, 年龄45-80(平均63)岁. 腺瘤直径0.5-4.0(平均2.1) cm. 所有病例均无遗传性结直肠肿瘤病史. β-Catenin单克隆抗体购自Zymed公司, EnVision试剂盒购自Dako公司. 本研究获得了复旦大学附属肿瘤医院伦理委员会的批准, 同时标本采集得到了病人的知情同意.
1.2.1 免疫组织化学法检测β-Catenin蛋白的表达: 用EnVision二步法, DAB显色. 以0.01 mol/L的柠檬酸(pH6.0)为抗原修复液, 通过煮沸进行抗原修复. 以TBS缓冲液代替一抗作阴性对照. 结果判定参考文献[11], β-Catenin胞质阳性细胞>30%, 胞核阳性细胞>1%, 分别记为胞质及胞核异常表达.
1.2.2 DNA提取: 新鲜标本切取20 µm冰冻切片20片, 用300 µL裂解液(20 mmol/L Tris-Cl pH8.0, 20 mmol/L EDTA, 20 g/L SDS)消化裂解后, 以酚/氯仿抽提DNA. 石蜡标本切取15 µm切片30张, 经二甲苯脱蜡后按上述方法提取DNA. 用紫外分光光度计(Beckman公司DU640型)测量DNA浓度.
1.2.3 PCR扩增和目的片断测序: 用PCR扩增β-Catenin第3外显子, 该部位是突变热点区和磷酸化调节位点区. 所用引物参考文献[12], 引物序列如下, 上游引物5-GCTGA TTTGATGGAGTTGGA-3, 下游引物5-GCTACTTGTTCTTGAGTGAA-3, 目的片段226 bp. 退火温度55℃, PCR扩增35个循环. 目的产物送上海基康生物公司纯化后, 在Applied Biosystem 3700 DNA测序仪上测序. 测序引物同上, 双向测序. 发现突变时重复一次测序.
统计学处理 采用SPSS11.5软件进行χ2检验或精确概率检验, P<0.05有显著性意义.
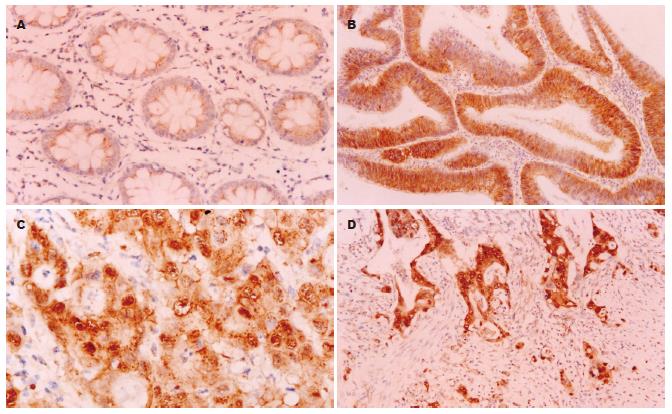
正常结直肠黏膜β-Catenin蛋白表达呈清晰的棕黄色染色, 阳性表达全部定位于细胞膜上, 未见胞质胞核中的异常表达(图1A). 散发性结直肠腺瘤和腺癌组织出现胞质和胞核的异常表达, 膜表达有不同程度的降低, 胞核异常表达者均显示胞质异常表达(图1B-D). 在SCRC中β-Catenin的胞质和胞核表达率(分别为88.9%和41.1%)显著高于散发性结直肠腺瘤(分别为59.1%和18.2%)(P<0.05, 表1). SCRC的β-Catenin异常胞质表达与肿瘤生长方式, 分化程度相关(P<0.05), 但与生长部位、浸润深度及淋巴结转移等临床病理参数无关(表2). 核表达多为灶性分布, 主要在肿瘤浸润前沿呈阳性表达. SCRC的β-Catenin核表达率在浸润型和溃疡型生长高于在隆起型生长(50.0% vs 26.5%, P<0.05), 与生长部位、分化程度、浸润深度及淋巴结转移等临床病理参数无关.
| n | 胞质 | P值 | 胞核 | P值 | |
| 部位 | |||||
| 右半结肠 | 14 | 11(78.6) | 4(28.6) | ||
| 左半结肠 | 14 | 13(92.9) | 7(50.0) | ||
| 直肠 | 62 | 56(90.3) | 0.576 | 26(41.9) | 0.501 |
| 生长方式 | |||||
| 隆起型 | 34 | 27(79.4) | 9(26.5) | ||
| 溃疡及浸润型 | 56 | 53(94.6) | 0.038 | 28(50.0) | 0.028 |
| 分化程度 | |||||
| 高分化 | 11 | 11(100.0) | 4(36.4) | ||
| 中分化 | 58 | 54(93.1) | 26(44.8) | ||
| 低分化 | 21 | 15(71.4) | 0.018 | 7(33.3) | 0.619 |
| 浸润深度 | |||||
| 深肌层以内 | 27 | 25(92.6) | 12(44.4) | ||
| 全层 | 63 | 55(87.3) | 0.717 | 25(39.7) | 0.674 |
| 淋巴结转移 | |||||
| 有 | 52 | 45(86.5) | 20(38.5) | ||
| 无 | 38 | 35(92.1) | 0.509 | 17(44.7) | 0.550 |
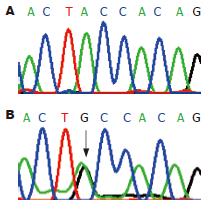
90例SCRC标本中仅有1例在第3外显子发生点突变(图2), 呈杂合性突变, 为41密码子ACC→GCC, 即苏氨酸变成丙氨酸, 突变率约1%. 22例散发性腺瘤未发现第3外显子突变. 该例β-Catenin第3外显子突变患者为男性, 81岁. 癌肿在升结肠, 中低分化, 浸透肠壁全层, β-Catenin在胞质和核内异常表达.
β-Catenin蛋白是Wnt通路中的关键分子, 被认为在消化系肿瘤的发生中起重要作用[13]. 本研究发现在SCRC中β-Catenin胞质及核内异常表达率为88.9%和41.1%, 显著高于散发性腺瘤中胞质及核内异常表达率(59.1%和18.2%), 而在正常结直肠黏膜上皮细胞中未见β-Catenin异常表达, 这表明β-Catenin的异常表达与结直肠肿瘤的发生发展密切相关[14]. 对Wnt通路中关键成分异常改变的认识是研究结直肠癌新的治疗靶点的基础[15], 已有实验用姜黄素(curcumin)抑制β-Catenin的功能而下调靶基因的表达[16].
β-Catenin蛋白胞质异常表达率从42%到100%不等[4-5,17], 但与临床病理参数关系的分析报道较少. 本研究显示β-Catenin蛋白胞质异常表达仅与肿瘤生长方式、分化程度有关, 即溃疡型和浸润型生长、高中分化腺癌的胞质异常表达率分别高于隆起型生长、低分化腺癌, 差异有显著性意义. 不同的生长方式可能涉及不同的分子机制. β-Catenin蛋白胞质异常表达与SCRC的分化程度有关, 这与文献中的报道相似[3-4,18]. 但本研究中β-Catenin胞质异常表达率在低分化SCRC中是低下的, 其发生机制尚不清楚, 可能与蛋白合成障碍有关.
胞质内异常表达的β-Catenin蛋白易位到胞核后才能激活靶基因的转录, 因此多数作者更加注重胞核β-Catenin异常表达的研究. β-Catenin蛋白的核表达率从12.8%到98%不等[4-6], 与临床病理变量的关系的报道不尽一致. 有报道β-Catenin蛋白核异常表达与SCRC的分级分期及淋巴结转移无关[4-5]; 有报道核异常表达与黏膜内癌的发展有关[19]; 有报道弥漫性核表达是生存期短的独立预测指标[20]; 也有报道核高表达与淋巴结转移及预后差有关[6], 认为β-Catenin的核表达可作为SCRC的预后指标. 研究结果的差异可能与实验方法不同、结果判断标准不一致和肿瘤的异质性等因素有关. 本研究发现β-Catenin核表达率为41.1%, 只与SCRC生长方式相关, 即β-Catenin核表达率在浸润型和溃疡型生长(50.0%)显著高于在隆起型生长(26.5%). 这与Chiang et al[21]的报道一致, 他们认为这2种类型可能存在不同的分子机制, 隆起型生长与Ras基因突变导致细胞过度增殖有关, 而溃疡型则与β-Catenin胞核异常表达引起靶基因MMP-7的过度表达导致组织酶性溶解密切相关. 我们还发现β-Catenin往往在肿瘤的浸润前沿呈现核表达, 与Brabletz et al的观察结果一致[22]. 他们认为细胞核β-Catenin聚集可能获得一种适应环境的能力, 保持差分化而参与肿瘤的侵袭和转移过程. MMP-7和uPA参与基质蛋白的溶解, 与肿瘤的侵袭行为相关. 文献报道MMP-7和uPA在浸润前沿表达增高[23-24], 受β-Catenin的正调节, 提示β-Catenin核表达在结直肠癌发展中有重要的作用.
关于β-Catenin异常表达的机制, 现认为与APC突变或β-Catenin点突变导致β-Catenin失降解有关[1]. 然而, 荷兰最近的大样本研究显示APC基因突变在SCRC为72%(479/665), 而其截短突变率仅37%[25], 并不是很高. 因而推测β-Catenin基因突变可能起重要作用. 文献报道在HNPCC中β-Catenin基因突变率达43%[7], 认为β-Catenin基因突变在HNPCC发生中有重要的作用. 但针对SCRC的β-Catenin基因突变研究, 有报道未发现β-Catenin基因突变[8,26], 或突变率很低(<1%)[9,27-28]. 国内有报道β-Catenin基因突变率高达28%[10], 与国外的报道不同. 本研究显示在SCRC中β-Catenin突变率约1%, 与国外的报道相似. 本实验中的1例突变发生在β-Catenin基因第3外显子的41密码子, 为ACC→GCC, 即苏氨酸变为丙氨酸. 该突变位点是结直肠癌β-Catenin第3外显子常见的突变热点和磷酸化调节位点[29]. 实验表明在人SCRC中β-Catenin突变很少见, 国内外突变率相符, 未显示种族差异. 国内文献报道β-Catenin的突变率较高[10], 究其原因可能与研究的样本有关, 因为他们未明确将SCRC和HNPCC分开研究, 而在HNPCC有较高的β-Catenin突变率[7,30]. 另外, Samowitz et al发现β-Catenin的突变在小腺瘤中更常见, 而在浸润性腺癌中并不常, 认为β-Catenin突变在结直肠肿瘤的发生中是一个早期事件, 伴突变的小腺瘤似乎不可能进展为大腺瘤和浸润性腺癌[28]. 本研究在散发性腺瘤中未发现突变(0/22), 可能与腺瘤直径较大或者全为外生型肿瘤有关[31].
总之, 在SCRC中β-Catenin有较高的胞质胞核异常表达率, 与肿瘤的发生发展密切相关. 但β-Catenin基因突变在SCRC及散发性结直肠腺瘤中是一个罕见事件, 推测在SCRC中β-Catenin突变不是β-Catenin胞质胞核异常表达的主要原因, 且在SCRC的发生发展中不起主要作用.
现认为Wnt信号通路的激活在结直肠癌的发生发展中起着重要作用. β-Catenin蛋白是Wnt信号通路的关键蛋白, 关于其在胞质胞核内的异常表达情况及其机制的研究是当今肿瘤研究中的一个热点.
施瑞华, 教授, 南京医科大学第一附属医院消化科.
目前, 关于结直肠癌中β-Catenin蛋白的胞质胞核异常表达及其与临床病理参数的关系报道不一. 而国内外关于结直肠癌中β-Catenin基因突变率的报道较少, 且结果相差较大. 因此, 针对结直肠癌中β-Catenin从蛋白到基因水平的大样本研究是急需的.
本课题以较大的样本量专门研究了散发性结直肠癌中β-Catenin蛋白的胞质胞核异常表达, 发现其与肿瘤的生长方式及分化程度相关. 同时用直接测序方法检测β-Catenin基因, 发现其突变率在散发性结直肠癌约1%, 突变率很低, 这表明β-Catenin基因突变不是引起β-Catenin蛋白胞质胞核异常表达的主要机制.
本文证实了散发性结直肠癌中β-Catenin蛋白的胞质胞核异常表达情况及其与肿瘤的生长方式和分化程度关系, 并明确β-Catenin基因突变在引起β-Catenin蛋白胞质胞核异常表达机制中所占的地位. 这为进一步探索Wnt信号通路中主要分子在散发性结直肠癌发生发展中的作用机制奠定了基础.
本研究设计合理, 有一定的创新性, 所用分子生物学方法合理正确, 学术价值较好.
编辑: 李军亮 电编:吴鹏朕
| 1. | Bienz M, Clevers H. Linking colorectal cancer to Wnt signaling. Cell. 2000;103:311-320. [PubMed] [DOI] |
| 2. | Brabletz T, Jung A, Kirchner T. Beta-catenin and the morphogenesis of colorectal cancer. Virchows Arch. 2002;441:1-11. [PubMed] [DOI] |
| 3. | 黄 琼, 朱 益民, 邢 晓明, 来 茂德. β-Catenin在结直肠肿瘤中的异常表达及其意义. 浙江大学学报(医学版). 2004;33:121-124. |
| 4. | Maruyama K, Ochiai A, Akimoto S, Nakamura S, Baba S, Moriya Y, Hirohashi S. Cytoplasmic beta-catenin accumulation as a predictor of hematogenous metastasis in human colorectal cancer. Oncology. 2000;59:302-309. [PubMed] [DOI] |
| 5. | Chung GG, Provost E, Kielhorn EP, Charette LA, Smith BL, Rimm DL. Tissue microarray analysis of beta-catenin in colorectal cancer shows nuclear phospho-beta-catenin is associated with a better prognosis. Clin Cancer Res. 2001;7:4013-4020. [PubMed] [DOI] |
| 6. | Wong SC, Lo ES, Lee KC, Chan JK, Hsiao WL. Prognostic and diagnostic significance of beta-catenin nuclear immunostaining in colorectal cancer. Clin Cancer Res. 2004;10:1401-1408. [PubMed] [DOI] |
| 7. | Miyaki M, Iijima T, Kimura J, Yasuno M, Mori T, Hayashi Y, Koike M, Shitara N, Iwama T, Kuroki T. Frequent mutation of beta-catenin and APC genes in primary colorectal tumors from patients with hereditary nonpolyposis colorectal cancer. Cancer Res. 1999;59:4506-4509. [PubMed] |
| 8. | Garinis GA, Spanakis NE, Menounos PG, Manolis EN, Peros G. Transcriptional impairment of beta-catenin/E-cadherin complex is not associated with beta-catenin mutations in colorectal carcinomas. Br J Cancer. 2003;88:206-209. [PubMed] [DOI] |
| 9. | Lüchtenborg M, Weijenberg MP, Wark PA, Saritas AM, Roemen GM, van Muijen GN, de Bruïne AP, van den Brandt PA, de Goeij AF. Mutations in APC, CTNNB1 and K-ras genes and expression of hMLH1 in sporadic colorectal carcinomas from the Netherlands Cohort Study. BMC Cancer. 2005;5:160. [PubMed] [DOI] |
| 10. | 王 东旭, 苏 铃, 房 殿春, 李 伟, 王 建文, 闫 晓初. 大肠腺瘤及癌组织中β-Catenin、APC及CD44V6异常改变的意义. 中华腹部疾病杂志. 2003;3:781-784. |
| 11. | Aust DE, Terdiman JP, Willenbucher RF, Chew K, Ferrell L, Florendo C, Molinaro-Clark A, Baretton GB, Löhrs U, Waldman FM. Altered distribution of beta-catenin, and its binding proteins E-cadherin and APC, in ulcerative colitis-related colorectal cancers. Mod Pathol. 2001;14:29-39. [PubMed] [DOI] |
| 12. | Garcia-Rostan G, Tallini G, Herrero A, D'Aquila TG, Carcangiu ML, Rimm DL. Frequent mutation and nuclear localization of beta-catenin in anaplastic thyroid carcinoma. Cancer Res. 1999;59:1811-1815. [PubMed] [DOI] |
| 16. | Jaiswal AS, Marlow BP, Gupta N, Narayan S. Beta-catenin-mediated transactivation and cell-cell adhesion pathways are important in curcumin (diferuylmethane)-induced growth arrest and apoptosis in colon cancer cells. Oncogene. 2002;21:8414-8427. [PubMed] [DOI] |
| 17. | Iwamoto M, Ahnen DJ, Franklin WA, Maltzman TH. Expression of beta-catenin and full-length APC protein in normal and neoplastic colonic tissues. Carcinogenesis. 2000;21:1935-1940. [PubMed] [DOI] |
| 19. | Kobayashi M, Honma T, Matsuda Y, Suzuki Y, Narisawa R, Ajioka Y, Asakura H. Nuclear translocation of beta-catenin in colorectal cancer. Br J Cancer. 2000;82:1689-1693. [PubMed] |
| 20. | Hugh TJ, Dillon SA, Taylor BA, Pignatelli M, Poston GJ, Kinsella AR. Cadherin-catenin expression in primary colorectal cancer: a survival analysis. Br J Cancer. 1999;80:1046-1051. [PubMed] [DOI] |
| 21. | Chiang JM, Chou YH, Chen TC, Ng KF, Lin JL. Nuclear beta-catenin expression is closely related to ulcerative growth of colorectal carcinoma. Br J Cancer. 2002;86:1124-1129. [PubMed] [DOI] |
| 22. | Brabletz T, Jung A, Reu S, Porzner M, Hlubek F, Kunz-Schughart LA, Knuechel R, Kirchner T. Variable beta-catenin expression in colorectal cancers indicates tumor progression driven by the tumor environment. Proc Natl Acad Sci U S A. 2001;98:10356-10361. [PubMed] [DOI] |
| 23. | Ougolkov AV, Yamashita K, Mai M, Minamoto T. Oncogenic beta-catenin and MMP-7 (matrilysin) cosegregate in late-stage clinical colon cancer. Gastroenteriology. 2002;122:60-71. [PubMed] [DOI] |
| 24. | Hiendlmeyer E, Regus S, Wassermann S, Hlubek F, Haynl A, Dimmler A, Koch C, Knoll C, van Beest M, Reuning U. Beta-catenin up-regulates the expression of the urokinase plasminogen activator in human colorectal tumors. Cancer Res. 2004;64:1209-1214. [PubMed] [DOI] |
| 25. | Lüchtenborg M, Weijenberg MP, Roemen GM, de Bruïne AP, van den Brandt PA, Lentjes MH, Brink M, van Engeland M, Goldbohm RA, de Goeij AF. APC mutations in sporadic colorectal carcinomas from The Netherlands Cohort Study. Carcinogenesis. 2004;25:1219-1226. [PubMed] |
| 26. | Nilbert M, Rambech E. Beta-catenin activation through mutation is rare in rectal cancer. Cancer Genet Cytogenet. 2001;128:43-45. [PubMed] [DOI] |
| 27. | Kitaeva MN, Grogan L, Williams JP, Dimond E, Nakahara K, Hausner P, DeNobile JW, Soballe PW, Kirsch IR. Mutations in beta-catenin are uncommon in colorectal cancer occurring in occasional replication error-positive tumors. Cancer Res. 1997;57:4478-4481. [PubMed] |
| 28. | Samowitz WS, Powers MD, Spirio LN, Nollet F, van Roy F, Slattery ML. Beta-catenin mutations are more frequent in small colorectal adenomas than in larger adenomas and invasive carcinomas. Cancer Res. 1999;59:1442-1444. [PubMed] |
| 29. | Provost E, Yamamoto Y, Lizardi I, Stern J, D'Aquila TG, Gaynor RB, Rimm DL. Functional correlates of mutations in beta-catenin exon 3 phosphorylation sites. J Biol Chem. 2003;278:31781-31789. [PubMed] [DOI] |
| 30. | Johnson V, Volikos E, Halford SE, Eftekhar Sadat ET, Popat S, Talbot I, Truninger K, Martin J, Jass J, Houlston R. Exon 3 beta-catenin mutations are specifically associated with colorectal carcinomas in hereditary non-polyposis colorectal cancer syndrome. Gut. 2005;54:264-267. [PubMed] [DOI] |
| 31. | Mikami M, Nosho K, Yamamoto H, Takahashi T, Maehata T, Taniguchi H, Adachi Y, Imamura A, Fujita M, Hosokawa M. Mutational analysis of beta-catenin and the RAS-RAF signalling pathway in early flat-type colorectal tumours. Eur J Cancer. 2006;42:3065-3072. [PubMed] [DOI] |