修回日期: 2009-07-27
接受日期: 2009-08-03
在线出版日期: 2009-08-18
目的: 研究氩氦刀冷冻消融对SD大鼠皮下移植瘤细胞凋亡及T细胞免疫的影响, 评价氩氦刀冷冻治疗对大鼠免疫功能的影响.
方法: 将45只大鼠随机分成3组: 正常对照组, 荷瘤对照组, 冷冻治疗组, 每组15只. 建立SD大鼠皮下移植瘤动物模型. 冷冻治疗组: 消融冷冻治疗3-5 min, 复温时间30 s. 荷瘤对照组: 将氩氦刀置入肿瘤3 min, 而不予冷冻治疗. 正常对照组: 正常饲养. 分别于冷冻后3, 12, 24 h和3, 7 d时处死动物, 取材. 光学显微镜观察冷冻坏死消融规律; 末端标记法(TUNEL)原位检测周边冷冻损伤区带细胞凋亡和检测特异性细胞毒性T淋巴细胞的增殖.
结果: 在冷冻中心区, 细胞死亡以坏死为主, 在周边冷冻损伤区, 光镜形态学检查及TUNEL染色可观察到明确的细胞凋亡, 术后12 h凋亡达高峰, 凋亡率为68.28%±7.85%. 氩氦刀治疗后可显著刺激特异性T淋巴细胞增殖, 与对照组比较具有显著性差异(P<0.01).
结论: 氩氦刀通过坏死和凋亡两种途径达到有效的消融, 并且可有效激活小鼠肿瘤抗原特异性的T细胞, 氩氦冷冻有效地诱发和增强机体的抗肿瘤免疫效应.
引文著录: 刘建刚, 管洪在, 葛成林, 张积仁. 氩氦冷冻对SD大鼠皮下移植瘤细胞凋亡及T细胞免疫的影响. 世界华人消化杂志 2009; 17(23): 2362-2366
Revised: July 27, 2009
Accepted: August 3, 2009
Published online: August 18, 2009
AIM: To investigate the effects of argon-helium (Ar-He) cryoablation on cell apoptosis and T-cell immunity in rats subcutaneously implanted with breast cancer cells.
METHODS: Forty-five healthy male Sprague-Dawley rats were randomly divided into three groups: normal control group, cancer control group and cryoablation group. A xenograft rat model of breast cancer was established by subcutaneous injection of breast cancer cells (W-256) into Sprague-Dawley rats. After argon-helium cryoablation, cell necrosis was observed under light microscopy, cell apoptosis in peripheral cryoablation zone was detected by terminal deoxynucleotidyl transferase-mediated dUTP in situ nick end labeling (TUNEL), and the proliferation of cytotoxic T lymphocytes was investigated using mixed lymphocyte reaction assay.
RESULTS: In central cryoablation zone, necrosis dominated in cell death. In peripheral cryoablation zone, cell apoptosis was definitely observed by morphological examination under light microscopy or TUNEL staining. The apoptosis reached the peak at 12 h after cryoablation, with an apoptosis rate of (68.28 ± 7.85)%. Cryoablation could effectively activate the proliferation of cytotoxic T lymphocytes. The proliferation rate of cytotoxic T lymphocytes in the cryoablation group was significantly higher than that in the cancer control group (P < 0.01).
CONCLUSION: Argon-helium cryoablation can effectively cause cell death either through inducing necrosis or apoptosis. Cryoablation may induce cell apoptosis in peripheral cryoablation zone. Besides, cryosurgery can effectively activate tumor antigen-specific T lymphocytes and improve T cell-mediated immunity.
- Citation: Liu JG, Guan HZ, Ge CL, Zhang JR. Effect of argon-helium cryoablation on cell apoptosis and T-cell immunity in rats subcutaneously implanted with breast cancer cells. Shijie Huaren Xiaohua Zazhi 2009; 17(23): 2362-2366
- URL: https://www.wjgnet.com/1009-3079/full/v17/i23/2362.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i23.2362
氩氦刀冷冻治疗是目前治疗恶性肿瘤的有效方法之一, 因具有安全、有效、微创、不良反应小等特点, 已成为一种令人关注的肿瘤微创治疗技术. 目前已经应用于前列腺癌、肺癌、肝癌等多种实体瘤的治疗[1-2]. 肿瘤的发生、发展、转移是与机体免疫功能密切相关的过程, 目前的资料显示对氩氦冷冻对机体免疫功能的影响的研究较少. 我们通过实验观察氩氦刀冷冻消融治疗对SD大鼠皮下移植瘤组织坏死和细胞凋亡的影响以及检测特异性细胞毒性T淋巴细胞的增殖, 以进一步探讨氩氦刀冷冻消融治疗肿瘤的免疫效应, 为临床应用提供理论依据.
SD大鼠45只, ♂, 月龄2-3 mo, 体质量200±10 g, 华中科技大学同济医学院实验动物中心提供. 胸腺嘧啶核苷, 丝裂霉素C, 3H-TdR, TUNEL原位免疫组织化学试剂盒, β液闪计数仪为美国Beckman公司产品. 氩氦靶向冷冻治疗系统-氩氦刀为美国Endocare公司生产.
1.2.1 分组及造模: 将45只大鼠随机分成3组: 荷瘤对照组(A组), 冷冻治疗组(B组), 正常对照组(C组), 每组15只. 另取2只大鼠作为种鼠, 建立腹水模型. 待腹水生成后乙醚麻醉待接种大鼠, 取右后腿外侧新洁尔灭配消毒皮下注射腹水, 用1 mL注射器抽取腹水, 每个注射点用0.4 mL, 含肿瘤细胞数约4×107个. 接种30只大鼠, 隔天测量肿瘤大小, 得出体积平均值. 2 wk后, 游标卡尺测量肿瘤体积平均为3.5 cm3. 同时将15只大鼠皮下接种生理盐水作为对照组.
1.2.2 处理大鼠: 10%水合氯醛腹腔麻醉(0.25 mL/100 g)后分别予以处理. 冷冻治疗组: 将荷瘤大鼠肿瘤处被毛剪除, 置于金属托盘内, 将肿瘤处酒精消毒, 直视下将消融针插入肿瘤组织内, 冷冻时间3-5 min, 复温时间30 s. 荷瘤对照组:将氩氦刀置入肿瘤3 min, 而不予冷冻治疗. 正常对照组:正常饲养.
1.2.3 取材: 分别于冷冻后3, 12, 24 h和3, 7 d时处死动物, 取材. 每组各时间点各处死小鼠3只, 完整剥离肿瘤组织.
1.2.4 细胞毒性T淋巴细胞(Tc)的增殖反应: 大鼠处死后取脾脏, 制备单细胞悬液, 制备尼龙毛柱. 1×108细胞重悬于2 mL RPMI 1640培养基中, 细胞悬液过尼龙毛柱, 获取T淋巴细胞. 苔盼蓝染色检测活细胞比例. 调节T淋巴细胞为5×109/L. 将分离的肿瘤坏死组织制作成匀浆, 用RPMI 1640培养基10 000、1000、100、10、1倍稀释后加入96孔板中, 使T淋巴细胞与抗原混合, 静置培养3 d. 混合培养结束前, 加入稀释的3H-TdR, 每孔实际放射比活度为1 μCi, 培养12 h后PBS液冲洗培养孔收集细胞, 滤纸点样, 10%三氯乙酸、无水乙醇洗涤、固定. 滤纸片60℃烘干后放入盛有闪烁记数液的计数瓶中, Beckman液闪记数仪测CPM值. 以空白T细胞孔及空白DMEM培养基孔分别对照检测. 每组实验重复3次.
统计学处理 所有数据均采用应用SPSS12.0统计软件进行分析. 以P<0.05为有统计学意义.
2 结果
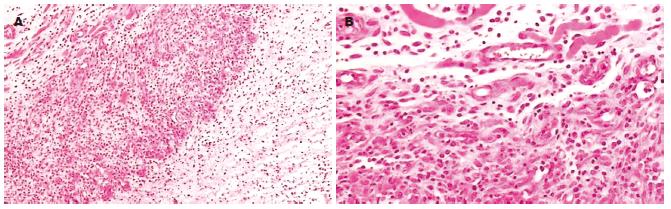
氩氦刀冷冻消融治疗SD大鼠皮下移植瘤, 冷冻后病灶局部可见3个比较明显的分区(图1A): 冷冻区中心(围绕氩氦刀探头插入处)细胞完全坏死崩解, 核碎裂, 呈凝固性坏死; 坏死区域周边出现明显的损伤区带, 其中仍可见部分癌细胞, 但细胞皱缩, 核浓集, 染色质固缩, 呈典型的凋亡细胞特征. 局部血管充血、栓塞、渗出(图1B); 外围则是未受损的肿瘤细胞, 形态正常.
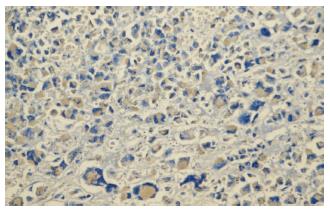
对SD大鼠皮下移植瘤实施局部冷冻后, TUNEL染色结果显示, 凋亡细胞主要集中分布在冰球周围损伤区带, 细胞出现了凋亡特有的形态学变化: 表现为细胞核着棕黄色, 核固缩, 染色质浓缩, 部分细胞已经破碎溶解(图2), 荷瘤对照组肿瘤组织中少量凋亡细胞散在分布. 与荷瘤对照组相比, 冷冻组各时间点凋亡细胞阳性率均显著增高(P<0.05, 表1). 冷冻组凋亡细胞于术后3 h即开始增多, 术后12 h凋亡达高峰68.28%±7.85%.
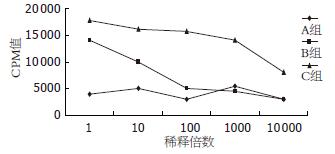
以正常对照组小鼠为对照, 荷瘤对照组小鼠接种肿瘤后, 肿瘤相关抗原浓度较高时可诱发特异性T淋巴细胞增殖; 冷冻组荷瘤小鼠经氩氦刀冻融瘤体后, 在肿瘤相关抗原稀释10 000倍时, 还可以诱发抗原特异性的T淋巴细胞增殖反应, 较荷瘤对照组更强(图3).
氩氦靶向肿瘤治疗技术是FDA于1998年批准, 欧盟CE认证的一项代表2l世纪科学技术发展水平的肿瘤微创外科治疗系统(endocare cryocare TM surgical system), 简称氩氦刀. 由于操作安全、禁忌证少、出血少、组织反应轻、不良反应少等优点, 目前氩氦刀在肿瘤的治疗中得到越来越广泛的应用. 是继射频, 微波, 激光, 超声波聚集, γ-射线, 中子射线之后又一新的肿瘤局部消融治疗手段[1]. 治疗时, 氩氦刀冷冻冰球中心的温度可达-125℃左右, 可致细胞完全坏死消融. 但随着距探头中心距离的增加, 温度逐渐回升[3], 冰球周围癌细胞并未坏死, 而表现为一个冷冻损伤区带. 研究氩氦刀对该区域组织细胞的影响, 对于手术靶区设计及解决术后残留问题, 具有重要的临床意义.
本实验的研究结果显示, 皮下移植瘤经氩氦刀冷冻消融后, 在冷冻中心区域, 肿瘤组织消融比较完全, 细胞完全坏死崩解, 核碎裂, 呈凝固性坏死. 在坏死区域周边出现明显的损伤区带, 其中仍可见部分癌细胞, 但细胞皱缩, 染色质固缩, 呈典型的凋亡细胞特征. 并且在冷冻后相当长的时间内, 冷冻损伤区带细胞仍存在较高的凋亡率. 这与国外实验结果一致[4-14]. 提示可能由于坏死和低氧血症等共同诱导的继发炎症反应, 构成了冷冻后的延迟效应, 也可以诱导细胞凋亡, 其凋亡机制可能亦参与了冷冻所致的细胞损伤. 国内亦有研究[15]表明在冷冻后冰球周边损伤区带组织可观察到caspase-3剪切, 这提示我们在氩氦冷冻消融治疗后, 有必要联合放、化疗等治疗手段, 以进一步促进冷冻周边损伤区带细胞凋亡, 进而提高冷冻治疗的效果.
氩氦刀治疗是利用超低温快速冷冻、解冻过程, 破坏细胞膜, 引起局部肿瘤细胞破坏, 反复冻融可以使肿瘤抗原持续缓慢释放入血, 理论上可以有效诱发肿瘤特异性免疫反应[16-19]. Tc淋巴细胞激活是抗肿瘤免疫的效应阶段. Tc亚群在体内以非活化的前体细胞(pTc)形式存在, 在经过抗原激活及辅助性T细胞(CD4+, Th)协同作用下分化发育为效应Tc细胞后通过双信号途径发挥细胞毒性, 起到杀灭肿瘤细胞的作用. 细胞毒T淋细胞(cytotoxic T lymphocyte, CTL)细胞的杀瘤活性明显升高机制可能有二: 一方面是冻融细胞内抗原释放被CTL识别, 刺激CTL特异性的杀瘤活性有关; 另一方面, 以往的实验表明冻融的肿瘤细胞能诱导单个核细胞高表达IL-12, IL-12可以有效激活NK细胞活性, 促使CD4+ T细胞向Th1亚群分化, 并刺激CTL成熟, 上调CTL的活性[20-27]. 本研究证明氩氦冷冻具有对肿瘤相关抗原特异性细胞毒性T细胞的激活、增殖作用, 氩氦刀治疗后肿瘤相关抗原的持续释放, 可有效诱发、增强机体的抗肿瘤免疫, 如果和CIK过继免疫治疗、树突状疫苗等免疫治疗方法联合应用, 将会在中晚期肿瘤的临床治疗方面开辟新的局面, 缓解患者痛苦, 提高生活质量, 减少肿瘤复发.
氩氦刀是一种新型的通过超低温冷冻治疗肿瘤的微创手术操作系统, 关于其对机体免疫功能的影响研究较少, 对其上调机体免疫功能的机制尚未阐明.
王蒙, 副教授, 中国人民解放军第二军医大学附属东方肝胆外科医院肝外综合治疗一科.
氩氦冷冻增强TCL细胞的杀伤功能的机制尚不清楚, 涉及肿瘤抗原的刺激以及相关细胞因子的共同作用, 其中冻融肿瘤抗原的刺激可能起了决定性作用.
目前对于氩氦刀的研究多数集中于其局部消融时间、范围和效果等领域, 对于其对免疫功能的影响的研究未能深入. 李泳群 et al研究肺癌细胞体外冷冻消融后的冻融组织能够上调IL-2的表达和活化单个核细胞的杀伤活性.
该研究以氩氦刀冷冻消融SD大鼠皮下移植瘤, 观察其对细胞凋亡及T细胞免疫的影响. 得出氩氦冷冻可有效激活小鼠肿瘤抗原特异性的T细胞, 有效地诱发和增强机体的抗肿瘤免疫效应结论.
氩氦冷冻治疗后肿瘤相关抗原的持续释放, 可有效诱发、增强机体的抗肿瘤免疫, 如果和CIK过继免疫治疗、树突状疫苗等免疫治疗方法联合应用, 使冷冻治疗由单纯的局部治疗上升为全身治疗, 可能为肿瘤治疗提供了一条新的有效途径.
本研究实用性强, 具有较好的参考价值.
编辑: 李军亮 电编:吴鹏朕
| 3. | Schacht V, Becker K, Szeimies RM, Abels C. Apoptosis and leucocyte-endothelium interactions contribute to the delayed effects of cryotherapy on tumours in vivo. Arch Dermatol Res. 2002;294:341-348. [PubMed] |
| 4. | Yaren A, Oztop I, Kargi A, Ulukus C, Onen A, Sanli A, Binicier O, Yilmaz U, Alakavuklar M. Bax, bcl-2 and c-kit expression in non-small-cell lung cancer and their effects on prognosis. Int J Clin Pract. 2006;60:675-682. [PubMed] [DOI] |
| 5. | Jungraithmayr W, Burger D, Olschewski M, Eggstein S. Cryoablation of malignant liver tumors: results of a single center study. Hepatobiliary Pancreat Dis Int. 2005;4:554-560. [PubMed] |
| 6. | Mazur P, Seki S, Pinn IL, Kleinhans FW, Edashige K. Extra- and intracellular ice formation in mouse oocytes. Cryobiology. 2005;51:29-53. [PubMed] [DOI] |
| 7. | Schneider U, Mazur P. Relative influence of unfrozen fraction and salt concentration on the survival of slowly frozen eight-cell mouse embryos. Cryobiology. 1987;24:17-41. [PubMed] [DOI] |
| 8. | Zawlodzka S, Takamatsu H. Osmotic injury of PC-3 cells by hypertonic NaCl solutions at temperatures above 0 degrees C. Cryobiology. 2005;50:58-70. [PubMed] [DOI] |
| 9. | Shapiro L, Dinarello CA. Hyperosmotic stress as a stimulant for proinflammatory cytokine production. Exp Cell Res. 1997;231:354-362. [PubMed] [DOI] |
| 10. | den Brok MH, Sutmuller RP, Nierkens S, Bennink EJ, Toonen LW, Figdor CG, Ruers TJ, Adema GJ. Synergy between in situ cryoablation and TLR9 stimulation results in a highly effective in vivo dendritic cell vaccine. Cancer Res. 2006;66:7285-7292. [PubMed] [DOI] |
| 11. | Redondo P, del Olmo J, López-Diaz de Cerio A, Inoges S, Marquina M, Melero I, Bendandi M. Imiquimod enhances the systemic immunity attained by local cryosurgery destruction of melanoma lesions. J Invest Dermatol. 2007;127:1673-1680. [PubMed] |
| 12. | Sabel MS, Nehs MA, Su G, Lowler KP, Ferrara JL, Chang AE. Immunologic response to cryoablation of breast cancer. Breast Cancer Res Treat. 2005;90:97-104. [PubMed] [DOI] |
| 13. | Osada S, Imai H, Tomita H, Tokuyama Y, Okumura N, Matsuhashi N, Sakashita F, Nonaka K. Serum cytokine levels in response to hepatic cryoablation. J Surg Oncol. 2007;95:491-498. [PubMed] [DOI] |
| 18. | den Brok MH, Sutmuller RP, Nierkens S, Bennink EJ, Frielink C, Toonen LW, Boerman OC, Figdor CG, Ruers TJ, Adema GJ. Efficient loading of dendritic cells following cryo and radiofrequency ablation in combination with immune modulation induces anti-tumour immunity. Br J Cancer. 2006;95:896-905. [PubMed] [DOI] |
| 21. | 杜 英, 陈 绍倩, 黄 玉敏, 董 子明. 人脐血树突状细胞分泌外来体的特性及其增强CTL杀伤活性的研究. 细胞与分子免疫学杂志. 2006;22:33-37. |
| 22. | Büssing A, Stumpf C, Tröger W, Schietzel M. Course of mitogen-stimulated T lymphocytes in cancer patients treated with Viscum album extracts. Anticancer Res. 2007;27:2903-2910. [PubMed] |
| 23. | Udagawa M, Kudo-Saito C, Hasegawa G, Yano K, Yamamoto A, Yaguchi M, Toda M, Azuma I, Iwai T, Kawakami Y. Enhancement of immunologic tumor regression by intratumoral administration of dendritic cells in combination with cryoablative tumor pretreatment and Bacillus Calmette-Guerin cell wall skeleton stimulation. Clin Cancer Res. 2006;12:7465-7475. [PubMed] [DOI] |
| 25. | Urano M, Tanaka C, Sugiyama Y, Miya K, Saji S. Antitumor effects of residual tumor after cryoablation: the combined effect of residual tumor and a protein-bound polysaccharide on multiple liver metastases in a murine model. Cryobiology. 2003;46:238-245. [PubMed] [DOI] |