修回日期: 2009-07-15
接受日期: 2009-07-27
在线出版日期: 2009-08-18
目的: 探讨苯丙素甙化合物逆转大肠癌耐药与凋亡的关系.
方法: 实验分3组: LoVo/Adr细胞组(空白对照组); LoVo/Adr细胞+PPG 40 mg/L组(实验组); LoVo/Adr细胞+VP 5 mg/L(阳性对照组). 采用MTT法检测苯丙素甙对LoVo/Adr细胞的耐药性; 流式细胞仪分析苯丙素甙对大肠癌耐药LoVo细胞的凋亡的作用; 通过检测pNA量观察苯丙素甙对LoVo/Adr细胞Caspase-3的活性.
结果: 苯丙素甙可降低阿霉素对LoVo/Adr细胞的IC50值, 具有逆转作用, 其逆转倍数为9.93; 他还可引起LoVo/Adr细胞凋亡, 与对照组相比, 具有显著性差异(P<0.01). 经苯丙素甙作用后, LoVo/Adr细胞pNA释放量明显增加(31.75±4.34 pmol/min vs 18.45±2.39 pmol/min, P<0.01), 而同时加入Caspase-3抑制剂Z-VAD-FMK, pNA释放量明显低于实验组(17.69±2.68 pmol/min vs 31.75±4.34 pmol/min, P<0.01).
结论: 苯丙素甙对耐药LoVo/Adr细胞具有逆转耐药作用, 通过Caspase-3途径诱导凋亡可能为其逆转耐药的机制之一.
引文著录: 马强, 张方信, 吕志诚, 陈嘉屿, 康生朝. 苯丙素甙逆转大肠癌耐药与凋亡的关系. 世界华人消化杂志 2009; 17(23): 2357-2361
Revised: July 15, 2009
Accepted: July 27, 2009
Published online: August 18, 2009
AIM: To investigate the relationship between the reversing effect of phenylpropanoid glycoside (PPG) on multidrug resistance of colon carcinoma LoVo/Adr cells and apoptosis.
METHODS: LoVo/Adr cells were divided into three groups: non-treatment (negative control) group, PPG treatment group (treated with 40 mg/L PPG) and verapamil treatment (positive control) group (treated with 5 mg/L VP). The effects of PPG on multidrug resistance of LoVo/Adr cells were examined by MTT (3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide) assay. The effects of PPG on cell apoptosis were detected by flow cytometry. The effects of PPG on the activity of Caspase-3 were evaluated by determining pNA release rate.
RESULTS: PPG could decrease the half maximal inhibitory concentration (IC50) of adriamycin in LoVo cells and reverse their resistance to adriamycin. The reversal index was 9.93. PPG could significantly induce the apoptosis of LoVo cells when compared with the non-treatment group (P < 0.01). The rate of pNA release in the PPG treatment group was significantly higher than that in the non-treatment group (31.75 ± 4.34 pmol/min vs 18.45 ± 2.39 pmol/min, P < 0.01). Caspase-3 inhibitor Z-VAD-FMK could significantly inhibit PPG-induced pNA release (17.69 ± 2.68 pmol/min vs 31.75 ± 4.34 pmol/min, P < 0.01).
CONCLUSION: PPG reverse multidrug resistance of LoVo/Adr cells perhaps through induction of Caspase 3-dependent apoptosis.
- Citation: Ma Q, Zhang FX, Lv ZC, Chen JY, Kang SZ. Phenylpropanoid glycoside reverse multidrug resistance of colon carcinoma LoVo/Adr cells through induction of apoptosis. Shijie Huaren Xiaohua Zazhi 2009; 17(23): 2357-2361
- URL: https://www.wjgnet.com/1009-3079/full/v17/i23/2357.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i23.2357
凋亡(apoptosis)是在基因控制和酶促反应下按一定程序进行的细胞自主死亡, 是机体维持自身稳定的一种基本生理机制[1-3]. 近年国外有学者认为, 凋亡通路受阻, 也是导致肿瘤细胞产生多药耐药(multidrug resistance, MDR)的一个原因[4-10]. 诱导肿瘤细胞凋亡, 尤其是诱导耐药细胞株的凋亡有望成为逆转MDR的有效途径. 苯丙素甙(phenylpropanoid glycoside, PPG)是从我国西北植物马先蒿中提取的化合物, 体外的抗瘤活性已得到证实[11-13]. 文献[7]报道PPG类化合物在肿瘤中可抑制端粒酶活性, 诱导细胞凋亡. 鉴于凋亡与耐药关系密切, 强烈暗示PPG可能具有逆转MDR的作用, 以本课题组诱导的耐药株LoVo/Adr细胞株具有P-糖蛋白(P-glycoprotein, P-gp)高表达, 谷胱甘肽-S-转移酶(glutathione-S-transferase, GST)活性高等生物学特性, 能在阿霉素1.0 mg/L培养基中生长, 不仅对阿霉素耐药, 而且对环磷酰胺、丝裂霉素和长春新碱有不同程度的交叉耐药, 对5-FU无耐药性[14-16], 以此细胞株为研究基础, 就PPG引起的凋亡与耐药的关系方面进行探讨.
耐药株LoVo/Adr细胞由本实验室传代保存; LoVo/Adr细胞株由本研究组采用阿霉素浓度递增法, 诱导大肠癌LoVo细胞株(引自美国ATCC), 历经8 mo、传代55次连续培养, 成功构建. 马先蒿甙A(Pedicularioside A)由红纹马先蒿(pedicularis striata Pall)提取所得, 由兰州大学有机化学实验室贾忠建教授分离鉴定并惠赠. 分子式为: C36H48O19. RPMI 1640为Gibco公司产品; 小牛血清为杭州四季青生物制品研究所产品; Z-VAD-FMK、Caspase-3活性检测试剂盒: 碧云天生物技术研究所; Cell Lysis Buffer: Biovision; 维拉帕米(verapamil, VP)、阿霉素(Adriamycin, ADR)、噻唑蓝(methyl terazolium, MTT): Sigma公司产品; AnnexinV/FIFC Kit: 美国BD Biosciences; P1和RNase: 美国BD Biosciences; 二氧化碳电热温孵箱: 日本太阳株式会社; 低温离心机: Dupont公司; 超净工作台: 上海阳光实验仪器有限公司; FACS-420型流式细胞仪: 美国Coulter公司.
1.2.1 LoVo/Adr细胞的培养: LoVo/Adr细胞接种于含100 g/L小牛血清的RPMI 1640培养液, 在培养体系中加入终浓度为1.0 mg/L的ADR以维持耐药. LoVo/Adr细胞在不含ADR的RPMI 1640培养基中培养2 wk后备用.
1.2.2 PPG对LoVo/Adr细胞耐药性的影响: 空白对照组: LoVo/Adr细胞; 实验组: LoVo/Adr细胞+PPG 40 mg/L组; 阳性对照组: LoVo/Adr细胞+VP 5 mg/L. 采用MTT法检测PPG对LoVo/Adr细胞耐药性的影响. 取对数生长期的LoVo/Adr细胞, 用RPMI 1640培养基制备成单细胞悬液, 分别接种到96孔板(每孔200 μL, 约1×105), 37℃, 50 mL/L CO2培养箱中培养24 h后, 各组再加入ADR终浓度为0.02-5.12 mg/L的9个浓度梯度, 同时加入相应浓度的PPG、VP, 每孔10 µL, 加入各组药物(设3个复孔), 再培养24 h后, 每孔加入2 mg/L MTT 20 µL继续培养4 h, 弃上清夜, 加入二甲基亚砜每孔150 µL, 将平板置于微孔板振荡器上充分振荡5 min, 使结晶物溶解. 酶标仪测每孔的吸光度(A)值. 计算存活率(存活率 = 实验孔A值/对照孔A值×100%). 以药物浓度为横轴, 存活率为纵轴绘制浓度效应曲线, 确定半数抑制浓度(IC50), 逆转倍数(fold reversal, FR) = 逆转前IC50值/逆转后IC50值.
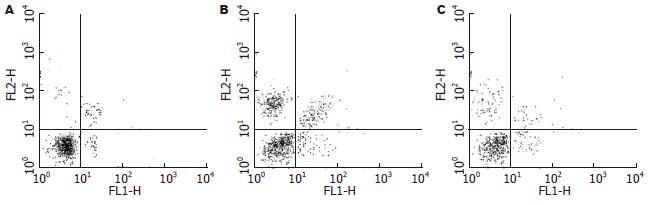
1.2.3 PPG诱导LoVo/Adr细胞凋亡实验: 细胞分组同前. 将LoVo/Adr细胞消化、吹匀后分别种入6孔板中, 加入含100 mL/L FBS的RPMI 1640培养液1 mL, 37℃, 50 mL/L CO2孵箱中孵育24 h, 按预设终浓度加入PPG及VP, 37℃, 50 mL/L CO2孵箱中孵育24 h, 加入2.5 g/L胰酶消化, 重悬细胞. 4℃离心, 800 r/min, 5 min, 弃上清. 4℃预冷的PBS洗细胞2次, 冰浴上用预先稀释的结合缓冲液(1份结合缓冲液+4份去离子水)重新悬浮细胞, 调节其浓度为5×109 /L. 冰浴上取100 µL的细胞悬液于5 mL流式管中, 加入5 µL AnnexinV/FIFC和10 µL碘化丙锭溶液(20 mg/L). 混匀后于室温避光孵育15 min. 在反应管中加入400 µL BPS, 上流式细胞仪分析. 流式细胞仪激发光波长488 nm, 用波长为515 nm的通带滤器检测FITC荧光, 另一波长大于560 nm的滤器检测PI. 实验重复3次. 结果判断: 凋亡细胞对所有用于细胞活性鉴定的染料(如PI)有抗染性, 坏死细胞则不能. 细胞膜有损伤的细胞的DNA可被PI着染产生红色荧光, 而细胞膜保持完好的细胞则不会有红色荧光产生. 因此, 在细胞凋亡的早期PI不会着染而没有红色荧光信号, 正常活细胞与此相似. 在双变量流式细胞仪的散点图上, 左下象限显示活细胞, 为(FITC-/PI-); 右上象限是非活细胞, 即坏死细胞, 为(FITC/PI); 而右下象限为凋亡细胞, 显现(FITC/PI-).
1.2.4 PPG对LoVo/Adr细胞Caspase-3活性的影响: 分组: 空白对照组: LoVo/Adr细胞; 实验组1: LoVo/Adr细胞+PPG 40 mg/L组; 实验组2: LoVo/Adr细胞+PPG 40 mg/L+Z-VAD-FMK 50 mg/L. 将LoVo/Adr细胞消化、吹匀后分别转入75 cm2培养皿中, 每瓶细胞数应相等, 约1×107, 培养液量为5 mL. 按预设终浓度分别加入PPG、Z-VAD-FMK, 37℃、50 mL/LCO2孵箱中孵育24 h. 2.5 g/L胰酶消化细胞, 收集入15 mL离心管中, 4℃离心. 细胞置于冰浴中, 冷PBS液洗2遍, 离心, 弃上清. 每管加入Cell Lysis Buffer, 调整细胞浓度为1×1011/L. 反复冻融以裂解细胞(置于液氮中迅速冷冻, 室温下溶化), 于冰中孵育15 min. 4℃离心, 1500 r/min, 20 min, 收集上清液于Ep管中. 立即测定Caspase-3的酶活性. Caspase-3的酶活性测定严格按照说明书进行. Caspase-3酶活力单位的定义: 一个酶活力单位定义为当底物饱和时, 在37℃, 每分钟剪切1 pmol Ac-DEVD-p-硝基苯胺(pNA)产生1 pmol pNA的Caspase-3的酶量.
统计学处理 结果以mean±SD表示, 所测数据用SPSS统计软件进行方差分析和t检验, 以P<0.05为有统计学意义.
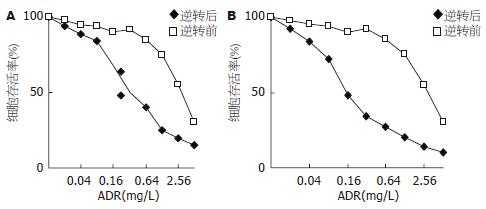
当耐药细胞株分别加入PPG和VP后, 均不同程度降低了ADR对LoVo/Adr细胞的IC50值, 说明PPG具有逆转MDR的特性, PPG、VP的逆转倍数分别为9.93、17.11. 与VP相比, PPG逆转倍数明显弱于VP(图1, 表1).
| 药物(mg/L) | IC50(mg/L) | 逆转倍数 |
| 空白对照组 | 3.08 | |
| 实验组 | 0.31 | 9.93 |
| 阳性对照组 | 0.18 | 17.11 |
培养体系中加入PPG、VP后继续培养24 h, PPG对LoVo/Adr细胞的影响, 更多是引起凋亡, 而坏死作用较弱, VP无此作用(图2, 表2).
与LoVo/Adr细胞对照组相比, 经PPG 40 mg/L作用后, 该组pNA释放量由18.45±2.39 pmol/min明显增加至31.75±4.34 pmol/min(P<0.01), 而同时加入Caspase-3抑制剂Z-VAD-FMK, pNA释放量为17.69±2.68 pmol/min, 明显低于PPG 40 mg/L组(P<0.01), 与对照组比较无差别, 从而说明PPG通过Caspase-3途径促进了LoVo/Adr细胞凋亡.
从某种意义上讲, 90%以上死于肿瘤的患者, 都与肿瘤原发或获得性抗药性有关. 据体内、外研究, 产生肿瘤抗药性可能是多种机制共同作用的结果. 其中凋亡相关基因发生突变, 他既可以加速肿瘤的进展, 又能使治疗反应减弱, 降低疗效, 这种耐药机制不同于传统的MDR机制[17-19]. 参与凋亡过程调控的基因表达失控, 例如激活细胞凋亡基因的丢失或抑制细胞凋亡基因的过度表达, 都可导致肿瘤细胞对广谱抗肿瘤药物的细胞毒性作用产生耐药性. 有趣的是, 众多报道[20-25]都显示MDR的存在几乎都伴有抗凋亡的现象.
细胞凋亡[4-5]即程序化细胞死亡(programmed cell death), 作为细胞死亡的方式之一, 是通过系列死亡信号分子活化而导致的主动性死亡过程. 其发生机制与细胞内信号转导系统所引起的基因调控有关, 肿瘤细胞由于癌基因的激活和抑癌基因的失活, 使分化受阻, 细胞进入增殖周期, 而不出现正常情况下的程序化死亡. 马先蒿在我国西北称"土人参", 用于治疗虚弱、衰竭、盗汗、遗精、衰老等症, 具有活血、健脾胃、安神益气等功效. PPG为从中分离的天然产物, 近年来的研究发现[25-29], 这类化合物有抗病毒、抗血小板凝聚、抗氧化作用, 抑制肿瘤生长的特性, PPG类化合物在肿瘤中可抑制端粒酶活性, 诱导细胞凋亡. 我们的实验不仅证实PPG对LoVo/Adr细胞具有致凋亡作用, 而且证实了PPG可降低了ADR对LoVo/Adr细胞的IC50值, 具有逆转耐药的特性, 其逆转倍数为9.93, 提示PPG可能是通过促凋亡途径逆转耐药性的. PPG是通过什么途径诱导凋亡的呢?
目前认为化疗药物可以通过以下5种途径介导细胞凋亡[1,30-31]: (1)依赖p53介导; (2)Bcl-2介导; (3)依赖Fas/FasL途径; (4)经神经酰胺介导; (5)经Caspase-3蛋白介导. 在本实验中, 我们通过测定Caspase-3作用于其底物后的产物pNA的含量来分析Caspase-3活性的变化. 结果显示, LoVo/Adr细胞经PPG作用后, Caspase-3活性显著增加, 而同时加入Caspase-3活性抑制剂后, Caspase-3活性又明显下降, 表明PPG通过Caspase途径促进了LoVo/ADR细胞的凋亡. 国外学者[32-35]通过对P-gp与细胞凋亡的关系进行深入研究, 提出P-gp除传统的药泵功能外, 他还对Caspase依赖的途径具有保护作用. 可能的机制为: (1)ATP是激活Caspase-3的重要成分, P-gp通过改变细胞内ATP水平影响细胞凋亡; (2)能使细胞内碱化, 能够诱导一种新的Na+和Cl-依赖跨膜H+转运, 导致细胞内pH增加, 这样使得Caspase处于失活状态, 从而起到保护作用. 本实验LoVo/Adr细胞中存在P-gp耐药途径[8], 我们推测PPG可能抑制了P-gp磷酸化程度, 减弱了对Caspase依赖的途径具的保护作用, 激活了Caspase-3活性, 从而促进LoVo/Adr细胞的凋亡, 逆转了耐药. 以上推测需今后研究进一步证实.
总之, 本研究表明: PPG对耐药LoVo/Adr细胞具有逆转耐药作用, 通过Caspase-3途径诱导凋亡可能为其逆转耐药的机制之一.
苯丙素甙是从我国西北植物马先蒿中提取的化合物, 苯丙素甙类化合物在肿瘤中可抑制端粒酶活性, 诱导细胞凋亡. 鉴于凋亡与耐药关系密切, 强烈暗示苯丙素甙可能具有逆转多药耐药(MDR)的作用.
蔡开琳, 副教授,华中科技大学同济医学院附属协和医院普通外科; 钱睿哲, 教授, 复旦大学上海医学院生理与病理生理学系血管分子生物学实验室; 王小众, 教授, 福建医科大学附属协和医院消化内科.
化疗是大肠癌治疗的主要手段之一, 而MDR产生则是化疗中最大的难点, 天然药物具有低毒、资源丰富、作用靶点多等特点. 提示开发中药耐药逆转剂有较好的前景.
国内学者证实川芎嗪、大黄素、榄香烯乳剂、浙贝母碱均可在体内外不同程度逆转肿瘤MDR.
本研究表明: PPG对耐药LoVo/Adr细胞具有逆转耐药作用, 通过Caspaes-3途径诱导凋亡可能为其逆转耐药的机制之一.
本研究为苯丙素甙改善肿瘤化疗, 提供了实验支持和理论依据, 为进一步深入研究奠定基础.
多药耐药(MDR):指肿瘤细胞接触一种药物后, 不但对该药产生抗药性, 而且对其他结构和作用机制不同的药物也产生抗药性.
本研究设计合理, 结果分析可靠, 具有一定的学术价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Shannan B, Seifert M, Leskov K, Willis J, Boothman D, Tilgen W, Reichrath J. Challenge and promise: roles for clusterin in pathogenesis, progression and therapy of cancer. Cell Death Differ. 2006;13:12-19. [PubMed] [DOI] |
| 2. | Mandal D, Mazumder A, Das P, Kundu M, Basu J. Fas-, caspase 8-, and caspase 3-dependent signaling regulates the activity of the aminophospholipid translocase and phosphatidylserine externalization in human erythrocytes. J Biol Chem. 2005;280:39460-39467. [PubMed] [DOI] |
| 3. | Wang W, Ho WC, Dicker DT, MacKinnon C, Winkler JD, Marmorstein R, El-Deiry WS. Acridine derivatives activate p53 and induce tumor cell death through Bax. Cancer Biol Ther. 2005;4:893-898. [PubMed] |
| 4. | Silva KL, Vasconcellos DV, Castro ED, Vasconcelos Fda C, Bigni R, Maia RC. Bisphosphonates induce apoptosis in CLL cells independently of MDR phenotype. Cancer Chemother Pharmacol. 2008;62:165-171. [PubMed] [DOI] |
| 5. | Sun W, Wang W, Kim J, Keng P, Yang S, Zhang H, Liu C, Okunieff P, Zhang L. Anti-cancer effect of resveratrol is associated with induction of apoptosis via a mitochondrial pathway alignment. Adv Exp Med Biol. 2008;614:179-186. [PubMed] [DOI] |
| 6. | Yajima T, Ochiai H, Uchiyama T, Takano N, Shibahara T, Azuma T. Resistance to cytotoxic chemotherapy-induced apoptosis in side population cells of human oral squamous cell carcinoma cell line Ho-1-N-1. Int J Oncol. 2009;35:273-280. [PubMed] |
| 7. | Jiang Z, Chen BA, Xia GH, Wu Q, Zhang Y, Hong TY, Zhang W, Cheng J, Gao F, Liu LJ. The reversal effect of magnetic Fe3O4 nanoparticles loaded with cisplatin on SKOV3/DDP ovarian carcinoma cells. Int J Nanomedicine. 2009;4:107-114. [PubMed] |
| 8. | Nardinocchi L, Puca R, Sacchi A, D'Orazi G. Inhibition of HIF-1alpha activity by homeodomain-interacting protein kinase-2 correlates with sensitization of chemoresistant cells to undergo apoptosis. Mol Cancer. 2009;8:1. [PubMed] [DOI] |
| 9. | Wrzal PK, Bettaieb A, Averill-Bates DA. Molecular mechanisms of apoptosis activation by heat shock in multidrug-resistant Chinese hamster cells. Radiat Res. 2008;170:498-511. [PubMed] [DOI] |
| 10. | Mashima T, Seimiya H, Chen Z, Kataoka S, Tsuruo T. Apoptosis resistance in tumor cells. Cytotechnology. 1998;27:293-308. [PubMed] [DOI] |
| 11. | Kuo YH, Hsu YW, Liaw CC, Lee JK, Huang HC, Kuo LM. Cytotoxic phenylpropanoid glycosides from the stems of Smilax china. J Nat Prod. 2005;68:1475-1478. [PubMed] [DOI] |
| 12. | Morikawa T, Sun B, Matsuda H, Wu LJ, Harima S, Yoshikawa M. Bioactive constituents from Chinese natural medicines. XIV.New glycosides of beta-carboline-type alkaloid, neolignan, and phenylpropanoid from Stellaria dichotoma L. var. lanceolata and their antiallergic activities. Chem Pharm Bull (Tokyo). 2004;52:1194-1199. [PubMed] [DOI] |
| 13. | Díaz AM, Abad MJ, Fernández L, Silván AM, De Santos J, Bermejo P. Phenylpropanoid glycosides from Scrophularia scorodonia: in vitro anti-inflammatory activity. Life Sci. 2004;74:2515-2526. [PubMed] [DOI] |
| 17. | Lage H. An overview of cancer multidrug resistance: a still unsolved problem. Cell Mol Life Sci. 2008;65:3145-3167. [PubMed] [DOI] |
| 18. | Li X, Hong L, Zhao Y, Jin H, Fan R, Du R, Xia L, Luo G, Fan D. A new apoptosis inhibitor, CIAPIN1 (cytokine-induced apoptosis inhibitor 1), mediates multidrug resistance in leukemia cells by regulating MDR-1, Bcl-2, and Bax. Biochem Cell Biol. 2007;85:741-750. [PubMed] [DOI] |
| 19. | Duarte N, Varga A, Cherepnev G, Radics R, Molnár J, Ferreira MJ. Apoptosis induction and modulation of P-glycoprotein mediated multidrug resistance by new macrocyclic lathyrane-type diterpenoids. Bioorg Med Chem. 2007;15:546-554. [PubMed] [DOI] |
| 20. | de Groot DJ, van der Deen M, Le TK, Regeling A, de Jong S, de Vries EG. Indomethacin induces apoptosis via a MRP1-dependent mechanism in doxorubicin-resistant small-cell lung cancer cells overexpressing MRP1. Br J Cancer. 2007;97:1077-1083. [PubMed] [DOI] |
| 21. | Hammond CL, Marchan R, Krance SM, Ballatori N. Glutathione export during apoptosis requires functional multidrug resistance-associated proteins. J Biol Chem. 2007;282:14337-14347. [PubMed] [DOI] |
| 22. | Ceruti S, Mazzola A, Abbracchio MP. Resistance of human astrocytoma cells to apoptosis induced by mitochondria-damaging agents: possible implications for anticancer therapy. J Pharmacol Exp Ther. 2005;314:825-837. [PubMed] [DOI] |
| 23. | Sagol O, Yavuzsen T, Oztop I, Ulukus C, Ylmaz U, Alakavuklar M, Karademir S, Obuz F, Astarcoğlu H, Astarcoglu I. The effect of apoptotic activity, survivin, Ki-67, and P-glycoprotein expression on prognosis in pancreatic carcinoma. Pancreas. 2005;30:343-348. [PubMed] [DOI] |
| 24. | Suárez L, Vidriales MB, Moreno MJ, López A, García-Laraña J, Pérez-López C, Tormo M, Lavilla E, López-Berges MC, de Santiago M. Differences in anti-apoptotic and multidrug resistance phenotypes in elderly and young acute myeloid leukemia patients are related to the maturation of blast cells. Haematologica. 2005;90:54-59. [PubMed] |
| 25. | Allen JW, Eldadah BA, Huang X, Knoblach SM, Faden AI. Multiple caspases are involved in beta-amyloid-induced neuronal apoptosis. J Neurosci Res. 2001;65:45-53. [PubMed] [DOI] |
| 26. | Yu S, Liu M, Gu X, Ding F. Neuroprotective effects of salidroside in the PC12 cell model exposed to hypoglycemia and serum limitation. Cell Mol Neurobiol. 2008;28:1067-1078. [PubMed] [DOI] |
| 27. | Kostyuk V, Potapovich A, Suhan T, De Luca C, Pressi G, Dal Toso R, Korkina L. Plant polyphenols against UV-C-induced cellular death. Planta Med. 2008;74:509-514. [PubMed] [DOI] |
| 28. | Shi Y, Wang W, Huang C, Jia Z, Yao S, Zheng R. Fast repair of oxidative DNA damage by phenylpropanoid glycosides and their analogues. Mutagenesis. 2008;23:19-26. [PubMed] [DOI] |
| 29. | Thuan ND, Ha do T, Thuong PT, Na MK, Lee JP, Lee JH, Seo HW, Min BS, Kim JC, Bae K. A phenylpropanoid glycoside with antioxidant activity from Picria tel-ferae. Arch Pharm Res. 2007;30:1062-1066. [PubMed] [DOI] |
| 31. | 倪 志, 鲍 缦夕, 刘 南植, 赵 秋, 覃 华, 杨 彦, 邱 艺坚, 王 婷婷. 结肠癌Lovo细胞RUNX3基因的表达与其增殖及凋亡的关系. 世界华人消化杂志. 2008;16:711-715. [DOI] |
| 32. | Angelini A, Iezzi M, Di Febbo C, Di Ilio C, Cuccurullo F, Porreca E. Reversal of P-glycoprotein-mediated multidrug resistance in human sarcoma MES-SA/Dx-5 cells by nonsteroidal anti-inflammatory drugs. Oncol Rep. 2008;20:731-735. [PubMed] |
| 33. | Xue C, Haber M, Flemming C, Marshall GM, Lock RB, MacKenzie KL, Gurova KV, Norris MD, Gudkov AV. p53 determines multidrug sensitivity of childhood neuroblastoma. Cancer Res. 2007;67:10351-10360. [PubMed] [DOI] |
| 34. | Engi H, Vasas A, Rédei D, Molnár J, Hohmann J. New MDR modulators and apoptosis inducers from Euphorbia species. Anticancer Res. 2007;27:3451-3458. [PubMed] |
| 35. | Inoue M, Sakuma Z, Ogihara Y, Saracoglu I. Induction of apoptotic cell death in HL-60 cells by acteoside, a phenylpropanoid glycoside. Biol Pharm Bull. 1998;21:81-83. [PubMed] |