修回日期: 2009-07-02
接受日期: 2009-07-06
在线出版日期: 2009-08-08
目的: 探讨靶向血管内皮生长受体-3(vascular endothelial growth factor receptor-3, VEGFR-3)小干扰RNA重组载体对胃癌细胞增殖的作用.
方法: 构建pSUPER-shRNA/VEGFR3重组载体, 将其转染入胃癌细胞SGC-7901, 采用MTT法观察细胞的生长曲线, RT-PCR检测重组载体在转染前后VEGFR-3 mRNA表达水平的变化, Western blot检测VEGFR-3的蛋白表达.
结果: pSUPER-shRNA/VEGFR3重组载体可显著抑制SGC-7901细胞中VEGFR-3基因的表达(P<0.05); 转染pSUPER-shRNA/VEGFR3的SGC-7901细胞生长明显受抑制(P<0.05), VEGFR-3基因蛋白表达明显降低(P<0.05).
结论: pSUPER-shRNA/VEGFR3重组载体能够对胃癌细胞SGC-7901中VEGFR-3形成基因沉默, 并抑制胃癌细胞的增殖.
引文著录: 吕志诚, 马强, 张有成, 王湘辉. 基因沉默血管内皮生长因子受体3对胃癌细胞增殖的抑制作用. 世界华人消化杂志 2009; 17(22): 2298-2302
Revised: July 2, 2009
Accepted: July 6, 2009
Published online: August 8, 2009
AIM: To investigate the effects of short hairpin RNA (shRNA)-based silencing of vascular endothelial growth factor receptor-3 (VEGFR-3) on the proliferation of gastric cancer cells.
METHODS: The pSUPER-siRNA/VEGFR3 recombinant expression vector was constructed and transfected into human gastric cancer SGC-7901 cells. The proliferation of transfected cells was analyzed by MTT assay. The expression level of VEGFR-3 mRNA and protein in stably transfected SGC-7901 cells were determined by RT-PCR and Western blot, respectively.
RESULTS: Compare to control cells, the expression of VEGFR3 gene and protein in SGC-7901 cells transfected with pSUPER-shRNA/VEGFR3 vector was significantly downregulated (both P < 0.05), and cell proliferation was significantly suppressed (P < 0.05).
CONCLUSION: RNA interference targeting VEGFR-3 is able to downregulate VEGFR-3 expression in gastric tumors cells and inhibit cell proliferation.
- Citation: Lv ZC, Ma Q, Zhang YC, Wang XH. RNA interference-based silencing of vascular endothelial growth factor receptor-3 inhibits the proliferation of gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2009; 17(22): 2298-2302
- URL: https://www.wjgnet.com/1009-3079/full/v17/i22/2298.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i22.2298
胃癌淋巴管转移为主要转移途径, 淋巴转移是胃癌复发的最主要原因. 血管内皮细胞生长因子受体3(vascular endothelial growth factor receptor-3, VEGFR-3)属于络氨酸激酶家族, 是淋巴管生成的特异性标志物点. 有研究表明[1-2]血管内皮生长C及其受体3(vascular endothelial growth factor C/vascular endothelial growth factor receptor-3, VEGFC/VEGFR3)信号通路是在肿瘤淋巴管生成和肿瘤转移过程中最重要的信号传导途径, 阻断该信号途径是抗淋巴管生成治疗最常采用的策略. 小干扰RNA(small interference RNA, siRNA)是一种高效、高特异性、高稳定性的基因敲减技术, 通过siRNA以胃癌血管内皮生长因子受体3信号通路为靶点, 对其进行抗淋巴管生成和转移的基因治疗, 可有效地抑制胃癌的生长、转移和复发, 从而提高患者的生存率. 本研究以靶向VEGFR3的siRNA表达载体为介导, 探讨这一载体能否下调胃癌VEGFR3的表达, 并抑制胃癌细胞的增殖.
胃癌细胞株SGC-7901购自中国科学院上海细胞生物研究所. 胎牛血清购自杭州四季青生物制品有限公司. 脂质体Lipofectamine 2000购自Invitrogen公司. 大肠杆菌DH5α、HindⅢ和BglⅡ限制性内切酶、T4DNA连接酶、Taq DNA聚合酶、RNA Extraction Kit购自TaKaRa公司(中国). RPMI 1640培养基购自Gibco公司. 琼脂糖凝胶回收试剂盒购自上海生工公司. siRNA表达载体pSUPER质粒由荷兰莱顿大学医学中心人类遗传学系Yvonne D Krom教授惠赠.
1.2.1 siRNA的设计和合成双链DNA模板的设计与合成: 在GenBank中找到VEGFR3基因的cDNA序列(序列号NM_002020). 根据Elbashir et al[3]的设计原则, 并参考在线siRNA靶点设计软件(http://www.ambion.com/techlib/mis/siRNA-finder.html)确定靶序列. 根据质粒载体pSUPER.basic的使用指南, 确定转录出siRNA的模板双链DNA(double strand DNA, dsDNA), 两端加上HindⅢ、BamHⅠ的酶切位点以及转录终止信号. 本实验设计了6条序列, VEGFR-3 siRNA1, 5'-CAT CAC GGA GGA GTC ACA C-3'(sense)和5'-GTG TGA CTC CTC CGT GAT G-3'(antisense); VEGFR3 siRNA2, 5'-GTA CAT CAA GGC ACG CAT C-3'(sense)和5'-GAT GCG TGC CTT GAT GTA C-3'(antisense); VEGFR3 siRNA3, 5'-GGG CAG AAT CAT CAC GAA G-3'(sense)5'-CTT CGT GAT GAT TCT GCC C-3'(antisense).
1.2.2 靶基因与siRNA表达载体pSUPER载体的连接: 靶基因按照pSUPER载体说明插入片段的要求合成长度为64 bp的双链DNA片段, 此片段的特点为两端设计有HindⅢ和BglⅡ酶切后的黏性末端, 中间为与要沉默的靶基因同源的19 bp序列、其反转互补序列和9 bp发夹结构. 将合成的2条互补单链寡核苷酸退火形成双链, 将pSUPER载体进行HindⅢ和BglⅡ酶双酶切后成线性DNA片段, 在T4DNA连接酶作用下进行连接, 于16℃孵箱反应16 h形成重组载体(pSUPER-siRNA/VEGFR3)并转化大肠杆菌.
1.2.3 阳性重组克隆的筛选及鉴定: 挑取单克隆于5 mL的LB(Amp+)培养基中过夜, 用RNA Extraction Kit小量制备pSUPER-siRNA/VEGFR3重组质粒, 用BglⅡ单酶切(因为BglⅡ位点在连接过程中失去)、EcoRⅠ和HindⅢ双酶切鉴定正确后, 再利用T7引物对克隆片段进行测序.
1.2.4 细胞培养和转染: 在含100 mL/L胎牛血清的RPMI 1640培养基内加青霉素100 kU/L、链霉素100 kU/L, 在37℃、50 mL/L CO2条件下培养、传代SGC-7901细胞. 细胞接种于24孔细胞培养板(2×105/孔), 18-24 h后90%融合. 采用Lipofectamine2000将pSUPER-siRNA/VEGFR3重组载体或pSUPER空质粒(1 μg/孔)导入细胞中, 作用6 h后换用完全培养基, 继续培养24、48、72 和96 h后进行检测. 48 h后加入G418 800 mg/L加压筛选[3], 每2-3 d换液1次, 去除死细胞, 实验中每种质粒均设4孔, 最终结果取平均值.
1.2.5 细胞生长曲线(MTT法)测定: 每组取200 μL加入96孔板中, 分别检测转染后第0、24、48和72 h MTT的吸光度值, 每组计数3孔, 取均值. 收获细胞前4 h, 每孔加入200 μL DMSO, 振荡10 min. 选择490 nm波长, 在酶联免疫检测仪上测定各孔光吸收值, 记录结果. 以时间为横轴, 光吸收值为纵轴绘制细胞生长曲线. 以只加培养液不加细胞的空白对照孔调零.
1.2.6 qRT-PCR法检测VEGFR3 mRNA的表达: 提取总RNA, 将收集的细胞在1 mL TRIzol试剂中匀浆, 经离心后与异丙酮混合, 室温孵育10 min. 于4℃离心15 min, 弃上清, 沉淀块用700 mL/L乙醇冲洗后, 以50 μL DEPC水溶解. 经纯化后将RNA沉淀溶解于DEPC处理的水中, 用分光光度计测量RNA浓度, 于-80℃保存备用. 在50 μL的反应体系中加入5 μg总RNA, 5×反应缓冲液10 μL, 10 mmol/L dNTPs 5 μL, RNasin(40 U/μL)0.5 μL, Oligo(dT)12-18 0.25 μg, 反转录酶(Su-perscript II, 200 U/μL) 2 μL, 0.1 mol/L DTT 0.5 μL, 置37℃孵育1 h, 然后在65℃加热5 min终止反应. 将cDNA保存于-20℃. 采用Primer 5.0引物设计软件设计引物. VEGFR3特异性PCR引物为上游引物(F): 5'-CGGGGAAGGG GAGGGAGGAG-3'; 下游引物(R): 5'-GAAAGGCGGCGGGTGTCAGG-3', 扩增产物为224 bp. 内参照GAPDH特异性PCR引物为上游引物(F): 5'-TAAGTATGACTCCACCCACG-3'; 下游引物(R): 5'-CTAGCACCTTCCCAACTA-3'(387 bp). 内参β-actin引物序列: 上游引物为: 5'-TCATGAAGTGTGACGTTGCATCCGT-3'下游引物为: 5'-CCTAGAAGCATTTGCGGTGCCGATG-3', 扩增产物片段长284 bp. 分别将各样品行10倍稀释. 浓度梯度为105/2 μL-1010/2 μL. 反应体系如下: Premix ExTaqTM(2×)12.5 μL、引物(10 μmol/L) 1.0 μL、SYBRGreenⅠ稀释液2.5 μL、dH2O 7.0 μL, 模板2 μL, 总体积25 μL. 1-6号作为标准曲线管. 按浓度梯度加入标准品DNA 2 μL, 7号管作为空白对照管. 其余12管按次序加入样本cDNA 2 μL. 荧光定量PCR的扩增条件同标准品的制备. 通过顺序检测系统观察各扩增曲线、融解曲线, 标准曲线的线形回归系数R值, 统计软件自动进行各样本的mRNA拷贝数的计算. 以VEGFR3 mRNA与β-actin mRNA拷贝数之比对结果进行标准化.
1.2.7 Western blot检测: 收集细胞, 裂解提取总蛋白, 于4℃离心, 15 000 r/min×10 min, 取上清, 用酚试剂法测蛋白浓度. 用凝胶加样缓冲液将各管蛋白浓度调为2 g/L, 电泳, 4%浓缩胶, 12.5%分离胶, 120 V、50 mA、1.5 h; 转膜, 50 V、100 mA、2 h. 用含50 g/L脱脂奶粉的TBS将膜封闭2 h, TBST漂洗2次×10 min, 分别加入VEGFR3抗体(1:500)、β-actin抗体(1:1000)孵育, 4℃过夜, TBST洗2次×10 min, 分别加入碱性磷酸酶标记山羊抗兔IgG(1:2 000)室温孵育2 h, TBST洗2次×5 min. 将滤膜放入配好的显色液中显色15-30 min, 取出滤膜, 蒸馏水冲洗, 晾干, 扫描, 软件分析条带的吸光度值, 以VEGFR3吸光度值与β-actin吸光度值之比进行标准化处理.
统计学处理 采用SPSS10.0统计软件进行数据处理, 差异的显著性用t检验, P<0.05有统计学意义.
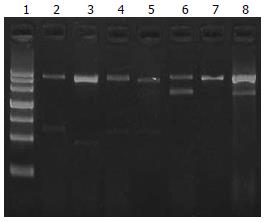
将VEGFR3 siRNA片段和对照片段连入含有H1启动子的载体pSUPER, 由于阳性克隆的BglⅡ酶切位点破坏, 先用BglⅡ进行酶切鉴定, 未发现切开者为阳性克隆, 然后再进行HindⅢ和EcoRⅠ双酶切鉴定(图1).
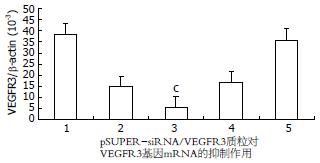
实时荧光定量PCR检测结果显示, VEGFR3和β-actin标准曲线制备均在线性范围内, 扩增产物融解曲线符合要求. 未转染质粒细胞组和转染空质粒细胞组的VEGFR3 基因表达水平(VEGFR3/β-actin)没有显著性差异(P>0.05), 明显高于转染pSUPER-siRNA1/VEGFR3、pSUPER-siRNA2/VEGFR3、pSUPER-siRNA3/VEGFR3质粒细胞组的表达水平(P<0.05). 其中pSUPER-siRNA2/VEGFR3质粒对VEGFR3基因表达水平抑制作用最为明显, 表达抑制显著低于其他组(P<0.05, 图2).
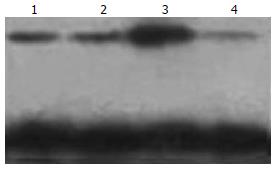
蛋白表达Western blot检测结果见图3, 转染空质粒细胞组的蛋白表达明显高于转染pSUPER-siRNA1/VEGFR3、pSUPER-siRNA2/VEGFR3、pSUPER-siRNA3/VEGFR3质粒细胞组的蛋白表达水平, 其中转染pSUPER-siRNA2/VEGFR3质粒组蛋白表达水平最低, 与实时荧光定量PCR检测结果一致.
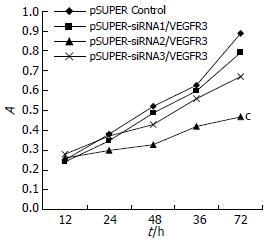
转染重组载体pSUPER-siRNA1/VEGFR3、pSUPER-siRNA2/VEGFR3、pSUPER-siRNA3/VEGFR3后, SGC-7901细胞生长受抑制, 细胞转染12 h后开始测细胞活性, 每12 h测1次, 将所测结果绘制生长曲线, 结果显示pSUPER-siRNA2/VEGFR3转染组细胞活性低于对照组(图4). pSUPER-siRNA1/VEGFR3、pSUPER-siRNA3/VEGFR3细胞活性影响不明显.
胃癌是人类死亡的主要原因之一, 区域淋巴结转移是胃癌不良预后的一个很重要的指标, 最近的研究表明, 肿瘤淋巴生成促进淋巴结转移[4-8]. VEGFR3是淋巴内皮细胞的一个标记, 其最主要在成熟组织的淋巴管内皮上表达[9-10], 同时也发现促进肿瘤生长和伤口愈合[5,11-13].
VEGFR3促进肿瘤细胞生长的作用机制如下: VEGFR3的信号传导通路为经典的Ras/MAPK传导通路, 当VEGFR3与VEGF-C二聚体结合后, 通过一系列的反应激活Ras/MAPK信号传导系统, 使其发生级联放大反应, 活化的MAPK可以激活下游的转录因子, 促进DNA合成和转录并促使细胞发生有丝分裂[14-15]. 这就是VEGF-C/VEGFR3信号系统促进肿瘤细胞自身增殖的机制.
在本实验中, 我们发现靶向VEGFR3的RNA干扰能够有效抑制人胃癌细胞系VEGFR3的mRNA和受体蛋白的表达, 并抑制了胃癌细胞系的生长, 这可能是由于靶向VEGFR3 siRNA抑制了VEGFR3和细胞因子VEGF-C等结合形成二聚体, 从而阻断了VEGF-C/VEGFR3信号系统, 抑制了胃癌细胞的生长.
siRNA技术是近年来研究基因功能较为新型的技术, 由于其高效、特异、稳定性和可遗传性的特点被广泛应用于胃肠道肿瘤的研究中[5,16-19], 但化学合成的RNA易于降解, 在细胞中作用寿命较短, 仅能作为瞬时抑制之用, 通过构建siRNA的表达载体导入细胞内可以达到较为长期的基因抑制作用, 为肿瘤的基因治疗奠定理论依据. 但是目前RNAi技术的机制由于其极其复杂仍不十分清楚, 包括目标RNA有效位点的识别, 减少脱靶(off-target)效应, 避免引起干扰素样反应[19-20], 提高稳定性以及siRNA转导的有效性和低毒性等方面都不尽如人意, 本研究通过siRNA表达载体pSUPER, 构建3对靶向VEGFR3的siRNA重组载体并导入细胞, 筛选出1组pSUPER-siRNA2/VEGFR3较高抑制效率的靶点, 可以为靶向VEGFR3基因治疗胃癌提供理论依据.
淋巴转移是胃癌复发的最主要原因, Roberts et al研究发现血管内皮生长C及其受体信号通路是在肿瘤淋巴管生成和肿瘤转移过程中最重要的信号传导途径, 阻断该信号途径可以为抗淋巴管生成治疗提供重要依据.
程英升, 教授, 同济大学附属第十人民医院影像临床医学中心; 杜雅菊, 主任医师, 哈尔滨医科大学附属第二医院消化内科
淋巴管生成的研究是目前肿瘤研究的一个新领域, 本研究通过应用目前较为先进的小干扰RNA技术阻断VEGFR3, 了解VEGFR3对肿瘤增殖的作用, 可以为以后肿瘤淋巴转移的基因治疗提供依据.
Pirjo et al通过VEGFR3的抗体阻断和VEGF-C或D结合, 抑制了肿瘤的生长. He et al将可溶性VEGFR3-Ig的融合蛋白通过载体阻断VEGFR3信号途径, 从而抑制了肿瘤的淋巴管血管生成和淋巴结转移.
利用RNA干扰抑制VEGFR3的表达, 为进一步阐明VEGFR3的作用机制和预防淋巴结转移提供了方法和途径, 有着十分重要的理论和实践意义.
本研究选题较好, 设计合理, 结果可靠, 具有一定的理论指导意义.
编辑: 李军亮 电编:何基才
| 1. | Roberts N, Kloos B, Cassella M, Podgrabinska S, Persaud K, Wu Y, Pytowski B, Skobe M. Inhibition of VEGFR-3 activation with the antagonistic antibody more potently suppresses lymph node and distant metastases than inactivation of VEGFR-2. Cancer Res. 2006;66:2650-2657. [PubMed] [DOI] |
| 2. | He Y, Karpanen T, Alitalo K. Role of lymphangiogenic factors in tumor metastasis. Biochim Biophys Acta. 2004;1654:3-12. [PubMed] |
| 3. | Elbashir SM, Harborth J, Weber K, Tuschl T. Analysis of gene function in somatic mammalian cells using small interfering RNAs. Methods. 2002;26:199-213. [PubMed] [DOI] |
| 4. | Partanen TA, Alitalo K, Miettinen M. Lack of lymphatic vascular specificity of vascular endothelial growth factor receptor 3 in 185 vascular tumors. Cancer. 1999;86:2406-2412. [PubMed] [DOI] |
| 5. | Cho WG, Albuquerque RJ, Kleinman ME, Tarallo V, Greco A, Nozaki M, Green MG, Baffi JZ, Ambati BK, De Falco M. Small interfering RNA-induced TLR3 activation inhibits blood and lymphatic vessel growth. Proc Natl Acad Sci U S A. 2009;106:7137-7142. [PubMed] [DOI] |
| 6. | Lin J, Lalani AS, Harding TC, Gonzalez M, Wu WW, Luan B, Tu GH, Koprivnikar K, VanRoey MJ, He Y. Inhibition of lymphogenous metastasis using adeno-associated virus-mediated gene transfer of a soluble VEGFR-3 decoy receptor. Cancer Res. 2005;65:6901-6909. [PubMed] [DOI] |
| 7. | Mandriota SJ, Jussila L, Jeltsch M, Compagni A, Baetens D, Prevo R, Banerji S, Huarte J, Montesano R, Jackson DG. Vascular endothelial growth factor-C-mediated lymphangiogenesis promotes tumour metastasis. EMBO J. 2001;20:672-682. [PubMed] [DOI] |
| 8. | Skobe M, Hawighorst T, Jackson DG, Prevo R, Janes L, Velasco P, Riccardi L, Alitalo K, Claffey K, Detmar M. Induction of tumor lymphangiogenesis by VEGF-C promotes breast cancer metastasis. Nat Med. 2001;7:192-198. [PubMed] [DOI] |
| 9. | Dumont DJ, Jussila L, Taipale J, Lymboussaki A, Mustonen T, Pajusola K, Breitman M, Alitalo K. Cardiovascular failure in mouse embryos deficient in VEGF receptor-3. Science. 1998;282:946-949. [PubMed] [DOI] |
| 10. | Partanen TA, Arola J, Saaristo A, Jussila L, Ora A, Miettinen M, Stacker SA, Achen MG, Alitalo K. VEGF-C and VEGF-D expression in neuroendocrine cells and their receptor, VEGFR-3, in fenestrated blood vessels in human tissues. FASEB J. 2000;14:2087-2096. [PubMed] [DOI] |
| 11. | Saaristo A, Tammela T, Farkkilā A, Kärkkäinen M, Suominen E, Yla-Herttuala S, Alitalo K. Vascular endothelial growth factor-C accelerates diabetic wound healing. Am J Pathol. 2006;169:1080-1087. [PubMed] [DOI] |
| 12. | Bando H, Weich HA, Horiguchi S, Funata N, Ogawa T, Toi M. The association between vascular endothelial growth factor-C, its corresponding receptor, VEGFR-3, and prognosis in primary breast cancer: a study with 193 cases. Oncol Rep. 2006;15:653-659. [PubMed] |
| 13. | Conrad C, Niess H, Huss R, Huber S, von Luettichau I, Nelson PJ, Ott HC, Jauch KW, Bruns CJ. Multipotent mesenchymal stem cells acquire a lymphendothelial phenotype and enhance lymphatic regeneration in vivo. Circulation. 2009;119:281-289. [PubMed] [DOI] |
| 14. | Whitehurst B, Flister MJ, Bagaitkar J, Volk L, Bivens CM, Pickett B, Castro-Rivera E, Brekken RA, Gerard RD, Ran S. Anti-VEGF-A therapy reduces lymphatic vessel density and expression of VEGFR-3 in an orthotopic breast tumor model. Int J Cancer. 2007;121:2181-2191. [PubMed] [DOI] |
| 15. | Su JL, Yen CJ, Chen PS, Chuang SE, Hong CC, Kuo IH, Chen HY, Hung MC, Kuo ML. The role of the VEGF-C/VEGFR-3 axis in cancer progression. Br J Cancer. 2007;96:541-545. [PubMed] [DOI] |
| 16. | Xie Y, Yin Y, Li L, Ma Y, Xiao Q. Short interfering RNA directed against the E2F-1 gene suppressing gastric cancer progression in vitro. Oncol Rep. 2009;21:1345-1353. [PubMed] |
| 17. | Li Q, Zhang N, Jia Z, Le X, Dai B, Wei D, Huang S, Tan D, Xie K. Critical role and regulation of transcription factor FoxM1 in human gastric cancer angiogenesis and progression. Cancer Res. 2009;69:3501-3509. [PubMed] [DOI] |
| 18. | Xu R, Sato N, Yanai K, Akiyoshi T, Nagai S, Wada J, Koga K, Mibu R, Nakamura M, Katano M. Enhancement of paclitaxel-induced apoptosis by inhibition of mitogen-activated protein kinase pathway in colon cancer cells. Anticancer Res. 2009;29:261-270. [PubMed] |
| 19. | Kurehara H, Ishiguro H, Kimura M, Mitsui A, Ando T, Sugito N, Mori R, Takashima N, Ogawa R, Fujii Y. A novel gene, RSRC2, inhibits cell proliferation and affects survival in esophageal cancer patients. Int J Oncol. 2007;30:421-428. [PubMed] |
| 20. | Pellish RS, Nasir A, Ramratnam B, Moss SF. Review article: RNA interference--potential therapeutic applications for the gastroenterologist. Aliment Pharmacol Ther. 2008;27:715-723. [PubMed] |