修回日期: 2009-05-28
接受日期: 2009-06-08
在线出版日期: 2009-07-28
目的: 了解肝硬化患者肺功能异常与肝病之间的关系.
方法: 选取2007-05/2008-03我院及中山大学附属第一医院住院肝硬化患者50例. 肺功能检测患者第一秒用力呼气量(FEV1)、一秒率(FEV1/FVC), 单次呼吸法检测肺一氧化碳弥散量(DLCO)、比弥散量(KCO, 即单位肺泡的DLCO). 将肝硬化患者分别按患者肝掌、蜘蛛痣、显性黄疸、白蛋白减低、脾亢、门静脉增宽等的异常与否分成阳性组(+)和阴性组(-), 比较组间FEV1、FEV1/FVC、DLCO、KCO均值的差异.
结果: 约34%患者出现通气功能障碍, 以限制性通气为主; 有72%的患者出现弥散功能减退, 为最主要的肺功能改变. Child-Pugh积分与KCO呈负相关(r = -0.351, P<0.05); 白蛋白水平与FEV1、KCO呈正相关(r = 0.334, 0.336, 均P<0.05); 门静脉宽度与FEV1、DLCO呈负相关(r = -0.389, -0.417, 均P<0.05); 脾厚度与DLCO、KCO呈负相关(r = -0.644, -0.536, 均P<0.01). 血红蛋白浓度和脾脏厚度是DLCO的独立预测因子(P<0.05).
结论: 弥散障碍在肝硬化患者中发生率较高, 门静脉高压的长期作用与之有密切关系.
引文著录: 欧阳菲菲, 王连源. 肝硬化与肺功能异常的关系. 世界华人消化杂志 2009; 17(21): 2203-2207
Revised: May 28, 2009
Accepted: June 8, 2009
Published online: July 28, 2009
AIM: To determine the relationship between liver cirrhosis and pulmonary function impairment.
METHODS: Fifty patients with liver cirrhosis, who were treated at our hospital and the First Affiliated Hospital of Sun Yat-Sen University from May 2007 to March 2008, were included in the study. All patients underwent pulmonary function tests (PFTs) to assess forced expiratory volume in one second (FEV1), FEV1/FVC (forced vital capacity), single-breath carbon monoxide diffusing capacity (DLCO) and DLCO per unit of alveolar volume (KCO, also known as DLCO/VA). The mean FEV1, FEV1/FVC, DLCO and KCO were compared between patients with and without liver palm, spider naevi, clinical jaundice, hypoproteinemia, hypersplenism or widening of the portal vein, respectively.
RESULTS: Approximately 34 percent of patients presented with ventilation abnormalities, mainly restrictive ventilation disorders. Decreased diffusion capacity was the most common pulmonary function disorder and was found in 72% of patients. The Child-Pugh score was correlated inversely with KCO (r = -0.351, P < 0.05). Serum albumin level was correlated positively with FEV1 and KCO (r = 0.334 and 0.336, respectively; both P < 0.05). The width of the portal vein was correlated inversely with FEV1 and DLCO (r = -0.389 and -0.417, respectively; both P < 0.05). The thickness of the spleen was correlated inversely with DLCO and KCO (r = -0.644 and -0.536, respectively; both P < 0.01). Hemoglobin concentration and the thickness of the spleen were independent predictors of DLCO (P < 0.05).
CONCLUSION: The impairment of diffusion capacity is a very common disorder in patients with liver cirrhosis. Long-term portal hypertension is closely associated with the development of impaired diffusion capacity in patients with liver cirrhosis.
- Citation: Ouyang FF, Wang LY. Relationship between liver cirrhosis and pulmonary function impairment. Shijie Huaren Xiaohua Zazhi 2009; 17(21): 2203-2207
- URL: https://www.wjgnet.com/1009-3079/full/v17/i21/2203.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i21.2203
慢性肝病患者经常可以出现其他系统器官的受累, 肝肺综合征(hepatopulmonary syndrome, HPS)是发生于晚期肝病的一种危及生命的严重并发症, 是由肺血管扩张所引起的动脉氧合障碍, 可以概括为一组临床三联征, 即慢性肝病或门脉高压症、低氧血症以及肺血管扩张. 并发HPS的肝硬化患者, 虽然大部分时候低氧血症尚不足以致命, 但能明显恶化患者的预后. HPS起病较隐匿, 临床上诊断往往滞后, 在患者出现非常严重的低氧血症时才被发现. 肺功能测试被应用于HPS的辅助诊断, 这类患者肺功能有明显减退, 其中最具标志性的是一氧化碳弥散量(carbon monoxide diffusing capacity, DLCO)的降低. 原位肝移植可以使85%的HPS患者缓解低氧血症, 成为目前治疗HPS唯一明确有效的方法. 曾有肝移植中心将DLCO中度减退用作筛查HPS的指标之一[1]. 然而近年来有学者发现, 肝移植虽然能逆转动脉氧合障碍, 但患者减退的肺弥散功能却仍然维持在术前水平持久得不到改善, 这使得HPS患者肺功能的改变及其与肝病的关系变得更加引人注目. 本研究旨在通过对肝硬化患者进行肺功能检查, 探讨肺功能异常与肝硬化临床表现和体征、生化改变、肝功能分级之间的关系, 进一步探索弥散障碍可能的发生机制.
选取2007-05/2008-03我院及中山大学附属第一医院住院肝硬化患者共50例. 排除标准: 慢性肺部疾病、急性呼吸道感染、吸烟史、胸部手术史、胸廓或脊柱畸形、心肾功能不全、恶性肿瘤、重度贫血.
入选患者均测试肺通气功能和弥散功能. 肺功能检查使用美国Medical graphic公司Elite体积描记肺功能测试系统检测第一秒用力呼气量(FEV1)、一秒率(FEV1/FVC), 单次呼吸法检测肺DLCO、比弥散量(KCO, 即单位肺泡的DLCO). 检查均取坐位进行, FEV1/FVC结果以实测百分比表示. FEV1、DLCO、KCO结果以实测值占预计值的百分比表示, 以低于预计值的80%为异常. 预计值由患者性别、身高、体质量、体表面积等为依据计算[2].
记录患者住院期间血常规、肝功能、腹部B超等结果, 根据其是否存在肝掌、蜘蛛痣、显性黄疸、白蛋白减低、脾亢、门静脉增宽等异常, 将患者分成阳性组(+)和阴性组(-), 比较两组肺功能的差异. 对肺功能与其他临床指标进行相关分析, 并以DLCO作为因变量, 采用线性回归分析脾厚度、FEV1、Hb、门静脉宽度在预测DLCO中的价值.
统计学处理 采用SPSS10.0统计软件, 计量资料以mean±SD表示, 均数的比较采用t检验. 计数资料以率表示, 对不同指标间相关关系根据资料分布类型采用Pearson积矩相关或Spearman等级相关进行分析. 对DLCO建立多重线性回归模型. P<0.05为有统计学差异.
17例(34%)患者出现通气功能障碍, 其中限制性通气功能障碍11例(22%), 阻塞性通气功能障碍4例(8%), 混合性通气功能障碍2例(4%); 出现DLCO下降的达36例(72%), 其均值低于正常下限(80%), KCO下降22例(44%). 患者按照肝功能Child-Pugh分级, 有Child A级22例, Child B级19例, Child C级9例. 总的肺功能受损的情况在Child A、B、C级之间无显著差异(P>0.05, 表1).
| 总均数 | A级(n = 22) | B级(n = 19) | C级(n = 9) | |
| FEV1 | 84.1±17.4 | 87.4±19.3 | 82.8±10.0 | 78.3±24.6 |
| FEV1/FVC | 77.8±7.0 | 76.3±6.7 | 78.9±8.2 | 79.4±3.7 |
| DLCO | 67.5±18.0 | 71.5±16.5 | 65.1±18.1 | 61.8±21.5 |
| KCO | 80.4±19.2 | 87.3±18.6 | 75.6±18.7 | 72.4±17.6 |
低蛋白血症患者FEV1显著降低(P<0.01); 脾亢患者的KCO显著降低(P<0.01); 门静脉增宽的患者DLCO、KCO均显著降低(P<0.01). 肝病体征则与肺功能没有明显关系(表2).
| 分组 | n | FEV1 | FEV1/FVC | DLCO | KCO | |
| 肝掌 | + | 13 | 0.223 | 0.750 | 0.135 | 0.069 |
| - | 37 | |||||
| 蜘蛛痣 | + | 17 | 0.778 | 0.783 | 0.305 | 0.707 |
| - | 33 | |||||
| 显性黄疸 | + | 23 | 0.964 | 0.105 | 0.788 | 0.443 |
| - | 27 | |||||
| 白蛋白减低 | + | 32 | 0.008 | 0.389 | 0.811 | 0.135 |
| - | 18 | |||||
| 脾亢 | + | 30 | 0.415 | 0.606 | 0.327 | 0.005 |
| - | 20 | |||||
| 门静脉增宽 | + | 16 | 0.112 | 0.686 | 0.005 | 0.006 |
| - | 12 |
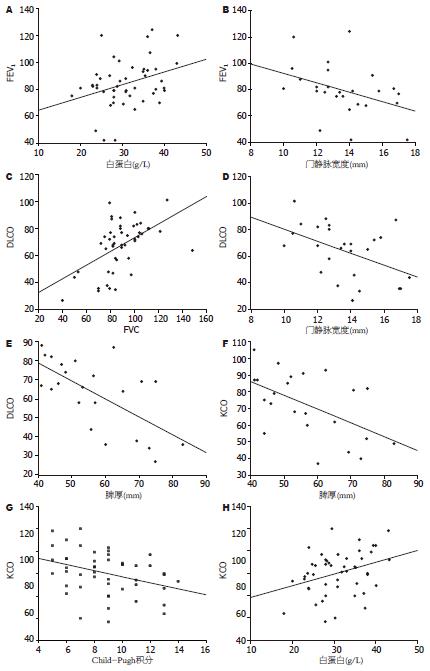
FEV1与DLCO、KCO、血红蛋白、白蛋白均呈正相关(r = 0.559, 0.318, 0.328, 0.334, P<0.05), 与门静脉宽度呈负相关(r = -0.389, P<0.05); DLCO与血红蛋白呈正相关(r = 0.4, P<0.01), 与门静脉宽度、脾厚度呈负相关(r = -0.417, -0.644, P<0.05); KCO与血红蛋白和白蛋白呈正相关(r = 0.471, 0.336, P<0.05), 与Child积分和脾厚度呈负相关(r = -0.351, -0.536, P<0.05)(表3, 图1).
| FEV1 | 血红蛋白 | 白蛋白 | Child积分 | 脾厚度 | 门静脉宽度 | |
| FEV1 | 0.328a | 0.334 | -0.258 | -0.311 | -0.389 | |
| FEV1/FVC | 0.121 | 0.133 | -0.034 | 0.188 | 0.343 | -0.084 |
| DLCO | 0.559b | 0.400b | 0.142 | -0.211 | -0.644 | -0.417 |
| KCO | 0.318a | 0.471b | 0.336 | -0.351 | -0.536 | -0.308 |
我们发现FEV1与血白蛋白水平呈正相关(r = 0.334, P<0.05), 在白蛋白减低的患者组FEV1亦明显降低(P<0.05), 考虑是低白蛋白血症通过引起胸腹水, 使肺容积减小而降低了FEV1. FEV1与门静脉宽度呈负相关(r = -0.389, P<0.05), 由于门静脉增宽间接反映出门静脉压力增高, 这里可能有两个原因: 门静脉压越高, 胸腹水生成越多, 从而加重限制性通气障碍, 使FEV1降低; 门静脉压越高, 从侧支循环分流入体循环和肺循环的代谢产物越多, 可能引起支气管平滑肌痉挛而降低FEV1[3].
国内学者多认为肝硬化患者弥散功能的减低随Child分级而加重, 蜘蛛痣阳性者肺功能损害更严重[4-5]. 本研究DLCO、KCO在各肝功能分级之间没有统计学差异, 这与Yigit et al[6]的结果相符. 弥散功能与蜘蛛痣、肝掌、黄疸均没有明显关系. 通过相关分析可以看出, 除去贫血的影响, 弥散功能与肝硬化的关系有几个特点: (1)KCO与肝储备功能有关, 体现在其与Child积分、白蛋白水平的相关性, 肝功能越差, KCO越低; DLCO则否. 由于KCO即DLCO/VA, VA是肺泡通气量, 直接受到胸腹水的影响, 后者是低白蛋白血症的后果, 并参与Child-Pugh积分的评判, 所以我们推测胸腹水的存在是潜在的联系KCO与肝功能的桥梁, 实则肺弥散与肝功能并无联系. (2)KCO、DLCO均与门静脉高压的影响有关, 体现在门静脉越宽或脾脏厚度越大, 弥散量越低. (3)KCO、DLCO均与FEV1呈正相关, 提示肝硬化患者通气功能越好, 弥散量越大. 基于此我们成功构建了关于预测DLCO的多重线性回归模型, 其中Hb和脾厚是DLCO的独立预测因子, 各指标对DLCO的影响力(方向)排序为: 脾厚(负向)>Hb(正向)>门静脉宽度(负向)>FEV1(正向). 孙勇伟 et al[7]曾经对DLCO与Child-Pugh评分、PA-aO2、VC(肺活量)进行多重线性回归分析, 认为后3者是DLCO的独立危险因素. 但是其回归方程的校正决定系数仅0.28, 而我们的回归方程校正决定系数为0.636, 显然回归的效果较其要更好一些.
肝硬化患者的弥散障碍一直以来被视作并发HPS的标志之一. 然而Lima et al[8]的研究发现在40个DLCO降低的肝硬化患者中80%不符合HPS的诊断标准; Martinez-Palli et al[9]进行的30例肝移植前瞻性研究, 在平均术后15 mo时, 肝功能、血气指标、通气/血流比值均恢复正常, 但其中24例HPS患者直至平均术后86 mo时复查, DLCO仍维持在术前水平. 由此我们可以推测弥散功能减退在肝硬化和HPS患者的低氧血症中不起主导作用. 那么弥散障碍的症结到底在哪里, 这让我们不得不重新审视弥散屏障-肺泡上皮细胞及基底膜、肺与毛细血管间隔、毛细血管内皮及基底膜. 膜相扩散是影响弥散量的最主要因素. Martínez-Palli et al[9]、Fallon et al[10]均在2006年提出了"肺血管重塑"的概念, 肺微血管的结构改变比肺血管扩张对肺换气功能的影响更大. Matsubara et al[11]研究了肝硬化患者肺血管的组织学改变, 发现肺血管改变出现在肌型小动脉, 包括扩张、管壁增厚、血栓形成等. 其管壁增厚与肝内门静脉壁增厚相关. Lamps et al[12]则发现肝硬化患者的肺静脉内膜明显增厚. 类似的管径扩大、管壁增厚以及小静脉动脉化的改变甚至在肝硬化门静脉高压症患者的结肠黏膜血管也普遍存在[13]. 由此我们不难推测肺毛细血管壁在门静脉高压的长期作用下也受到波及, 其血管膜很可能也有增厚现象, 从而限制了气体的弥散. 在这方面尚需更多更细致的组织病理学研究来证实.
肝肺综合征是继发于晚期肝病的严重并发症, 通过引起低氧血症而使患者死亡率增加. 通常认为肝病通过多种复杂的机制导致肺血管扩张从而影响了肺的气体交换. 这些患者的肺功能往往有明显减退, 又以一氧化碳弥散量(DLCO)降低最具标志性.
丁惠国, 主任医师, 首都医科大学附属北京佑安医院肝病消化科.
目前研究铂类配合物的重点和热点是对现有的经典结构的改造, 如将单核的铂类配合物改为双核或多核, 增加特异性和疗效; 增加空间阻位, 防止耐药性的发生; 引入新的极性离子, 增加可溶性; 增加脂溶性, 来改变用药途径, 等等. 以此达到高效、低毒、水溶性好、选择性高、与顺铂无交叉耐药性、可口服的新型铂类.
Møller et al在对肝硬化患者进行肺功能检测的同时, 还利用放射性核素对肺循环的血流动力学指标进行检测, 认为患者有肺循环时间缩短, 肺血容量减低, 并且与DLCO减低呈正相关, 提示肺血管因素在肺功能异常中起重要作用.
本文较全面地分析了肝病的各种临床表现与肺功能指标的关系, 揭示了肺弥散功能与肝储备功能并无直接关系, 而与门静脉高压密切相关, 并建立了关于DLCO的多重线性回归模型.
本研究提示临床上门静脉增宽以及脾大较明显的肝硬化患者肺部受累的可能性较大, 据此宜进一步进行血气分析、对比增强超声心动图等肝肺综合征有关的检查.
1 DLCO: 指单位时间内、单位压力差下通过肺泡毛细血管膜进入毛细血管血液中的CO量.
2 KCO: 即DLCO/VA, 一氧化碳弥散量与肺泡气量之比. 由于很难采取肺毛细血管的血样测定氧分压,临床上很少测定氧的弥散量 ,而是采用CO测试弥散功能.
本研究方法可靠, 结论合理, 研究结果对临床有一定的指导价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Martínez GP, Barberà JA, Visa J, Rimola A, Paré JC, Roca J, Navasa M, Rodés J, Rodriguez-Roisin R. Hepatopulmonary syndrome in candidates for liver transplantation. J Hepatol. 2001;34:651-657. [PubMed] [DOI] |
| 6. | Yigit IP, Hacievliyagil SS, Seckin Y, Oner RI, Karincaoglu M. The relationship between severity of liver cirrhosis and pulmonary function tests. Dig Dis Sci. 2008;53:1951-1956. [PubMed] [DOI] |
| 8. | Lima BL, França AV, Pazin-Filho A, Araújo WM, Martinez JA, Maciel BC, Simões MV, Terra-Filho J, Martinelli AL. Frequency, clinical characteristics, and respiratory parameters of hepatopulmonary syndrome. Mayo Clin Proc. 2004;79:42-48. [PubMed] [DOI] |
| 9. | Martínez-Palli G, Gómez FP, Barberà JA, Navasa M, Roca J, Rodríguez-Roisin R, Burgos F, Gistau C. Sustained low diffusing capacity in hepatopulmonary syndrome after liver transplantation. World J Gastroenterol. 2006;12:5878-5883. [PubMed] |
| 10. | Fallon MB. Hepatopulmonary syndrome: more than just a matter of tone? Hepatology. 2006;43:912-914. [PubMed] [DOI] |
| 11. | Matsubara O, Nakamura T, Uehara T, Kasuga T. Histometrical investigation of the pulmonary artery in severe hepatic disease. J Pathol. 1984;143:31-37. [PubMed] [DOI] |
| 12. | Lamps LW, Carson K, Bradley AL, Pinson CW, Johnson JE, Coogan AC, Hunter EB, Clavien PA, Washington MK. Pulmonary vascular morphological changes in cirrhotic patients undergoing liver transplantation. Liver Transpl Surg. 1999;5:57-64. [PubMed] [DOI] |
| 13. | Lamps LW, Hunt CM, Green A, Gray GF Jr, Washington K. Alterations in colonic mucosal vessels in patients with cirrhosis and noncirrhotic portal hypertension. Hum Pathol. 1998;29:527-535. [PubMed] [DOI] |