修回日期: 2009-06-18
接受日期: 2009-06-23
在线出版日期: 2009-07-28
原代肝细胞的分离和培养是建立体外HBV感染的细胞模型和临床应用生物人工肝的关键步骤, 许多学者对肝细胞分离和培养技术做了大量探索. 本文就近年来建立的各种肝细胞分离技术和培养技术的优缺点进行比较, 并对该领域今后的发展前景作了展望.
引文著录: 牟卉卉, 胡康洪. 原代肝细胞分离培养技术现状及展望. 世界华人消化杂志 2009; 17(21): 2164-2170
Revised: June 18, 2009
Accepted: June 23, 2009
Published online: July 28, 2009
Isolation and culture of primary hepatocytes are key steps for establishment of the in vitro cellular model of HBV infection and clinical application of bioartificial liver. Over the past decade, numerous studies have been performed on the isolation and culture of hepatocytes. In this article, we will review the advantages and disadvantages of various hepatocyte isolation and culture techniques developed so far and discuss future prospects in this field.
- Citation: Mou HH, Hu KH. Recent advances in techniques for isolation and culture of primary hepatocytes. Shijie Huaren Xiaohua Zazhi 2009; 17(21): 2164-2170
- URL: https://www.wjgnet.com/1009-3079/full/v17/i21/2164.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i21.2164
乙型肝炎是由乙型肝炎病毒(hepatitis B virus, HBV)引起的严重危害人类健康的病毒性传染疾病. 要对HBV的进入机制进行研究, 就需要具有良好分化表型的原代肝细胞作为工具[1]. 而随着生物人工肝在治疗急性肝衰竭领域的广泛应用, 也需要具有较好生存能力和分化功能的原代肝细胞作为生物材料. 因此, 肝细胞的分离、培养技术受到了越来越多的关注. 近年来, 许多学者在原代肝细胞分离和培养技术上做了大量的探索, 为肝细胞分离、培养技术的实际应用提供了大量的技术支持, 现将各种方法的优缺点作一比较并对该领域的前景作概述性展望.
体外培养肝细胞的关键是如何分离得到形态完整、体外代谢活性高的肝细胞. 自1953年Anderson[2]首创剪切法从肝脏分离肝细胞以来, 各实验室对肝细胞的分离方法进行了不断改进. 在众多方法中, 主要分为非灌流的方法和灌流的方法.
早期的研究一般通过非灌流这种简单的步骤分离肝细胞.
1.1.1 机械分离法: 机械分离法是利用机械剪切及强力吹打等物理手段来分离肝细胞的方法[3]. 张顶 et al[4]在分离树鼩肝细胞的过程中, 首先将树鼩的肝脏剪成小块, 然后通过挤压、剪碎和震荡等机械手段, 使肝细胞从肝组织上脱落, 从而获得互相分离的肝细胞.
1.1.2 胰酶消化法: 胰酶消化法是利用胰酶来破坏肝细胞之间的桥连, 使肝细胞分离的一种方法. Dulbecco et al[5]首次采用胰酶来分离猴肾细胞、大鼠肝细胞, 并运用到体外细胞的研究和培养中. 刘友平 et al[6]利用该方法分离肝细胞时, 首先取出小鼠的肝组织用眼科剪剪碎至糊状, 然后用缓冲液充分清洗并加入胰酶进行消化. 待消化完全后用D-Hank's液清洗, 最后加入含有血清的培养液终止胰酶的作用, 得到消化彻底的细胞悬液.
1.1.3 胶原酶消化法: 胶原酶消化法是利用胶原酶来破坏细胞间的纤维成分, 使肝细胞分离的一种方法. 王琳 et al[7]在利用该方法分离新生小鼠肝细胞时, 首先将新生小鼠的肝脏剪成1 mm3组织块, 用无钙无镁的D-Hank's液反复冲洗后加入胶原酶进行消化. 最后用DMEM液终止胶原酶的作用, 得到肝细胞悬液.
虽然非灌流的方法以其简单易行的特点得到了一定的应用, 但由于存在消化不完全、分离得到的肝细胞中多细胞团块存在的问题, 不能满足许多基础研究或临床应用的要求. 1969年, Berry和Friend[8]引入了肝脏灌流法, 灌流可以使消化液与肝组织更加充分地接触, 不仅提高了分离效率, 还使分离所得肝细胞的活力和数量大大提高.
1.2.1 离体胶原酶灌流法: 离体胶原酶灌流法是将离体灌注与胶原酶消化相结合的方法. 在使用该方法分离肝细胞时, 首先将动物肝脏取出, 于门静脉内置管或直接在获得的肝组织块的血管或切口内置管, 用预热的无钙无镁的D-Hank's液灌流. 然后换用胶原酶作持续灌流, 使肝细胞与间质分离. 最后用培养液终止胶原酶的消化作用, 过滤、离心、弃上清后得到肝细胞悬液[9].
1.2.2 Seglen两步灌流法(原位胶原酶灌注法): 自从引入灌流法分离肝细胞以来, 许多学者根据不同的应用条件对灌流法进行了改良. 其中Seglen[10]经过一系列细致的研究, 创立了改良的Seglen两步灌流法, 这一方法已成为应用至今的标准的原代肝细胞分离方法. 两步灌流法主要是通过门静脉先后用含EDTA或EGTA缓冲液和胶原酶缓冲液进行灌注来分离肝细胞的方法. 许多学者在具体操作中, 不断改进两步灌流法的灌注条件, 目的在于进一步减少分离过程中肝细胞的损伤, 提高肝细胞的活率[11-12].
1.2.3 半原位胶原酶灌流法: 半原位胶原酶灌流法是我国学者彭齐容 et al[13]以Seglen法为基础建立的肝细胞分离技术. 俞红 et al[14]在采用该方法分离乳猪肝细胞时, 首先用无钙无镁的D-Hank's液于门静脉进行原位灌注. 接着, 除保留门静脉以外, 离断肝脏血管并将肝脏移入无菌平皿中, 继续用胶原酶进行灌注使肝细胞与间质细胞分离. 最后钝性撕裂组织, 过滤洗涤后得到制备好的细胞悬液.
1.2.4 下腔静脉插管的逆向胶原酶灌注法: 下腔静脉插管的逆向胶原酶灌注法是在肝下腔静脉插管, 并结合逆向胶原酶灌注来分离肝细胞的方法[9]. 在采用该方法分离肝细胞时, 首先将灌注针逆向插入下腔静脉后固定, 门静脉开放做流出道. 接着用含EGTA或EDTA的灌注液进行灌注, 一段时间后再用含有Ca2+的胶原酶进行充分灌注. 灌流结束后, 将细胞过滤、清洗后得到制备好的肝细胞悬液.
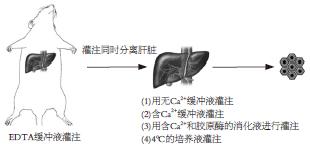
1.2.5 Gerlach五步胶原酶灌流法: 在使用两步灌流法分离大的肝组织块时, 仍存在消化不完全的问题. 而Gerlach et al[15]在两步灌流法的基础上, 创立了联合门静脉和肝动脉的五步胶原酶灌流技术, 建立了一种高效的细胞分离方法(图1).
刘应生 et al[16]在使用该方法分离细胞时, 采用了无钙缓冲液进行开放灌注, 以去除器官内血细胞, 这样可以得到纯度更高的肝细胞. 并且用无Ca2+缓冲液洗掉Ca2+后再用含Ca2+缓冲液开放灌注, 这样可以提前为胶原酶营造一个Ca2+环境. 最后用4℃的培养液进行灌注, 低温的环境可以减少操作过程对细胞造成的损害.
不同的分离方法具有不同特点, 各方法的优缺点对比见表1.
| 分离方法 | 最适对象 | 优点 | 缺点 | 参考文献 |
| 机械分离法 | 小型动物及肝组织块 | 操作简单; 不需要复杂仪器和昂贵的胶原酶; 分离得到细胞的膜蛋白的成分和性质不易发生改变 | 所得细胞的收获量和成活率很低 | [3], [4] |
| 胰酶消化法 | 操作简单; 酶价格便宜 | 胰酶易造成肝细胞死亡, 使细胞活率低 | [17], [18] | |
| 胶原酶消化法 | 肝脏体积小的动物 | 操作简单; 细胞产率高、损伤小, 且细胞维持特异功能时间较长 | 胶原酶价格昂贵; 获得的肝细胞悬液多细胞团块存在 | [7], [18] |
| 离体胶原酶灌流法 | 该法具有较好的细胞收率 | 需要较高的操作水平; 需要摸索最适酶浓度和作用时间; 所得细胞活率低 | [9], [19] | |
| 半原位胶原酶灌流法 | 适用于大规模的肝细胞分离 | 不需要特殊设备; 半原位灌注使胶原酶的用量仅为原位灌注的1/4 | 操作技巧要求高; 易发生污染; 细胞易发生灌注再损伤而具有较低的生存能力 | [14], [18] |
| Seglen两步灌流法 | 主要适用于中等大小动物 | 所得肝细胞较纯, 细胞存活率高; 可分离肝实质细胞及肝非实质细胞 | 操作过程复杂, 影响因素多, 细胞易污染; 需要恒流灌注装置, 胶原酶消耗量大 | [18], [20], [21] |
| 下腔静脉插管的逆向胶原酶灌注法 | 灌注效率高, 细胞收率高; 分离得到的细胞纯度高、生存能力强; 节省胶原酶; 细胞不易发生污染 | 该方法要求较高的操作技巧 | [9], [22] | |
| Gerlach五步胶原酶灌流法 | 主要用于大规模肝细胞分离 | 分离效率高, 所得细胞纯度高; 灌注的同时分离肝脏, 可避免污染; 所得细胞具有较强的生存能力和分化特性 | 操作过程复杂; 该方法的分离效果易受到不同的胶原酶浓度、动物体质量和月龄的影响 | [16] |
自19世纪末以来, 鉴于肝脏代谢学、毒理学、生物化学与分子生物学研究不断增长的需求, 众多科学家都致力于肝细胞培养技术的不断探索, 使该领域得到了较快的发展. 到目前为止, 用于肝细胞培养的方法主要有以下几种, 现叙述如下.
该法是用于培养肝细胞的最原始的方法. 聂兴草 et al[23]在运用该方法培养肝细胞时, 首先将肝组织块用消化液短时间处理, 然后直接贴于培养瓶内壁, 加入培养液后置于37℃、50 mL/L CO2条件下进行培养.
研究表明, 肝非实质细胞在肝细胞特性及生物学功能的维持中发挥着举足轻重的作用[24]. Bhatia et al[25]认为, 肝非实质细胞能够通过生成HGF等生长因子来促进肝细胞的增殖, 并使肝细胞维持其生物学特性. 王英杰 et al[26]在使用该方法培养肝细胞时, 将所得肝细胞、肝非实质细胞按2:1的比例混合, 在37℃条件下旋转培养1 h, 使两类细胞形成球形聚集体后移入被覆聚羟乙基异丁烯酸的培养瓶中, 在常规条件下继续旋转培养.
由于肝细胞属上皮细胞类型, 所以细胞所处的微环境对于细胞生存能力和分化特性的维持发挥着至关重要的作用[27]. 而加入到培养体系中的胶原可以为细胞提供一个类似于体内环境的微环境, 有利于细胞生长状态和分化特性的维持. 在使用该方法培养肝细胞时, 首先将分离得到的肝细胞接种在胶原涂层的平面载体上, 然后加入培养液在37℃、50 mL/L CO2的条件下进行培养.
双层胶夹层培养法也称胶原三明治培养法, 是较为常用的三维细胞培养方法[28]. 胶原夹层的制备方法是: 首先在培养器皿中加入适量胶原, 放置过夜, 使胶原在培养器皿底部均匀地铺上一层. 将多余的胶原吸出后加入分离好的细胞悬液, 在37℃、50 mL/L CO2的环境中培养一定时间, 使肝细胞能够黏附到胶原表面. 最后再在细胞悬液上加入胶原, 待胶原形成均匀的一层胶原膜后, 加入培养液继续培养.
微载体黏附培养法是将分离得到的肝细胞与微载体一起加到培养介质中, 利用肝细胞具有贴壁生长的特性, 通过振动或其他手段, 使肝细胞附着到微载体表面, 形成以微载体为中心的肝细胞聚集体而进行培养的一种方法[29]. 为了更有利于肝细胞的大规模培养, 许多学者优化了常规微载体制备的反应条件, 希望能进行肝细胞的大规模培养[30-33].
微囊培养法是将肝细胞悬浮在多聚赖氨酸与海藻酸反应形成的囊内, 形成微囊化的肝细胞[34]. 细胞生存所需要的营养物质、氧气、代谢产物及其分泌的生物活性物质能通过囊膜出入, 而宿主免疫细胞、免疫球蛋白、补体等则不能通过半透膜. 微囊既作为免疫隔离屏障又具有良好的通透性, 使囊内肝细胞保持良好的生存能力和生物学特性, 并且能够不受宿主的免疫排斥而长期存活[35].
提高培养细胞的密度、维持肝细胞的体外活性和分化特性, 一直是现有细胞培养方法亟待解决的问题. 而培养方法的改进目前主要集中在两个方面, 即提高培养细胞的密度、维持较高的生存能力和分化特性[36].
球形聚集体培养法是根据新分离的肝细胞具有相互聚集的特性, 通过一定的手段抑制肝细胞单层贴壁生长, 使肝细胞聚集成多细胞球状体来进行培养的方法.
最初, 人们主要采用肝细胞球形聚集体回旋培养法, 该方法是通过转动培养烧瓶来促使肝细胞的聚集. 由于该方法在维持培养体系中肝细胞分化特性方面所具有的优势, 使其在抗肿瘤新药筛选领域得到了一定应用[37]. 但研究发现, 通过回旋的方式来促进肝细胞球状体的形成需较长时间, 而球状体形成的推迟会使肝细胞较快失去分化表型和发生死亡, 所以该方法一直未得到十分广泛的应用. 而Brophy et al[38]采用振荡的方式来促进球形聚集体的形成, 并且研究发现, 球状体振荡培养法是一种比单层培养系统乃至球状体回旋培养法更加快速、高效的肝细胞培养方法, 是一种可用于原代肝细胞培养的三维细胞培养法.
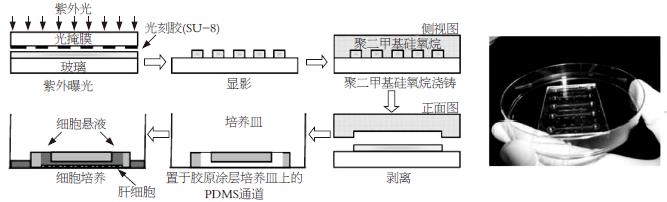
微流体通道培养法是采用软蚀刻技术, 以聚二甲基硅氧烷(polydimethyl siloxane, PDMS)为材料制成微小腔室来进行原代肝细胞培养的方法[39].
在制作微通道时, 首先将负性光致抗蚀剂以旋转的方式铺到硼硅酸盐玻璃表面. 然后将玻璃片置于热平板上, 分别于65℃烘烤5 min和95℃烘烤20 min. 接着, 在制作的光蚀胶上面放上铬模具, 用紫外线进行照射. 再将照射后的光蚀胶置于热平板上, 分别于65℃烘烤1 min和95℃烘烤10 min. 用显影剂显影后用异丙醇清洗, 得到了制作微通道的模板. 把制作好的模板置于培养皿中, 将与固化剂以10:1的比例配制成的PDMS倾倒到制作好的模具上, 脱气除去气泡, 置于80℃的对流箱中固化1 h. 之后将膜取出, 冷却到室温后, 将PDMS膜从模具上剥下, 切成适合大小并用细的不锈钢管在每条通道的两头钻孔. 最后, 将PDMS膜直接放到培养皿中待用. 制作过程和得到的装置见图2.
采用该方法进行细胞培养时, 首先将微通道灭菌, 然后放置到用胶原涂层的组织培养皿上, PDMS的界面性质会使他可逆地黏附到培养皿的底部. 接着用PBS浸润微通道, 将要培养的细胞接种到微通道中并加入培养液进行培养. 此外, 在PDMS膜的外围要倒入一定量的培养液, 以防止微通道中培养液的汽化.
生物反应器是生物人工肝(bioartificial liver, BAL)系统的核心部件, 承担着大量培养肝细胞和维持其功能的任务. 设计合理的生物反应器能够为培养其中的肝细胞提供充足的营养, 排除代谢产物, 维持其正常的生长状态和生化指标[40-41]. 目前已有的生物反应器包括: (1)中空纤维生物反应器; (2)平板单层生物反应器; (3)灌注床或支架生物反应器; (4)包被悬浮生物反应器. 其中研究和应用较多的是中空纤维反应器.
在使用该系统进行细胞培养时, 首先将分离得到的生长状态良好的肝细胞悬浮于胶原凝胶中并接种于中空纤维管外间隙. 然后通过中空纤维管内间隙, 将培养液加入到循环体系中, 最后将整个中空纤维管置于培养箱中进行培养. 培养于该系统中的肝细胞通过管壁上的微孔与培养液中的营养物质进行物质交换, 来维持较好的生长状态[42].
在研究与应用过程中, 许多科学家对该系统进行了改进, 如Jasmund et al[43]将肝细胞接种于中空纤维的外腔, 而灌流液亦灌注于外腔, 纤维内腔则专门用于供氧及控制培养温度. 这样可以保证系统中的细胞具有良好的营养供应, 并且能够在更加适宜的温度和气体环境下生长. 而何礼荣 et al[44]设计的编织型中空纤维管生物反应器, 改进了普通反应器中肝细胞易沉积到基底部的缺点, 使培养的细胞具有较好的生存能力和生长特性. 另外, Chia et al[45]将肝细胞附着在微载体表面或包裹在微囊中, 然后接种到生物反应器中, 这样可以为细胞提供一个类似于体内的微环境, 使培养于其中的肝细胞能够更好地维持其分化状态和功能.
迄今发展的各种肝细胞培养方法各具优缺点, 对比见表2.
| 培养方法 | 最适对象 | 优点 | 缺点 | 参考文献 |
| 组织块贴壁培养法 | 操作简便, 流程短, 成本低 | 所培养的细胞数量有限、且细胞成分不纯; 细胞生长状态较差 | [6] | |
| 肝细胞-非实质细胞混合培养法 | 细胞具有良好的生长状态和分化特性; 提高培养细胞的密度 | 需较高的细胞分离技术; 培养条件要求高 | [26], [46] | |
| 单层胶原培养法 | 操作简单; 细胞能在较长时间内维持正常形态和生理功能, 有一定的增殖能力. | 不能用于大规模细胞培养; 易使肝细胞失去分化表型 | [47], [48], [49] | |
| 双层胶夹层培养法 | 细胞生长状态好; 良好微环境有助于维持肝细胞功能和分化特性 | 需要昂贵的胶原; 需要较高的技术支持 | [50], [51] | |
| 微载体黏附培养法 | 动物细胞和人肝细胞系 | 具有相对较大培养空间; 培养环境均一, 避免发生接触抑制; 实现细胞可控生长; 细胞易于黏附, 生长状态好; 培养可自动化 | 细胞易失去正常形态和分化功能; 剪切力、营养供给等因素会影响细胞生存和分化; 存在使用安全性问题 | [30], [31], [32], [33], [49], [52] |
| 微囊培养法 | 培养的细胞具良好代谢活性; 能为细胞提供适宜的微环境; 细胞存活率高; 培养的细胞可用于异种移植 | 存在生物相容性问题; 细胞培养的效果受多种因素制约, 稳定性差 | [34], [35], [53] | |
| 球形聚集体培养法 | 适用于原代细胞培养 | 设备简单, 节省经费; 培养的细胞具有良好的生长状态和分化特性; 不需特殊载体; 实现了高密度细胞培养 | 需纯度较高的细胞来源; 需较高操作水平 | [36], [38], [54] |
| 微流体通道培养法 | 适用于微量原代细胞培养 | 所需细胞数量和试剂量少; 能维持细胞良好的生长和分化状态; 细胞能维持特异性表型 | 需特殊技术、花费大; 细胞生长速率慢、易感性低; 不能进行大规模细胞培养 | [39] |
| 生物反应器培养系统 | 大规模细胞培养 | 可进行大规模细胞培养; 可避免异种细胞产物抑制细胞的生长、分化; 细胞生长状态好 | 需高的技术和经济支持; 细胞活力低; 肝细胞功能难以长期维持 | [40], [41], [42], [44], [45], [55], |
在过去的几十年里, 肝细胞的体外培养技术在众多科学家的共同努力下得到了迅猛的发展, 出现了能满足各种实验要求的细胞分离与培养方法, 促进了以肝细胞分离、培养为基础的各项研究的进程.
在探索过程中, 除了对肝细胞的分离、培养技术进行研究外, 还有人对用于肝细胞培养的培养液成分进行了摸索[56]. 最初, 人们在培养液中加入一定量的胎牛血清, 使培养的肝细胞能够在较长时间内维持生存能力, 但这样并不利于肝细胞分化特性的维持. 失去分化表型的肝细胞无法被HBV感染, 故使用该培养液培养得到的肝细胞不能作为细胞模型应用到对HBV感染的研究当中. 有人发现, 门静脉血中含有一定成分, 能促进肝细胞分化. 但从不同动物血管中收集得到的门静脉血成分所具有的不均一性, 阻碍了该培养液的广泛的应用. 近年来, 随着人们对肝细胞生长、分化相关细胞因子研究的深入, 不同生长因子在肝细胞生长、分化的不同阶段所起作用也逐渐得到了阐明. 为了能使肝细胞能在完全可控的条件下生长, 科学家们多采用无血清的已知成分的化学培养液, 然后再加入一定量的能促进肝细胞分化的生长因子, 实现了肝细胞的可控培养.
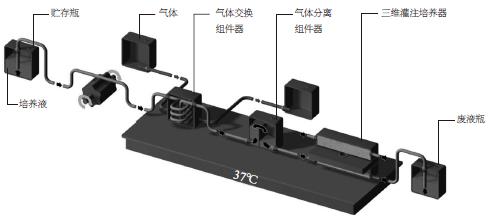
有关原代肝细胞培养, 科学家们最关心的还是处于培养体系中的肝细胞能否在尽可能长的时间内维持其分化表型, 使HBV能够在自然培养状态下成功感染肝细胞, 进而鉴定HBV受体, 深入研究HBV复制过程及致病机制, 并进行有效的抗病毒药物筛选. 但到目前为止, 所有的培养方法都难以达到此要求, 培养得到的细胞或者具有较低的生存能力, 或者在培养过程中很快失去分化表型. 所以, 缺乏模拟体内HBV感染过程的体外感染细胞系统, 一直是进行HBV基础研究的一个巨大的技术瓶颈. 胡康洪 et al[37,57-58]在研究肾小管的发育和功能性成熟的过程中, 创建了一种全新的基于人工脉管的三维培养系统(图3). 经过详细研究处于培养体系中的组织外植体的微环境后发现, 培养液体积远大于组织外植体的体积(也称死角体积)是制约外植体分化的关键, 而以人工脉管取代胶原作为生长支架的三维培养系统可最大限度降低死角体积, 有助于在较长时间内维持原代细胞的分化表型. 同时, 经过筛选得到的聚酯羊毛人工脉管在加入培养液后可模拟天然的毛细血管, 保证了组织表面均匀的液体交换. 该培养系统不仅为细胞提供了某种程度的机械保护, 也很好地模拟了体内微环境, 使培养其中的细胞能在较长的时间内维持良好的生长、分化状态.
受到该思路的启发, 我们拟将该基于人工脉管的三维培养系统运用到原代肝细胞的培养中, 在不含血清的化学培养液中加入各种肝细胞生长因子, 并通过不断优化培养条件, 建立适用于HBV感染的原代肝细胞培养模型.
我们相信, 肝细胞分离培养技术的不断完善必将对以肝细胞研究为基础的病毒学、病理学和毒理学、生物化学、药代动力学、发育生物学以及以肝细胞移植为基础的临床治疗与应用产生巨大的推动作用.
乙型肝炎病毒(HBV)感染导致的慢性肝炎是严重威胁人类健康的世界性疾病. 由于缺乏理想的体外感染模型, HBV复制机制的研究和抗病毒药物筛选一直受到制约. 实验室对获得足够数量以及生长状态良好的肝细胞的需求十分迫切, 发展和完善原代肝细胞分离技术和培养技术是进行HBV基础研究、新药发现以及生物人工肝应用的关键一步.
孙殿兴, 主任医师, 白求恩国际和平医院肝病科.
摸索最佳的分离方法和培养条件, 使分离培养得到的原代肝细胞获得足够的细胞数量和最佳的生存能力. 在众多科学家的共同努力下, 出现了许多更加优化的分离条件和新颖的细胞培养系统.
对于肝细胞的培养, 三维细胞培养技术受到了越来越多的关注. 许多研究者正致力于对最佳培养方式的探索, 除了球状体培养法、微通道培养法以及生物反应器培养法等方法外, 印制阵列培养法也受到了关注, 是一种具有较大应用前景的肝细胞培养方法.
本文除总结近年来出现的肝细胞的分离和培养技术, 还对这些方法的优缺点进行了详细的对比. 对于新出现的一些方法, 文中也有较详细的论述.
肝细胞的分离和培养技术在HBV感染模型的建立、生物人工肝的运用以及许多相关生命科学领域的研究中发挥着十分重要的作用. 本文对于肝细胞分离和培养技术作了较详尽的概述, 这对于实际应用具有指导意义.
本文内容全面, 有深度, 提供了很多有意义的新信息, 对于原代肝细胞分离培养技术的应用与改进, 有重要的指导价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Bremer CM, Bung C, Kott N, Hardt M, Glebe D. Hepatitis B virus infection is dependent on cholesterol in the viral envelope. Cell Microbiol. 2009;11:249-260. [PubMed] [DOI] |
| 2. | Anderson NG. The mass isolation of whole cells from rat liver. Science. 1953;117:627-628. [PubMed] [DOI] |
| 3. | Mitry RR, Hughes RD, Aw MM, Terry C, Mieli-Vergani G, Girlanda R, Muiesan P, Rela M, Heaton ND, Dhawan A. Human hepatocyte isolation and relationship of cell viability to early graft function. Cell Transplant. 2003;12:69-74. [PubMed] [DOI] |
| 5. | Dulbecco R, Vogt M. Plaque formation and isolation of pure lines with poliomyelitis viruses. J Exp Med. 1954;99:167-182. [PubMed] [DOI] |
| 8. | Berry MN, Friend DS. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J Cell Biol. 1969;43:506-520. [PubMed] [DOI] |
| 10. | Seglen PO. Preparation of isolated rat liver cells. Methods Cell Biol. 1976;13:29-83. [PubMed] [DOI] |
| 11. | Gerlach JC, Brombacher J, KlÖppel K, Schnoy N, Neuhaus P. Comparison of four methods for mass hepatocyte isolation from pig and human livers. Transplantation. 1994;57:1318-1322. [PubMed] [DOI] |
| 14. | 俞 红, 秦 爱兰, 周 霞秋, 向 晓星, 张 韡. 乳猪肝细胞的分离、培养及功能检测. 上海第二医科大学学报. 2004;24:178-180. |
| 15. | Gerlach J, Brombacher J, Smith M, Neuhaus P. High yield hepatocyte isolation from pig livers for investigation of hybrid liver support systems: influence of collagenase concentration and body weight. J Surg Res. 1996;62:85-89. [PubMed] [DOI] |
| 18. | 田 三德, 潘 婕, 解 尚云. 体外肝细胞培养的研究进展. 陕西科技大学学报(自然科学版). 2006;24:152-155. |
| 22. | Aiken J, Cima L, Schloo B, Mooney D, Johnson L, Langer R, Vacanti JP. Studies in rat liver perfusion for optimal harvest of hepatocytes. J Pediatr Surg. 1990;25:140-144; discussion 144-145. [PubMed] [DOI] |
| 24. | 张 莉萍, 康 格非. 原代肝细胞培养的研究现状. 国外医学•临床生物化学与检验学分册. 2004;25:193-196. |
| 25. | Bhatia SN, Balis UJ, Yarmush ML, Toner M. Effect of cell-cell interactions in preservation of cellular phenotype: cocultivation of hepatocytes and nonparenchymal cells. FASEB J. 1999;13:1883-1900. [PubMed] |
| 29. | Consolo F, Fiore GB, Truscello S, Caronna M, Morbiducci U, Montevecchi FM, Redaelli A. A computational model for the optimization of transport phenomena in a rotating hollow-fiber bioreactor for artificial liver. Tissue Eng Part C Methods. 2009;15:41-55. [PubMed] [DOI] |
| 31. | Tao X, Shaolin L, Yaoting Y. Preparation and culture of hepatocyte on gelatin microcarriers. J Biomed Mater Res A. 2003;65:306-310. [PubMed] [DOI] |
| 33. | Wu C, Pan J, Bao Z, Yu Y. Fabrication and characterization of chitosan microcarrier for hepatocyte culture. J Mater Sci Mater Med. 2007;18:2211-2214. [PubMed] [DOI] |
| 34. | 许 烂漫, 陈 永平. 微囊化肝细胞在急性肝衰竭中的研究进展. 国际流行病学传染病学杂志. 2006;33:121-123, 128. |
| 38. | Brophy CM, Luebke-Wheeler JL, Amiot BP, Khan H, Remmel RP, Rinaldo P, Nyberg SL. Rat hepatocyte spheroids formed by rocked technique maintain differentiated hepatocyte gene expression and function. Hepatology. 2009;49:578-586. [PubMed] [DOI] |
| 39. | Sodunke TR, Bouchard MJ, Noh HM. Microfluidic platform for hepatitis B viral replication study. Biomed Microdevices. 2008;10:393-402. [PubMed] [DOI] |
| 43. | Jasmund I, Langsch A, Simmoteit R, Bader A. Cultivation of primary porcine hepatocytes in an OXY-HFB for use as a bioartificial liver device. Biotechnol Prog. 2002;18:839-846. [PubMed] [DOI] |
| 45. | Chia SM, Wan AC, Quek CH, Mao HQ, Xu X, Shen L, Ng ML, Leong KW, Yu H. Multi-layered microcapsules for cell encapsulation. Biomaterials. 2002;23:849-856. [PubMed] [DOI] |
| 46. | Nyberg SL, Shatford RA, Hu WS, Payne WD, Cerra FB. Hepatocyte culture systems for artificial liver support: implications for critical care medicine (bioartificial liver support). Crit Care Med. 1992;20:1157-1168. [PubMed] |
| 47. | Koike M, Matsushita M, Taguchi K, Uchino J. Function of culturing monolayer hepatocytes by collagen gel coating and coculture with nonparenchymal cells. Artif Organs. 1996;20:186-192. [PubMed] |
| 48. | Kern A, Bader A, Pichlmayr R, Sewing KF. Drug metabolism in hepatocyte sandwich cultures of rats and humans. Biochem Pharmacol. 1997;54:761-772. [PubMed] [DOI] |
| 49. | 李 晓斌. 用于生物人工肝的细胞培养及其应用. 国外医学•消化系疾病分册. 2000;20:30-33. |
| 50. | Dunn JC, Yarmush ML, Koebe HG, Tompkins RG. Hepatocyte function and extracellular matrix geometry: long-term culture in a sandwich configuration. FASEB J. 1989;3:174-177. [PubMed] |
| 52. | Chamuleau RA, Deurholt T, Hoekstra R. Which are the right cells to be used in a bioartificial liver? Metab Brain Dis. 2005;20:327-335. [PubMed] [DOI] |
| 54. | 王 宇明. 肝细胞培养系统在生物人工肝中应用的研究进展. 国外医学•流行病学传染病学分册. 1993;20:97-102. |
| 58. | Hu K, Denk L, de Vries U, Minuth WW. Chemically defined medium environment for the development of renal stem cells into tubules. Biotechnol J. 2007;2:992-995. [PubMed] [DOI] |