修回日期: 2009-07-13
接受日期: 2009-07-20
在线出版日期: 2009-07-28
目的: 观察海水浸泡对血管内皮细胞迁移和血管生成的影响, 为探讨海水致伤机制、制定科学救治原则提供实验依据.
方法: 建立ECV304细胞划痕创伤模型, 分别给予生理盐水和人工海水浸泡处理, 划痕创伤愈合修复分析观察细胞迁移能力; 建立人食管鳞癌EC0156裸鼠皮下移植瘤模型, 分别给予生理盐水和人工海水干预, 监测肿瘤体积并绘制肿瘤生长曲线, 观察肿瘤边缘血管的生成, 免疫组织化学染色检测肿瘤组织内微血管密度.
结果: 海水浸泡后, ECV304细胞失去正常形态, 并随浸泡时间的延长, 呈明显"脱水"状态. 在划痕后17 h, 对照组划痕已基本愈合, 而实验组仍可见清晰划痕, 且以实验4 h组划痕尤其明显. 与对照组相比, 实验组细胞划痕愈合明显延迟, 细胞迁移能力降低; 与对照组相比实验组肿瘤边缘新生血管较少, 前者肿瘤边缘新生血管较丰富, 两者有显著性差异(微血管密度值: 1.2±0.44 vs 3.2±0.83, P<0.05). 实验组肿瘤生长缓慢, 肿瘤体积较小(P<0.05).
结论: 海水浸泡能够降低血管内皮细胞迁移能力并抑制血管生成.
引文著录: 熊鸣, 曲佳, 周兰萍, 张达矜, 乔媛媛, 胡明, 赵晓航. 海水浸泡降低血管内皮细胞迁移能力并抑制血管生成. 世界华人消化杂志 2009; 17(21): 2152-2158
Revised: July 13, 2009
Accepted: July 20, 2009
Published online: July 28, 2009
AIM: To investigate the effects of seawater immersion on vascular endothelial cell migration and angiogenesis.
METHODS: A scratch wound model was established using ECV304 cells. Cells were divided into control group (immersed in normal saline) and experimental group (immersed in seawater). Cell migration was examined using the scratch wound healing recovery assay. A nude mouse xenograft model was developed by subcutaneous inoculation of esophageal squamous cells (ECO156) in nude mice. Tumors were also divided into control group (immersed in normal saline) and experimental group (immersed in seawater). Tumor volume and weight were measured, and tumor growth curves were plotted. Neovascular vessels surrounding the tumor were observed, and microvessel density was detected by immunohistochemical staining.
RESULTS: After seawater immersion, ECV304 cells lost their normal morphology, and showed obvious dehydration with the prolongation of immersion duration. Seventeen hours after wounding, the scratch wound in the control group had almost completely healed, while that in the experiment group was still obvious, suggesting that the healing of scratch wound in the experiment group was delayed significantly and the migration of cells was depressed. The microvessel density in the experiment group was significantly lower than that in the control group (1.20 ± 0.44 vs 3.20 ± 0.83, P < 0.05). Compared with the control group, tumors in the experiment group grew slowly and had significantly smaller size (P < 0.05).
CONCLUSION: Seawater immersion may depress the migration of vascular endothelial cells and inhibit angiogenesis.
- Citation: Xiong M, Qu J, Zhou LP, Zhang DJ, Qiao YY, Hu M, Zhao XH. Seawater immersion depresses the migration of vascular endothelial cell and inhibits angiogenesis. Shijie Huaren Xiaohua Zazhi 2009; 17(21): 2152-2158
- URL: https://www.wjgnet.com/1009-3079/full/v17/i21/2152.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i21.2152
21世纪是海洋世纪, 也是我国海洋经济可持续发展的时代, 伴随着各类海洋产业的蓬勃发展, 海上事故的发生频率日益增高, 如何开展科学有效的海上救援成为亟待解决的问题. 由于海水具有高盐、高渗、偏碱等特点, 在这种特殊环境条件下落水人员易遭受创伤和海水浸泡的复合打击, 伤情进展和致伤机制与陆地伤明显不同[1]. 研究发现, 腹部开放伤合并海水浸泡情况下, 海水直接损伤创伤局部组织血管, 或通过腹膜透析作用进入体内, 使循环系统处于高盐、高渗状态, 机体内环境稳态被破坏, 大量修复细胞, 尤其是血管内皮细胞(vascular endothelial cells, VECs)的结构和功能受损, 创伤愈合明显延迟, 伤员救治也更为复杂[2-3]. 本课题组在前期的研究中, 借助于实时定量PCR芯片技术发现海水浸泡能够广泛引起血管内皮细胞重要功能基因表达改变. 其中, E选择素(selectin E, SELE)、血管内皮生长因子(vascular endothelial growth factor, VEGF)、凝血酶敏感蛋白-1(thrombospondin 1, TSP-1)、基质金属蛋白酶-9(matrix metalloproteinases, MMP-9)等一系列与细胞运动、血管生成相关的基因均出现了不同程度的差异表达[4]. 因此, 在前期工作基础上, 进一步观察海水浸泡对血管内皮细胞迁移和血管生成的影响, 为探讨海水致伤机制、制定科学救治原则提供实验依据.
实验用健康♀Babic裸鼠, 周龄5 wk, 体质量15-16 g, 共18只, 由中国医学科学院实验动物研究所繁育厂提供. DMEM培养基购自Gibco/BRL公司; 胰酶购自Promega公司; SP试剂盒、EDTA抗原修复液(pH9.0)和DAB试剂盒购自迈新公司; 兔抗人VWF多克隆抗体购自DakoCytomation公司.
1.2.1 人工海水配制: 实验用人工海水参照国家海洋局第三研究所标准[3]配制, 主要指标为: 渗透压1250.00±11.52 mOsm/L, pH8.2, 钠离子浓度630.00±5.33 mmol/L, 钾离子浓度10.88±0.68 mmol/L, 氯离子浓度658.80±5.25 mmol/L.
1.2.2 细胞培养: 人食管鳞癌细胞系EC0156由中国医学科学院肿瘤研究所建系[5], 人脐静脉内皮细胞系ECV304购自中国医学科学院细胞中心, 2种细胞均培养于DMEM培养基中, 含100 mL/L胎牛血清、100 kU/L青霉素和100 g/L链霉素, 置于50 mL/L CO2的37℃孵箱内培养, 每3-4 d传代1次.
1.2.3 ECV304细胞划痕创伤模型的建立: 处于对数生长期的ECV304细胞经2.5 g/L的胰酶消化后, 与含100 mL/L胎牛血清的DMEM培养基混合, 制成单细胞悬液, 按每孔约3×105细胞密度均匀接种于预先放置有0.01%多聚赖氨酸包被的无菌盖玻片的6孔细胞培养板中, 37℃培养至细胞融合率达到60%-70%时, 用无菌200 μL枪头沿细胞层纵轴作两道平行的划痕, 造成单层融合细胞划痕创伤模型[6-7].
1.2.4 划痕创伤愈合修复分析观察海水浸泡对ECV304细胞迁移能力的影响: 弃去旧的培养液, 每孔加入1 mL含200 mL/L胎牛血清的新鲜DMEM培养液, 37℃孵育15 min. 沿划痕边缘等间距作4个标记作为观察点, 倒置显微镜下拍照, 此时划痕宽度作为划痕初始宽度(时间记为0 h). 根据不同处理因素随机分为对照组和实验组, 对照组每孔补加1 mL生理盐水, 实验组每孔补加1 mL人工海水, 轻轻混匀; 根据不同处理时间, 每组又进一步分为2 h处理组和4 h处理组, 各组均设3个平行对照孔. 置于37℃孵育继续培育相应时间后, 在上述标记的4个相同观察点拍照, 然后用1×PBS轻轻洗3次, 更换2 mL含100 mL/L胎牛血清的DMEM培养液继续培养.每隔4 h拍照1次, 直至划痕愈合或基本愈合, 结束观察. 各处理组划痕的愈合速度即反映各组细胞的迁移能力[6-7].
1.2.5 EC0156裸鼠皮下移植瘤模型的建立和分组处理: 处于对数生长期的EC0156细胞经2.5 g/L胰酶消化后与1×PBS混合, 制成单细胞悬液, 按每只1×107细胞接种于裸鼠背部右后肢外侧皮下. 从接种当日(即接种后0天)算起, 至第7天, 全部裸鼠均存活并出现皮下可触摸的质硬肿块.用游标卡尺测量肿瘤结节的长(l)和宽(b)(精确度0.002 cm), 按公式V = lb2/2计算肿瘤体积. 根据肿瘤体积大小进行配对并随机分为2组, 对照组和实验组, 每组8只, 分别依次编号并做好标记. 对照组经肿瘤包膜于肿瘤基底部注射生理盐水, 每只500 μL, 实验组经肿瘤包膜于肿瘤基底部注射等量人工海水, 形成大小较对称的水泡, 均匀包围整个肿瘤. 2 h后水泡基本吸收, 重复前面操作, 分别再次注射500 μL生理盐水和人工海水. 定期观察裸鼠精神状态、饮食及排便情况. 分别于第10天、第12天测量肿瘤体积大小, 取每组6只裸鼠肿瘤体积的平均值绘制肿瘤生长曲线. 第12天结束观察, 麻醉处死裸鼠, 手术切开肿瘤周围皮肤, 观察肿瘤血管生成情况并拍照, 然后将肿瘤完整剥离下来, 称质量并测量肿瘤大小. 将肿瘤组织分为2份保存, 1份置于液氮冻存备用, 另1份以甲醛溶液固定常规石蜡包埋, 用于免疫组织化学染色.
1.2.6 肿瘤组织内微血管密度检测: 通过VWF免疫组织化学染色显示裸鼠移植瘤中微血管, 具体方法参考试剂盒说明书进行, 主要步骤如下: (1)石蜡包埋组织4 μm厚连续切片, 常规脱蜡和水化; (2)EDTA抗原修复液热修复20 min, 冷却至室温, 1×PBS漂洗; (3)内源性过氧化物酶阻断剂室温下孵育10 min, 1×PBS漂洗; (4)正常非免疫羊血清封闭, 室温下孵育10 min; (5)1:400稀释的兔抗人VWF多克隆抗体4℃孵育过夜, 阴性对照以1×PBS代替, 1×PBS漂洗; (6)1:200生物素标记的羊抗兔IgG室温下孵育10 min, 1×PBS漂洗; (7)过氧化物酶标记的链霉素抗生物素室温下孵育10 min, 1×PBS漂洗; (8)DAB显色, 蒸馏水冲洗, 结晶紫复染; (9)梯度酒精脱水, 二甲苯透明, 中性树胶封片, 显微镜下观察并收集图像. 微血管密度计数参照Weidner方法[8-10]进行, 先在低倍(×4)镜下扫视整个切片, 寻找血管密集区, 再在高倍(×20)镜下计数被VWF抗体染成棕黄色的微血管数目, 结果用5个20倍视野下微血管数目的平均数表示.
统计学处理 计量资料以mean±SD表示, 组间比较用t检验, 以P<0.05为有显著性差异, P<0.01为有极显著性差异.
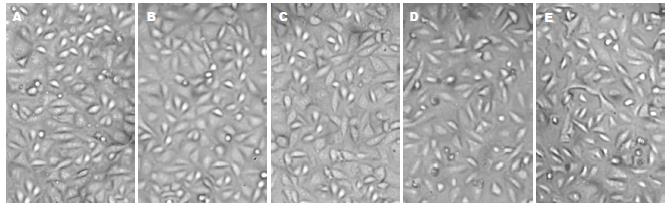
在细胞划痕创伤模型的基础上, 2组细胞分别给予生理盐水和人工海水处理, 结果显示: (1)与正常培养的ECV304细胞相比, 对照组经生理盐水浸泡2 h后, 细胞形态无明显变化, 浸泡4 h后, 少数细胞胞体略变细长, 更换正常培养液后2 h内细胞形态即可恢复正常; 而实验组经人工海水浸泡2 h后, 细胞出现皱缩, 胞体变细长, 细胞间隙增大, 更换正常培养液后12 h细胞形态基本恢复; 浸泡4 h后, 细胞进一步皱缩, 胞体失去正常的立体结构, 部分细胞核变小, 呈明显"脱水"状态, 细胞间隙进一步增大, 更换正常培养液后12 h细胞形态仍未恢复(图1). (2)在划痕后17 h, 对照组划痕已基本愈合, 而实验组仍可见清晰划痕, 且以4 h实验组划痕尤为明显(图2), 提示海水浸泡能够降低ECV304细胞迁移能力, 延缓划痕创伤愈合.
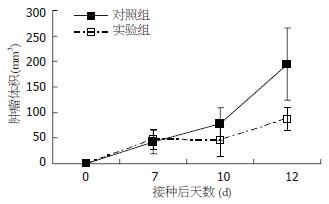
从接种当日(即接种后0 d)算起, 至第7天, 全部裸鼠均存活并出现皮下可触摸的质硬肿块, 成瘤率100% .根据肿瘤体积大小均匀配对分组, 对照组和实验组平均肿瘤体积无显著性差异.此后, 分别给予生理盐水和人工海水处理, 随着时间的延长, 两组肿瘤体积在第10天开始出现显著性差异(P<0.05), 至第12天, 两者差异具有极显著性(P<0.01, 表1). 以接种后天数为横坐标, 肿瘤体积大小为纵坐标, 取每组8只裸鼠肿瘤体积的平均值绘制肿瘤生长曲线. 结果如图3所示, 对照组肿瘤呈递增性生长, 而实验组肿瘤在人工海水处理后, 起初生长明显受抑制, 第10天与第7天相比, 肿瘤体积无明显增大, 甚至略有缩小, 随后开始增大, 但生长速度仍明显慢于对照组肿瘤. 接种后第12天, 麻醉处死裸鼠, 将肿瘤完整剥离下来, 称质量, 对照组和实验组肿瘤质量分别为0.055±0.03 g和0.02±0.01 g, 两者相比有显著性差异(P<0.05). 与对照组相比, 实验组肿瘤生长缓慢, 肿瘤体积较小.
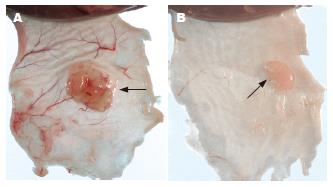
接种后第12天观察肿瘤周围新生血管. 结果如图4所示, 对照组裸鼠肿瘤呈鲜红色, 周围血管丰富, 血管分支较密集, 并从瘤体边缘向瘤体内伸展, 瘤体内可见明显的微小血管网. 实验组裸鼠肿瘤呈淡粉色, 周围血管较少, 血管分支稀疏, 少有达到瘤体边缘, 瘤体内仅见少量细小血管, 无明显可见的微小血管网.
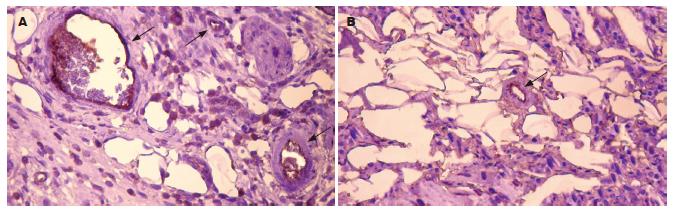
通过VWF免疫组织化学染色进一步显示肿瘤组织内微血管(图5), VWF特异性表达于呈线性排列的血管内皮细胞胞质中, 呈弥漫性棕黄色(图中箭头所示). 肿瘤组织内微血管主要分布于肿瘤间质中. 在相同大小的视野下, 对照组血管密度较高, 而实验组血管密度较低, 结果与图4一致. 进一步通过统计学分析, 对照组微血管密度值为3.2±0.83, 实验组微血管密度值为1.2±0.44, 两者相比具有显著性差异(P<0.05). 上述结果提示海水能够抑制血管生成.
血管生成(angiogenesis)是指从已存在的血管中以萌芽的方式形成新生血管的过程. 他是许多生理和病理过程, 包括胚胎发育, 创伤愈合, 组织再生和肿瘤生长所必需的基本步骤[11-12]. 该过程受到促血管生成因子(如VEGF, 碱性成纤维细胞生长因子等)和抗血管生成因子(如TSP-1, 纤溶酶原活化抑制剂-1等)之间严格平衡的调节, 并包含多种细胞协同参与的一系列级联事件[13-15]. 已有的研究表明, 在血管生成过程中, 血管内皮细胞是最重要的细胞, 通过分泌多种酶、黏附分子、促/抗血管生成因子, 定向迁移和增殖等作用参与了血管生成的全过程. 其中, 血管内皮细胞脱离基底膜, 向促血管生成因子迁移被认为是新生血管形成的始动环节[16-17].
本研究首先用观察细胞迁移和生物学功能的经典方法划痕创伤愈合修复分析[6], 观察了海水浸泡对血管内皮细胞迁移的影响.通过ECV304细胞划痕创伤模型, 观察并比较了生理盐水浸泡和海水浸泡对ECV304细胞形态和划痕创伤愈合功能的影响. 结果显示, 生理盐水处理后细胞形态无明显改变, 或仅发生轻微改变, 更换正常培养基后短期内形态即可恢复正常; 而细胞经海水处理后, 细胞形态皱缩, 细胞间隙增大, 呈"脱水"样改变, 并随着浸泡时间延长而加剧, 更换正常培养基后细胞形态恢复时间显著延长. 提示, 海水高钠、高渗导致ECV304细胞脱水, 细胞内液大量丢失, 细胞结构受损, 并且随着浸泡时间延长, 受损程度逐渐加重, 并且更换正常培养基后恢复时间也相应延长. 而细胞经等渗生理盐水浸泡, 细胞形态虽然也发生一些轻微变化, 可能只是细胞在无营养状态下的一种自我保护形式, 细胞受损不严重, 因此在更换正常培养基后, 细胞迅速恢复正常形态[18-19]. 观察细胞划痕愈合实验, 在划痕后17 h, 对照组划痕已基本愈合, 而实验组仍可见清晰划痕, 并且以实验4 h组划痕尤为明显. 提示, 海水浸泡使ECV304细胞结构的改变导致了细胞功能障碍, 表现在细胞迁移能力降低, 细胞划痕愈合明显延迟. 推测其原因, 可能由于高渗海水导致细胞内液大量丢失, 细胞核和线粒体、高尔基体等重要细胞器结构受损, 细胞能量代谢和蛋白质合成障碍, 并且随着浸泡时间延长损伤程度逐渐加重[20-23]. 在更换正常培养基后, 细胞功能短期内不能完全恢复, 因此细胞运动能力降低, 划痕愈合延迟, 并且延迟程度与细胞浸泡时间呈正相关.
进一步借助裸鼠皮下移植瘤模型, 观察海水浸泡对血管生成的影响[24]. 结果显示, 对照组肿瘤边缘新生血管较丰富, 瘤体内微血管密度值为3.2±0.83, 而实验组肿瘤边缘新生血管较少, 瘤体内微血管密度值为1.2±0.44, 两者具有显著性差异(P<0.05). 与对照组相比, 实验组肿瘤生长缓慢, 肿瘤体积较小. 提示海水浸泡能够抑制血管生成, 而肿瘤血管生成是维持肿瘤血供、促进肿瘤生长的必要条件[25]. 该结果进一步验证了我们前期有关海水对大鼠肠系膜血管内皮功能基因表达影响的研究, 提示海水浸泡可以影响血管生成相关基因的表达[4]. 也与宁浩勇 et al的研究结果一致, 即创伤合并海水浸泡后, 修复细胞功能受损, 伤口血管化程度降低, 伤口愈合时间明显延迟[3].
已知血管生成是创伤愈合过程中的必需步骤, 该过程受到促血管生成因子和抗血管生成因子间严格的调节. 在前期的工作中, 我们发现海水浸泡引起VEGF、TSP-1、MMP-9等一系列重要的促/抗血管生成基因的表达改变. 本研究通过功能性实验进一步证实了海水浸泡能够抑制体内血管生成, 而这可能是其延缓伤口愈合的重要原因之一. 同时, 在创伤愈合中, 血管内皮细胞作为重要的修复细胞, 参与了血管生成的全过程[26-28], 尤其是内皮细胞脱离基底膜、向促血管生成因子迁移的过程被认为是新生血管形成的始动环节. 因此, 海水浸泡能够抑制血管内皮细胞迁移, 可能是其抑制血管生成的原因之一.
此外, 血管内皮细胞作为血液与组织间代谢交换的重要屏障, 还具有重要的内分泌功能, 参与维持血流动力学平衡、形成抗血栓表面以及免疫与炎症反应等重要病理生理活动[29-30]. 我们在研究中发现, 海水浸泡能够导致血管内皮细胞损伤, 不仅体现在细胞结构的破坏, 而且还能广泛引起内皮细胞重要功能基因的表达改变. 因此, 除了血管生成以外, 包括凝血、炎症反应在内的由血管内皮细胞参与的多种病理生理过程均可能发生障碍, 而这都将加重创伤的病理过程, 导致伤口愈合延缓[31-32].
总之, 本研究的结果表明, 海水浸泡能够降低血管内皮细胞迁移能力, 并抑制血管生成.
在前期研究中, 借助于实时定量PCR芯片技术, 我们发现海水浸泡能够广泛引起血管内皮细胞重要功能基因的差异表达, 包括细胞运动、血管生成在内的由血管内皮细胞参与的多种病理生理过程可能发生障碍. 因此, 本文拟从功能验证的角度, 着重观察海水浸泡对血管内皮细胞迁移和血管生成功能的影响.
汪思应, 教授, 安徽医科大学实验动物中心.
血管内皮细胞迁移和血管生成是创伤愈合过程中的关键步骤, 通过观察海水浸泡的影响, 有助于阐明海水浸泡延缓创伤愈合的可能机制, 为探讨海水致伤机制、制定科学救治原则提供实验依据.
宁浩勇 et al在海水浸泡对伤口愈合时间影响的动物实验中也发现, 创伤合并海水浸泡后, 血管内皮细胞、成纤维细胞等修复细胞功能受损, 伤口血管化程度降低, 肉芽组织成熟缓慢, 伤口愈合时间明显延迟. 该研究与本文的结果具有一致性.
本课题组在前期的研究中, 通过血管内皮功能相关基因实时定量PCR芯片分析, 发现海水浸泡能够导致一系列与细胞运动、血管生成相关基因的表达改变. 因此, 本研究在此基础上, 通过内皮细胞功能实验, 进一步观察海水浸泡对血管内皮迁移和血管生成的影响. 从基因表达水平及其功能分析两方面, 为认识海水致伤分子机制提供了实验依据.
认识海水致伤分子机制, 为制定海难或战伤落水伤员的救治原则提供科学依据.
本研究选题新颖, 设计合理, 具有较好的实际应用价值.
编辑: 李军亮 电编:吴鹏朕
| 3. | 宁 浩勇, 孟 宇宏, 王 大鹏, 刘 肖, 杨 兴东, 尚 立群, 姜 涛, 虞 积耀. 海水浸泡对伤口愈合时间影响的动物实验观察. 中华航海医学与高气压医学杂志. 2008;15:82-84. |
| 5. | Wang Q, Xu Y, Zhao X, Chang Y, Liu Y, Jiang L, Sharma J, Seo DK, Yan H. A facile one-step in situ functionalization of quantum dots with preserved photoluminescence for bioconjugation. J Am Chem Soc. 2007;129:6380-6381. [PubMed] [DOI] |
| 6. | Liang XJ, Choi Y, Sackett DL, Park JK. Nitrosoureas inhibit the stathmin-mediated migration and invasion of malignant glioma cells. Cancer Res. 2008;68:5267-5272. [PubMed] [DOI] |
| 7. | Bindschadler M, McGrath JL. Sheet migration by wounded monolayers as an emergent property of single-cell dynamics. J Cell Sci. 2007;120:876-884. [PubMed] [DOI] |
| 8. | Bahramsoltani M, Plendl J, Janczyk P, Custodis P, Kaessmeyer S. Quantitation of angiogenesis and antiangiogenesis in vivo, ex vivo and in vitro - an overview. ALTEX. 2009;26:95-107. [PubMed] |
| 9. | Weidner N. Intratumor microvessel density as a prognostic factor in cancer. Am J Pathol. 1995;147:9-19. [PubMed] |
| 10. | Staton CA, Reed MW, Brown NJ. A critical analysis of current in vitro and in vivo angiogenesis assays. Int J Exp Pathol. 2009;90:195-221. [PubMed] |
| 11. | Carmeliet P. Angiogenesis in life, disease and medicine. Nature. 2005;438:932-936. [PubMed] [DOI] |
| 12. | Chan LK. Current thoughts on angiogenesis. J Wound Care. 2009;18:12-14, 16. [PubMed] |
| 13. | Byrne AM, Bouchier-Hayes DJ, Harmey JH. Angiogenic and cell survival functions of vascular endothelial growth factor (VEGF). J Cell Mol Med. 2005;9:777-794. [PubMed] [DOI] |
| 14. | Gill SE, Parks WC. Metalloproteinases and their inhibitors: regulators of wound healing. Int J Biochem Cell Biol. 2008;40:1334-1347. [PubMed] [DOI] |
| 15. | Krady MM, Zeng J, Yu J, MacLauchlan S, Skokos EA, Tian W, Bornstein P, Sessa WC, Kyriakides TR. Thrombospondin-2 modulates extracellular matrix remodeling during physiological angiogenesis. Am J Pathol. 2008;173:879-891. [PubMed] [DOI] |
| 16. | Muñoz-Chápuli R, Quesada AR, Angel Medina M. Angiogenesis and signal transduction in endothelial cells. Cell Mol Life Sci. 2004;61:2224-2243. [PubMed] |
| 17. | Lamalice L, Le Boeuf F, Huot J. Endothelial cell migration during angiogenesis. Circ Res. 2007;100:782-794. [PubMed] [DOI] |
| 18. | Zhang A, Xu LX, Sandison GA, Cheng S. Morphological study of endothelial cells during freezing. Phys Med Biol. 2006;51:6047-6060. [PubMed] [DOI] |
| 19. | Parolari A, Sala R, Antona C, Bussolati O, Alamanni F, Mezzadri P, Dall'Asta V, Gazzola GC, Biglioli P. Hypertonicity induces injury to cultured human endothelium: attenuation by glutamine. Ann Thorac Surg. 1997;64:1770-1775. [PubMed] [DOI] |
| 20. | Malek AM, Xu C, Kim ES, Alper SL. Hypertonicity triggers RhoA-dependent assembly of myosin-containing striated polygonal actin networks in endothelial cells. Am J Physiol Cell Physiol. 2007;292:C1645-C1659. [PubMed] [DOI] |
| 21. | Chen L, Wu Q, Guo F, Xia B, Zuo J. Expression of Dishevelled-1 in wound healing after acute myocardial infarction: possible involvement in myofibroblast proliferation and migration. J Cell Mol Med. 2004;8:257-264. [PubMed] [DOI] |
| 22. | Real C, Caiado F, Dias S. Endothelial progenitors in vascular repair and angiogenesis: how many are needed and what to do? Cardiovasc Hematol Disord Drug Targets. 2008;8:185-193. [PubMed] [DOI] |
| 23. | Yan H, Lai XN, Ge HJ. Comparative study on effects of burn-blast combined injury and burn-firearm combined injury complicated with seawater immersion on vascular endothelial cells. Chin J Traumatol. 2005;8:147-150. [PubMed] |
| 24. | 陈 坚, 钟 良, 钱 立平, 蒋 蔚茹, 黄 剑平, 秋 冬妮. 丹参酮ⅡA磺酸钠对MKN-45胃癌裸鼠移植瘤增殖及血管生成的影响. 世界华人消化杂志. 2008;16:2507-2511. [DOI] |
| 25. | Folkman J. Role of angiogenesis in tumor growth and metastasis. Semin Oncol. 2002;29:15-18. [PubMed] |
| 26. | Tamura K, Hashimoto K, Suzuki K, Yoshie M, Kutsukake M, Sakurai T. Insulin-like growth factor binding protein-7 (IGFBP7) blocks vascular endothelial cell growth factor (VEGF)-induced angiogenesis in human vascular endothelial cells. Eur J Pharmacol. 2009;610:61-67. [PubMed] [DOI] |
| 27. | Xueyong L, Shaozong C, Wangzhou L, Yuejun L, Xiaoxing L, Jing L, Yanli W, Jinqing L. Differentiation of the pericyte in wound healing: The precursor, the process, and the role of the vascular endothelial cell. Wound Repair Regen. 2008;16:346-355. [PubMed] [DOI] |
| 28. | Lee JG, Kay EP. FGF-2-induced wound healing in corneal endothelial cells requires Cdc42 activation and Rho inactivation through the phosphatidylinositol 3-kinase pathway. Invest Ophthalmol Vis Sci. 2006;47:1376-1386. [PubMed] [DOI] |
| 29. | Suzuki Y, Mogami H, Ihara H, Urano T. Unique secretory dynamics of tissue plasminogen activator and its modulation by plasminogen activator inhibitor-1 in vascular endothelial cells. Blood. 2009;113:470-478. [PubMed] [DOI] |
| 30. | Ma L, Francia G, Viloria-Petit A, Hicklin DJ, du Manoir J, Rak J, Kerbel RS. In vitro procoagulant activity induced in endothelial cells by chemotherapy and antiangiogenic drug combinations: modulation by lower-dose chemotherapy. Cancer Res. 2005;65:5365-5373. [PubMed] [DOI] |
| 31. | Fan ZF, Wang JH, Li ZQ, Yi CH. [Influence of sea water immersion on inflammation and healing of the wounds in scalded rats]. Zhonghua Shaoshang Zazhi. 2006;22:215-217. [PubMed] |
| 32. | Wang Y, Lu E, Yu J, Li H, Wang D, Zhou Z. [Hemodynamic and pathologic changes in open abdominal wound after seawater immersion in dog]. Zhonghua Waike Zazhi. 2000;38:700-702. [PubMed] |