修回日期: 2009-06-24
接受日期: 2009-06-29
在线出版日期: 2009-07-28
目的: 观察促肝再生磷酸酶-3(phosphatase of regeneration liver-3, PRL-3)抑制剂原钒酸钠(sodium orthovanadate, SoV)对大肠癌细胞株Colo-320迁移能力的影响.
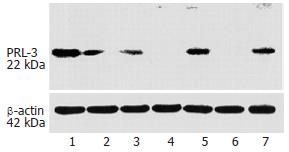
方法: 应用Western blot方法检测PRL-3在7株大肠癌细胞中的表达, 筛选表达最强的1株做下一步抑制实验. 选择PRL-3拮抗剂SoV, 通过细胞划痕实验观察其在0.5 µmol/L浓度下对癌细胞运动能力的影响, 高倍倒置显微镜下计算细胞迁移距离. 细胞爬片原位杂交观察SoV对PRL-3 mRNA的表达.
结果: PRL-3表达最强的结肠癌细胞株为Colo-320. 细胞划痕实验显示, SoV作用48 h细胞仅迁移相当于4-7个细胞的距离, 400×倍镜下精确测量20个细胞在0-48 h迁移距离, 计算对照组细胞迁移速度为39.12±10.11 μm/h, SoV为12.84±6.78 μm/h, 差异非常显著(P<0.00001). SoV作用细胞48 h后原位杂交结果未见PRL-3 mRNA阳性表达.
结论: SoV能显著抑制Colo-320细胞迁移能力, 其机制可能与抑制PRL-3酶活性以及基因转录有关.
引文著录: 赵高平, 周总光, 郑雪莲. 抑制促肝再生磷酸酶-3对大肠癌细胞迁移能力的影响. 世界华人消化杂志 2009; 17(21): 2147-2151
Revised: June 24, 2009
Accepted: June 29, 2009
Published online: July 28, 2009
AIM: To investigate the effect of sodium orthovanadate (SoV), an inhibitor of phosphatase of regeneration liver-3 (PRL-3), on the migration of Colo-320 colon cancer cells.
METHODS: The expression levels of PRL-3 protein in seven colorectal cancer cell lines were examined by Western blot to screen the line with the highest expression of PRL-3 protein. The screened cell line was employed in subsequent drug intervention experiments. A scratch wound assay was performed to examine the effect of SoV (at a dose of 0.5 μmol/L) on the migration of Colo-320 cells. The migration distance of cells was determined under an inverted microscope. The expression of PRL-3 mRNA in cells treated with SoV was detected by in situ hybridization.
RESULTS: Western blot analysis indicated that the colon cancer cell line Colo-320 had the highest expression level of PRL-3. The scratch wound assay showed that the migration distance of Colo-320 cells treated with SoV for 48 hours was significantly lower than that of control cells. The migration rate of SoV-treated cells was also significantly lower than that of control cells (2.84 ± 6.78 μm/h vs 39.12 ± 10.11 μm/h, P < 0.00001). In situ hybridization analysis showed that PRL-3 mRNA was highly expressed in control cells but not in SoV-treated cells.
CONCLUSION: SoV can effectively inhibit the migration of Colo-320 cells perhaps through downregulation of PRL-3 mRNA expression and suppression of PRL-3 catalytic activity.
- Citation: Zhao GP, Zhou ZG, Zheng XL. Inhibition of phosphatase of regeneration liver-3 suppresses the migration of Colo-320 colon cancer cells. Shijie Huaren Xiaohua Zazhi 2009; 17(21): 2147-2151
- URL: https://www.wjgnet.com/1009-3079/full/v17/i21/2147.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i21.2147
细胞的生长、分化、转化等过程受酪氨酸的磷酸化/脱磷酸化组成的信号传导网络调控[1-3]. 蛋白酪氨酸磷酸酶(protein tyrosine phosphatases, PTPs)在酪氨酸的脱磷酸化过程中扮演着重要角色. 如果这种平衡遭到破坏, 最终会引起人类包括癌症和糖尿病在内的多种疾病[4-5]. PRL-3作为小分子PTP, 其COOH-端有一个特殊的异戊二烯基化结构域单元, 这种独一无二的结构赋予细胞以特殊功能[6-7]. 虽然体内外实验已表明PRL-3能促进细胞生长、浸润、迁移以及癌性转移[7-13], 但以PRL-3为靶点, 采用拮抗剂抑制其活性, 观察拮抗剂对肿瘤的生长和转移的影响, 目前尚未见报道. SoV即原钒酸钠(sodium orthovanadate), 为PRL-3相对特异性抑制剂. 已有研究显示, SoV能有效地抑制PTPs酶的活性区域[14]. 本论文观察SoV在体外对表达PRL-3的结肠癌细胞株Colo-320细胞迁移能力的影响, 旨在为将来可能将SoV应用于临床提供实验依据.
7株人大肠癌细胞株, 即LoVo、CaCo- 2、SW620、Ls-174t、Colo-320、HRC-99、HRC-101. LoVo和Ls-174t细胞株购自中国科学院上海细胞库, CaCo-2、SW620、Colo-320为四川大学华西医学中心保存培养, HRC-99、HRC-101为四川大学华西医院消化外科研究室原代培养至50代. HRC-99取自46岁女性中-低分化直肠癌患者, Duke's C期; HRC-101取自54岁男性中分化直肠癌患者, Duke's B期. 上述细胞均用含10%新生牛血清、100 kU/L青霉素、100 µg/L链霉素和0.01 mol/L HEPES的RPMI 1640培养基, 在37℃、饱和湿度及50 mL/L CO2条件下传代培养.
1.2.1 Western blot法检测7株癌细胞PRL-3蛋白表达: 将冻存的7株细胞株迅速解冻, 洗涤后离心培养, 直至细胞呈对数生长. 分别提取总蛋白质, 制作标准蛋白曲线, 测定蛋白浓度, 按总蛋白量60 µg上样行SDS-PAGE电泳分析, 一抗为 1:1000兔抗人PRL-3(美国Zymed公司), 二抗为1:1000的辣根过氧化物酶连接的羊抗兔IgG, 选β-actin做内对照. 用化学发光试剂盒(美国Sigma公司)在PVDF膜上显示条带, 根据PRL-3蛋白量/β-actin蛋白量比值来比较7株癌细胞PRL-3差异性表达.
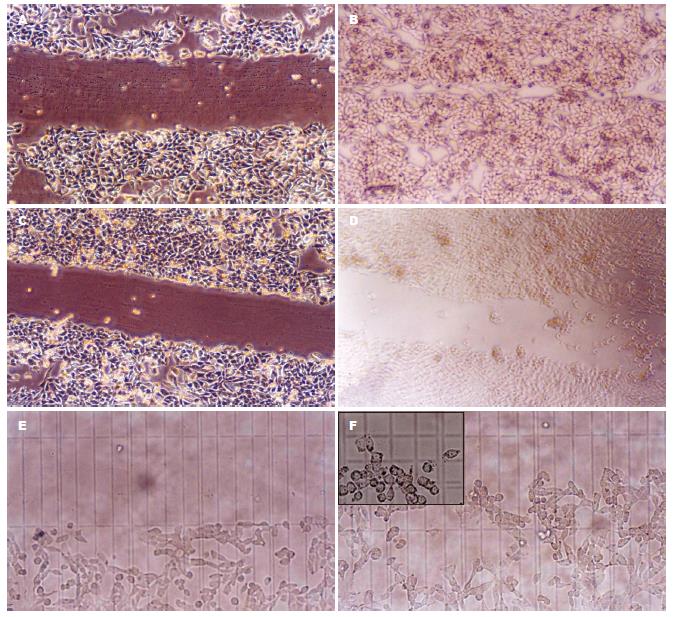
1.2.2 细胞划痕实验(wound-healing assay)测定细胞迁移能力: 通过上述Western blot方法筛选出PRL-3高表达细胞株Colo-320, 胰蛋白酶消化后配制成单细胞悬液. 取2张盖玻片清洗消毒后放入6孔板的2个孔中, 取含1×108个/L Colo-320细胞的完全培养基1 mL滴入这2个孔中, 并完全浸没盖玻片, 放入CO2恒温孵箱中培养, 隔日换培养液, 直到玻片上几乎爬满单层细胞. 用微量吸液管头在2张玻片上表面正中各划一条直线痕迹, 用温PBS冲洗掉脱落细胞, 倒置显微镜下照相(Olympus公司, IX-40型). 该实验需用血细胞计数台镜下观察和计算Colo-320细胞在药物干预下移动距离. 同盖玻片清洗消毒方法, 准备2块血细胞计数台, 将3张玻片小心分别放在血细胞计数台上, 注意上表面朝上. 镜下调整玻片位置, 使细胞划痕线与血细胞计数台中某一刻度直线重叠, 作为药物干预前的位置标志. 用树脂将玻片黏合在血细胞计数台上, 保证位置不会在转运过程中移动, 然后一起放入较大培养皿中(已消毒). 在玻片上滴加含0.5 μmol/L SoV(Sigma公司)完全培养液, 浸满整个玻片上表面. 设另一张玻片为对照组, 只加完全培养基. 放入CO2恒温孵箱中培养48 h, 期间每隔6 h观察同一视野一次并拍照(100×、200×和400×各1张), 每隔12 h换培养基或含药物的培养基1次. 以上步骤重复3次.
1.2.3 高倍倒置显微镜下计算细胞迁移距离: 细胞孵育48 h后, 照相记录观察视野中细胞的最终位置. 血细胞计数台中心计数线最小正方形边距为1/4 mm, 边缘计数线最小长方形长为1/4×5 mm. 在400×倍镜下测出20个细胞(从0-48 h间断观察相同的细胞)向划痕中心直线移动的距离, 统计学分析对照组和实验组各20个细胞移动距离有无差异.
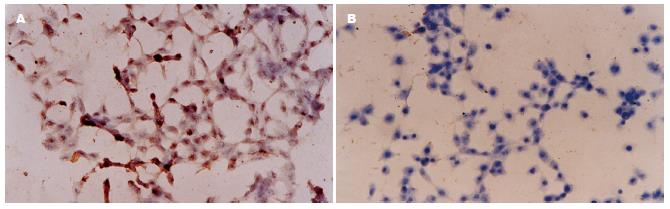
1.2.4 细胞爬片原位杂交观察SoV对PRL-3 mRNA的表达影响: 普通血盖片打底及消毒后制作对照组和实验组细胞爬片. 待细胞贴片后, 换液加入含0.5 μmol/L SoV完全培养液, 对照组不加药. 继续培养48 h后用含40 g/L多聚甲醛的固定液4℃固定10 min. 杂交前按酒精梯度脱水及脱酒精到水. 盖玻片上滴加30 g/L柠檬酸新鲜稀释的胃蛋白酶, 37℃通透细胞片20 min, 后再用固定液室温下固定10 min, 蒸馏水洗3次. 按每张细胞片20 μL加预杂交液, 38℃孵育2-4 h. 在杂交前将地高辛标记的cDNA探针(探针序列为5'-ccacatcgccttttcctccccgacacctccgtgcacttg-3', 上海生能博彩生物技术有限公司)在80℃短暂复性, 然后加入杂交液20 μL, 其浓度为5 μg/L. 恒温箱38℃-42℃杂交过夜. 杂交后在37℃下用不同浓度的SSC洗涤, 共4次. 最后显色阶段分别滴加封闭液, 生物素化鼠抗地高辛抗体, SABC及生物素化过氧化物酶, 水洗后酒精脱水, 二甲苯透明, 封片.
统计学处理 数据以mean±SD表示, 采用t检验方法, 用SPSS10.0统计软件分析.
Western blot检测结果如图1所示, PRL-3蛋白在Ls-174t、Colo-320、SW620、HRC-99、HRC-101细胞株中可见表达, 其中Ls-174t、Colo-320和HRC-99表达最强, SW620和HRC-101细胞表达次之. 另两株细胞LoVo、CaCo-2未见PRL-3蛋白表达. Ls-174t细胞株在培养皿中悬浮生长, 不利于观察; HRC-99原代培养细胞还未建立稳定细胞株系; Colo-320细胞贴壁生长, 且形态较好, 所以我们选择其作为下一步干预实验的研究对象. }
48 h后, 对照组细胞几乎铺满了划痕区域, 而SoV组细胞仅仅迁移了相当于4-7个细胞的距离, 细胞迁移速度远远低于对照组(图2A-D), 细胞的运动能力显著受抑制. 在400×倍镜下精确测量20个细胞在0 h到48 h间迁移距离, 计算对照组细胞迁移速度为39.12±10.11 μm/h, SoV为12.84±6.78 μm/h, 两组细胞迁移速度有非常显著差异(P<0.00001, 图2E-F).
2.3 细胞形态及PRL-3 mRNA的表达变化
倒置显微镜下观察细胞形态, 对照组Colo-320细胞接种贴壁48 h进入指数生长期后, 细胞表现为高折光性, 呈长条梭形, 细胞相互紧密嵌合. 原位杂交结果显示PRL-3 mRNA在胞质中强表达, 有些细胞还可看到胞核表达; SoV处理细胞48 h后可见明显的细胞损伤现象, 部分细胞表现为外形皱缩、变小变圆, 折光度下降, 细胞集落小且散在. 原位杂交结果未见PRL-3 mRNA阳性表达(图3).
钒属于化学元素周期表中VB族的过渡元素, 广泛存在于自然界中, 参与人体许多不同的生理过程, 如细胞的生长和分化、糖类及脂类的代谢等[15]. SoV是金属钒化合物, 最初研究发现, SoV作用于糖尿病模型大鼠后产生明显的胰岛素样效应, 表现为血糖下降、糖原合成增强、糖脂代谢趋于平衡[16-19]. 其原因可能与SoV抑制Na+-K+-ATP酶活性有关. 目前钒盐作为降血糖药物, 其口服制剂已完成临床Ⅰ期试验, 进入Ⅱ期试验阶段[20-21].
随着研究地深入, 人们发现SoV还可以通过改变酪氨酸磷酸酶功能区结构, 从而抑制酶的活性. 核磁共振显示[22-23], PRL-3酶活性中心在结合状态下是非常稳定的. 在未与底物或抑制剂结合之前, 位于β5和α4之间的磷酸盐结合环由于缺乏张力而不能很好地聚合, 这一区域核磁共振检测信号就很弱或无法检测. 在加入SoV后, 由于离子从自由状态向结合状态转换, 活性位点环状区域检测到新的信号, 表明这些离子状态的底物通过配体与PRL-3结合, 使后者酶活性区域结构达到稳态.
为了解SoV对肿瘤细胞运动能力的影响, 我们设计了Colo-320细胞爬片划痕实验. 正如结果所示, 48 h后对照组细胞几乎铺满了划痕区域, 而SoV组细胞仅仅迁移了相当于4-7个细胞的距离, 迁移速度远远低于对照组(P<0.00001). Zeng et al[8]观察到PRL-3主要聚集在细胞膜表面, 尤其是细胞膜的褶边、突起以及空泡样延伸部分, 此外还可见于胞内肌动蛋白纤维上, 而这些结构在细胞的运动和浸润过程中起着重要的作用[24-27]. 由此推断, SoV通过对PRL-3酶活性抑制, 可能是遏制结肠癌细胞Colo-320运动能力的主要原因.
正常培养状态下Colo-320细胞表现为高折光性, 呈长条梭形, 细胞相互紧密嵌合细胞, ISH结果显示, PRL-3 mRNA在胞质中呈现强表达, 有些细胞还可看到胞核表达. SoV(0.5 µmol/L)处理细胞48 h后可见明显的细胞损伤现象, 部分细胞表现为外形皱缩、变小变圆, 折光度下降, 细胞集落小且散在. SoV作用细胞48 h后ISH未见PRL-3 mRNA阳性表达, 此结果提示SoV在转录水平抑制PRL-3 mRNA的表达. 这一发现很有意义, 因为之前的报道均仅述及SoV在蛋白水平抑制PRL-3酶活性. 药物影响基因表达的机制很复杂, 如调控离子流动、与染色体结合影响转录、调节受体传导通路等. SoV抑制PRL-3 mRNA表达可能也是抑制Colo-320癌细胞迁移能力的原因之一.
总之, 针对PRL-3能促进细胞生长增殖, 提高细胞迁移和浸润能力的特点, 我们应用PRL-3抑制剂SoV进行干预Colo-320细胞对PRL-3的表达, 观察到由此产生的对结肠癌细胞运动能力强烈的抑制效应, 同时提示PRL-3基因转录和酶活性受SoV双重抑制的作用机制. 本实验为将来可能将SoV应用于临床提供实验依据.
促肝再生磷酸酶-3(PRL-3)又称为PTP4A3, 属于一类新型小分子蛋白酪氨酸磷酸酶. 其最显著的特征是在COOH-端有独一无二的异戊二烯基化结构域单元, 与细胞内膜的蛋白定向和蛋白间相互作用关系密切. 最早发现该基因与结直肠癌肝转移有关, 随后研究表明该基因还在胃癌, 肺癌, 乳腺癌, 卵巢癌, 黑色素瘤等肿瘤的发生、发展及晚期转移过程中扮演重要角色.
戴冬秋, 教授, 中国医科大学附属第一医院肿瘤外科; 吴泰璜, 教授,山东省立医院肝胆外科.
结直肠癌转移是影响患者预后的最主要因素. PRL-3在肝转移灶中持续、稳定、高表达, 是药物作用的理想靶点. 围绕该靶点从不同角度研究和开发药物, 将会是该领域今后发展的方向和重点.
研究显示, PRL-3的表达与多种恶性肿瘤的淋巴管浸润、淋巴结转移和肿瘤分期有关, 是预测胃癌进展的一个新的分子标志物, 是结直肠癌肝转移唯一的独立预测因素. Kaplan-Meier生存曲线表明, PRL-3表达组患者预后要比PRL-3(-)组好, PRL-3表达程度与生存时间呈负相关..
本文以PRL-3为靶点, 采用其相对特异性拮抗剂SoV抑制其活性, 观察其对结肠癌细胞迁移能力的影响, 同时提示PRL-3基因转录和酶活性受SoV双重抑制的作用机制, 目前尚未见报道.
本文观察到SoV作用结肠癌细胞后对细胞运动能力产生强烈的抑制效应, 结合本课题组过去的研究报道, 即SoV还对大肠癌细胞的增殖有抑制作用. 这些研究工作为将来可能将SoV应用于临床提供实验依据.
本研究立意新颖, 方法得当, 分析合理, 研究有一定意义.
编辑: 李军亮 电编:何基才
| 2. | Tonks NK, Neel BG. From form to function: signaling by protein tyrosine phosphatases. Cell. 1996;87:365-368. [PubMed] [DOI] |
| 3. | Denu JM, Stuckey JA, Saper MA, Dixon JE. Form and function in protein dephosphorylation. Cell. 1996;87:361-364. [PubMed] [DOI] |
| 4. | Streuli M. Protein tyrosine phosphatases in signaling. Curr Opin Cell Biol. 1996;8:182-188. [PubMed] [DOI] |
| 5. | Zhang ZY. Mechanistic studies on protein tyrosine phosphatases. Prog Nucleic Acid Res Mol Biol. 2003;73:171-220. [PubMed] [DOI] |
| 6. | Brown MS, Goldstein JL. Protein prenylation. Mad bet for Rab. Nature. 1993;366:14-15. [PubMed] [DOI] |
| 7. | Zeng Q, Si X, Horstmann H, Xu Y, Hong W, Pallen CJ. Prenylation-dependent association of protein-tyrosine phosphatases PRL-1, -2, and -3 with the plasma membrane and the early endosome. J Biol Chem. 2000;275:21444-21452. [PubMed] [DOI] |
| 8. | Zeng Q, Dong JM, Guo K, Li J, Tan HX, Koh V, Pallen CJ, Manser E, Hong W. PRL-3 and PRL-1 promote cell migration, invasion, and metastasis. Cancer Res. 2003;63:2716-2722. [PubMed] |
| 9. | Matter WF, Estridge T, Zhang C, Belagaje R, Stancato L, Dixon J, Johnson B, Bloem L, Pickard T, Donaghue M. Role of PRL-3, a human muscle-specific tyrosine phosphatase, in angiotensin-II signaling. Biochem Biophys Res Commun. 2001;283:1061-1068. [PubMed] [DOI] |
| 10. | Werner SR, Lee PA, DeCamp MW, Crowell DN, Randall SK, Crowell PL. Enhanced cell cycle progression and down regulation of p21(Cip1/Waf1) by PRL tyrosine phosphatases. Cancer Lett. 2003;202:201-211. [PubMed] [DOI] |
| 11. | Wu X, Zeng H, Zhang X, Zhao Y, Sha H, Ge X, Zhang M, Gao X, Xu Q. Phosphatase of regenerating liver-3 promotes motility and metastasis of mouse melanoma cells. Am J Pathol. 2004;164:2039-2054. [PubMed] |
| 12. | Kato H, Semba S, Miskad UA, Seo Y, Kasuga M, Yokozaki H. High expression of PRL-3 promotes cancer cell motility and liver metastasis in human colorectal cancer: a predictive molecular marker of metachronous liver and lung metastases. Clin Cancer Res. 2004;10:7318-7328. [PubMed] [DOI] |
| 13. | Guo K, Li J, Tang JP, Koh V, Gan BQ, Zeng Q. Catalytic domain of PRL-3 plays an essential role in tumor metastasis: formation of PRL-3 tumors inside the blood vessels. Cancer Biol Ther. 2004;3:945-951. [PubMed] |
| 14. | Pelassy C, Breittmayer JP, Aussel C. Inhibition of phosphatidylserine synthesis during Jurkat T cell activation. The phosphatase inhibitor, sodium ortho-vanadate bypasses the CD3/T cell receptor-induced second messenger signaling pathway. Eur J Biochem. 2000;267:984-992. [PubMed] [DOI] |
| 15. | Stern A, Yin X, Tsang SS, Davison A, Moon J. Vanadium as a modulator of cellular regulatory cascades and oncogene expression. Biochem Cell Biol. 1993;71:103-112. [PubMed] |
| 16. | Cortizo AM, Caporossi M, Lettieri G, Etcheverry SB. Vanadate-induced nitric oxide production: role in osteoblast growth and differentiation. Eur J Pharmacol. 2000;400:279-285. [PubMed] [DOI] |
| 17. | Brichard SM, Henquin JC. The role of vanadium in the management of diabetes. Trends Pharmacol Sci. 1995;16:265-270. [PubMed] [DOI] |
| 18. | Shafrir E, Spielman S, Nachliel I, Khamaisi M, Bar-On H, Ziv E. Treatment of diabetes with vanadium salts: general overview and amelioration of nutritionally induced diabetes in the Psammomys obesus gerbil. Diabetes Metab Res Rev. 2001;17:55-66. [PubMed] [DOI] |
| 19. | Thompson KH, Leichter J, McNeill JH. Studies of vanadyl sulfate as a glucose-lowering agent in STZ-diabetic rats. Biochem Biophys Res Commun. 1993;197:1549-1555. [PubMed] [DOI] |
| 20. | Thompson KH, Orvig C. Vanadium in diabetes: 100 years from Phase 0 to Phase I. J Inorg Biochem. 2006;100:1925-1935. [PubMed] [DOI] |
| 21. | Thompson KH, Lichter J, LeBel C, Scaife MC, McNeill JH, Orvig C. Vanadium treatment of type 2 diabetes: a view to the future. J Inorg Biochem. 2009;103:554-558. [PubMed] [DOI] |
| 22. | Kozlov G, Cheng J, Ziomek E, Banville D, Gehring K, Ekiel I. Structural insights into molecular function of the metastasis-associated phosphatase PRL-3. J Biol Chem. 2004;279:11882-11889. [PubMed] [DOI] |
| 23. | Kozlov G, Cheng J, Lievre C, Banville D, Gehring K, Ekiel I. 1H, 13C and 15N resonance assignments of the human phosphatase PRL-3. J Biomol NMR. 2002;24:169-170. [PubMed] [DOI] |
| 24. | Small JV, Stradal T, Vignal E, Rottner K. The lamellipodium: where motility begins. Trends Cell Biol. 2002;12:112-120. [PubMed] [DOI] |
| 25. | Mogilner A, Rubinstein B. The physics of filopodial protrusion. Biophys J. 2005;89:782-795. [PubMed] [DOI] |
| 26. | Atilgan E, Wirtz D, Sun SX. Mechanics and dynamics of actin-driven thin membrane protrusions. Biophys J. 2006;90:65-76. [PubMed] [DOI] |
| 27. | Le Clainche C, Carlier MF. Regulation of actin assembly associated with protrusion and adhesion in cell migration. Physiol Rev. 2008;88:489-513. [PubMed] [DOI] |