修回日期: 2009-07-01
接受日期: 2009-07-06
在线出版日期: 2009-07-28
目的: 观察c-Jun氨基末端激酶(c-jun-N-terminal kinase, JNK)信号通路的活化对大肠癌细胞运动、侵袭的影响, 并探讨大肠癌转移可能的分子机制.
方法: LoVo细胞无血清饥饿24 h同步化后, 对照组无纤维粘连蛋白(fibronectin, FN)干预, FN组给予FN 10, 20, 40 mg/L, 24 h干预. JNK抑制剂组给予FN 40 mg/L+SP600125(20, 40 μmol/L)干预24 h. 用Boyden小室法检测其体外运动和侵袭能力. Western blot法检测JNK磷酸化和MMP-9蛋白质表达.
结果: FN可剂量性增加LoVo细胞运动和侵袭细胞数, SP600125能明显减少FN诱导的细胞运动和侵袭力. 与对照组相比, FN 40 mg/L干预时p-JNK和MMP-9明显增高(38.39%±5.97% vs 28.61%±4.19%; 58.25%±6.53% vs 33.43%±2.05%, 均P<0.01). 与FN 40 mg/L组相比, SP600125 40 µmol/L能明显抑制p-JNK和MMP-9蛋白的表达(29.59%±2.17% vs 38.39%±5.97%, 36.69%±4.20% vs 58.25%±6.53%, 均P<0.01).
结论: 大肠癌细胞JNK磷酸化可激活其下游成员使大肠癌基质金属蛋白酶的分泌增加, 导致大肠癌细胞的运动和侵袭力增加, 最终促进癌细胞的转移.
引文著录: 周燕红, 何小飞, 高卉, 王瑶芬. JNK信号通路在大肠癌侵袭和转移中的作用及机制. 世界华人消化杂志 2009; 17(21): 2142-2146
Revised: July 1, 2009
Accepted: July 6, 2009
Published online: July 28, 2009
AIM: To investigate the effects of c-Jun-N-terminal kinase (JNK) signaling pathway on the migration and invasion of human colon cancer cells (LoVo) stimulated with fibronectin and explore possible mechanisms underlying such effects.
METHODS: LoVo cells were cultured in serum-free medium for 24 hours and then divided into normal control group (no fibronectin treatment), fibronectin treatment group (a 24-hour treatment with fibronectin at concentrations of 10, 20 and 40 mg/L, respectively), and SP600125 treatment group (a 24-hour treatment with 40 mg/L of fibronectin and SP600125 at concentrations of 20 and 40 µmol/L, respectively). The in vitro migration and invasion of LoVo cells were measured by Boyden chamber assay. The phosphorylation levels of JNK and matrix metalloproteinase-9 (MMP-9) were detected by Western blot.
RESULTS: Fibronectin significantly increased the migration and invasion of LoVo cells, while SP600125 showed an obvious inhibitory effect on migration and invasion. The expression of p-JNK and MMP-9 in the fibronectin (40 mg/L) treatment group was more significantly upregulated than that in normal control group (38.39% ± 5.97% vs 28.61% ± 4.19% and 58.25% ± 6.53% vs 33.43% ± 2.05%, respectively; both P < 0.01). The upregulation of p-JNK and MMP-9 expression in the SP600125 (40 µmol/L) treatment group was significantly lower than that in the fibronectin (40 mg/L) treatment group (29.59% ± 2.17% vs 38.39% ± 5.97% and 36.69% ± 4.20% vs 58.25% ± 6.53%, both P < 0.01).
CONCLUSION: Fibronectin can enhance the migration and invasion of human colon cancer cells perhaps through upregulation of p-JNK and MMP-9 expression.
- Citation: Zhou YH, He XF, Gao H, Wang YF. Mechanisms underlying the role of JNK signaling pathway in the invasion and metastasis of colon cancer cells. Shijie Huaren Xiaohua Zazhi 2009; 17(21): 2142-2146
- URL: https://www.wjgnet.com/1009-3079/full/v17/i21/2142.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i21.2142
大肠癌(colon cancer)是人类最常见的恶性肿瘤之一, 大肠癌转移是影响患者疗效和预后并导致死亡的重要因素. 肿瘤转移是多因素相互作用的结果, 已发现了很多导致肿瘤转移的生物学行为, 如细胞黏附(adhesion), 运动(migration)、侵袭(invasion)、血管生成(angiogenesis)以及生长(growth)等[1]. 不断研究和探讨其机制, 进一步认识肿瘤转移, 可为治疗肿瘤转移提供更可靠的理论依据.
c-Jun氨基末端激酶(c-jun-N-terminal kinase, JNK)/应激活化蛋白激酶(stress-activated protein kinase, SAPK)信号途径存在于多种生命过程中在细胞周期调节、细胞增殖和转化生长中具有重要作用. 近年来, 越来越多的研究表明JNK在肿瘤的发生发展中发挥重要作用[2-3], 从而使JNK在临床上可作为一个潜在的分子治疗靶点. 本研究中以纤维粘连蛋白(fibronectin, FN)作为细胞外基质(extracellular matrix, ECM)的主要成分诱导大肠癌细胞侵袭和运动, 探讨JNK作为整合素与FN结合的下游信号分子, 在大肠癌的转移中发挥的重要作用; 并探讨应用JNK抑制剂抑制大肠癌的侵袭和转移的可能性, 为明确大肠癌转移的发生机制以及寻找新的大肠癌治疗方案提供理论依据.
人大肠癌细胞株LoVo购自武汉大学典型生物保藏中心; BD BioCoatTM MatrigelTM Invasion Chamber(No. 354483, 354578)试剂盒购自美国BD公司; 兔抗JNK多克隆抗体, 兔抗磷酸化JNK多克隆抗体购自Upstate公司; 鼠抗单克隆MMP-9抗体, β-actin多克隆抗体购自Santa Cruz公司; SP600125购自德国Merck公司, FN购自Sigma公司.
1.2.1 细胞培养: LoVo细胞使用RPMI 1640加100 mL/L胎牛血清培养液, 置于37℃、50 mL/L CO2的培养箱中培养. 细胞无血清饥饿24 h同步化后, 对照组无FN干预, FN组给予FN 10、20、40 mg/L 24 h干预. JNK抑制剂组给予FN 40 mg/L+ SP600125(20, 40 μmol/L)干预24 h.
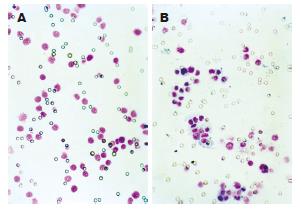
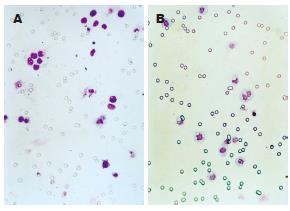
1.2.2 体外细胞运动和侵袭力的测定: 采用Boyden小室法, 按照试剂盒说明书严格无菌进行操作. 从-20℃取出试剂盒至室温, 无血清培养液37℃, 50 mL/L CO2细胞培养箱中水化上下室2 h. 对照组、FN 24 h干预及抑制剂组细胞制成细胞悬液. 上室加细胞悬液5×105/每室, 下室内加入NIH3T3细胞上清, 在37℃, 50 mL/L CO2细胞培养箱中培养24 h, 用棉签擦掉膜内表面未穿过膜的细胞, Wright-Giemsa染色. 每组设3个复孔, 计算穿过膜细胞的平均值.
1.2.3 Western blot: 组织和细胞提取总蛋白后, 离心上清液蛋白定量保存于-80℃用于JNK、MMP-9及p-JNK Western blot分析. 40 µg蛋白行SDS-PAGE变性凝胶电泳. 转膜封闭后与一抗(稀释浓度均为1:1000)4℃孵育过夜. 二抗室温反应2 h, 增强化学发光法(ECL)显影, 暗室压片. 胶片经凝胶成像分析系统处理数据.
统计学处理 实验数据以mean±SD表示, 采用SPSS11.5软件进行统计学分析, 两组间比较用单因素方差分析, 组间差异采用q检验. 以P<0.05为有统计学意义.
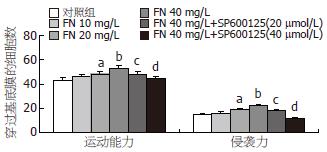
FN不同剂量(0、10、20、40 mg/L)及SP600125(20、40 µmol/L)干预大肠癌细胞, 大肠癌细胞侵袭穿过Matrigel胶的平均数分别为15.33±2.52, 16.33±2.52, 19.00±1.00, 22.00±2.00, 17.67±2.52, 12.00±1.00; 运动穿过膜的平均数42.67±2.52, 46.00±1.00, 48.00±2.00, 52.67±2.52, 48.33±1.53, 43.67±3.21. FN能剂量依赖性增强大肠癌LoVo细胞的运动和侵袭力, FN 20 mg/L时LoVo细胞的运动和侵袭力明显增强(P<0.05), 以FN 40 mg/L时细胞的运动和侵袭力最强(P<0.01). 我们选择FN 40 mg/L干预这一处理剂量的基础上加上不同浓度SP600125(20、40 µmol/L)干预24 h. 结果表明, SP600125剂量依赖性地减少LoVo细胞24 h FN诱导细胞的运动和侵袭能力, 以40 µmol/L SP600125抑制作用最强(P<0.01, 图1-3).
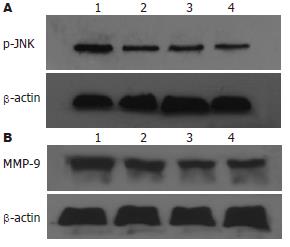
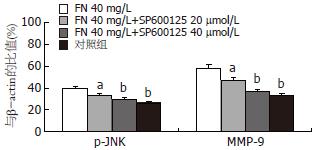
大肠癌LoVo细胞各组JNK均有表达, 但各组间无统计学意义. FN能剂量依赖性诱导p-JNK在大肠癌细胞中表达. 以FN 40 mg/L最明显(38.39%±5.97% vs 28.61%±4.19%, P<0.01). SP600125对JNK蛋白的表达无明显影响. SP600125能明显抑制p-JNK蛋白的表达, 以40 µmol/L SP600125抑制作用最强(29.59%±2.17% vs 38.39%±5.97%, P<0.01, 图4-5). 大肠癌LoVo细胞FN 40 mg/L干预时MMP-9蛋白的表达明显增强(58.25%±6.53% vs 33.43%±2.05%, P<0.01), SP600125能剂量依赖性地抑制MMP-9蛋白的表达, 以40 µmol/L SP600125抑制作用最强(36.69%±4.20% vs 58.25%±6.53%, P<0.01, 图4-5).
3 讨论
肿瘤细胞转移至远处器官决定于其从生长原位侵袭穿过组织屏障进入血循环的能力, 以及血循环中的肿瘤细胞黏附第2器官并生长增殖的能力. 肿瘤细胞侵袭和转移需细胞外基质(extracellular matrix, ECM)黏附和ECM降解的精确协同. FN是构成细胞外基质的主要成分, 他们在肿瘤细胞的增殖、分化和转移中具有重要作用. FN能反映肿瘤细胞的增殖活性及局部侵袭性, 是判定肿瘤淋巴结潜在转移的重要指标. JNK信号通路被上游信号激活后, 胞质中的JNK移位到细胞核, 可以进一步使核内的转录因子c-Jun氨基末端63及73位的丝氨酸残基磷酸化[4-5]. JNK的活化需要FAK与Src及p130Cas的结合以及与Crk的缔和. 活化的JNK进入细胞核, 使转录因子c-Jun磷酸化, 与c-Fos形成AP-1(activator protein-1)转录因子复合物. AP-1调节下游基因控制细胞的增殖过程. 几种控制细胞迁移的信号通路包括Rac, FAK和Src与JNK信号通路密切相关[6]. JNK信号通路是细胞迁移过程中所必需的[7-8], 用其抑制剂SP600125抑制JNK活化可抑制细胞的迁移[9-13].
本课题组前期研究表明胃泌素及其受体对大肠癌细胞FAK-Src-ERK1/2通路的影响在大肠癌的侵袭过程中起到了重要的作用[14]. 细胞外的刺激通过FAK/Src或Ras激活MEKK1磷酸化, 激活MKK4或MKK7, 然后激活或磷酸化JNK, 活化的JNK依次磷酸化Jun, Paxillin, Spir, DCX和MAPs. Paxillin磷酸化能促进细胞黏附进而使细胞迁移增快[15-16]. JNK在传导胞外信号至核转录因子时起着重要作用, 可以提高转录能力, 存在于多种生命过程中, 如细胞生长、癌基因转化、细胞分化和细胞死亡. 在Ras诱导的转化实验中, Ras介导c-Jun的磷酸化是由JNK完成的. JNK磷酸化c-Jun位点的突变可抑制Ras引起的成瘤[17]. 提示JNK与肿瘤发生相关, 但其作用机制还不清楚. JNK信号途径的异常活化与多种人类肿瘤的发生发展密切相关, 因此JNK信号通路是一个干预治疗潜在的分子靶点.
MMP-9又被称为Ⅳ型胶原酶, 是基质金属蛋白酶家族成员之一. MMP-9的过表达可促进恶性肿瘤的发生与发展[18-19]. 侵袭和转移是恶性肿瘤细胞的重要特征. 基质金属蛋白酶(matrix metalloproteinase, MMP)和纤溶酶原激活物(plasminogen activator, PA)等蛋白酶类是细胞侵袭过程所必需的[20-21]. MMP-9一方面降解、破坏靠近肿瘤细胞表面的ECM和BM, 释放大量的促生长因子, 导致细胞的异常增殖与凋亡抑制; 另一方面则通过毛细血管内生、新生血管生成等促进瘤细胞沿着缺失的BM向周围组织浸润, 促进肿瘤细胞的侵袭和转移灶形成. 研究表明MMP-9的表达和8NB19细胞(人神经胶质瘤细胞系)的侵袭性受JNK和ERK依赖的信号模式调节, 干预其中的任何一条信号通路都能够降低肿瘤细胞的侵袭性[22].
JNK及其信号通路在肿瘤侵袭和转移中起中介和信号放大作用, 一方面接受大量来自生长因子、丝裂原、环境刺激等的信号; 另一方面, 通过JNK级联反应作用于核转录因子, 调控基因表达, 期间伴有与其他信号通路的相互作用, 如整合素通路及PKC通路. 对此信号传导中任一位点的阻断都有可能成为抗大肠癌侵袭转移治疗新的靶点.
本课题用Western blot方法探讨JNK、磷酸化JNK, 在FN诱导和抑制剂SP600125特异性抑制大肠癌LoVo细胞中表达的差异, 观察JNK信号通路及下游信号通路MMP-9对大肠癌细胞运动、侵袭和转移的作用机制. 结果表明FN可剂量依赖性地增加LoVo细胞运动和侵袭细胞数, 以FN 40 mg/L时细胞的运动和侵袭力最强(P<0.01). SP600125能明显减少FN诱导的细胞运动和侵袭力. 磷酸化JNK蛋白和MMP-9蛋白的表达在FN地诱导下呈增强趋势, 以FN 40 mg/L最明显(P<0.01). SP600125能明显抑制FN诱导的大肠癌细胞磷酸化JNK蛋白和MMP-9蛋白的增高.
因此, 我们推测JNK可能通过激活其下游成员使大肠癌MMP的分泌增加、细胞-细胞黏附力下降而导致大肠癌细胞的运动和侵袭力增加, 最终促进癌细胞的转移.
大肠癌是人类最常见的恶性肿瘤之一, 大肠癌转移是影响患者疗效和预后并导致死亡的重要因素, 是当前大肠癌研究中最重要的一个方面. 近来研究表明c-Jun氨基末端激酶(JNK)/应激活化蛋白激酶(SAPK)信号途径在肿瘤的发生发展和转移中发挥重要作用, 但其在大肠癌侵袭和转移中的作用机制还不清楚.
曹秀峰, 主任医师, 南京医科大学附属南京第一医院肿瘤中心; 唐世刚, 教授, 大连大学附属医院消化内科; 陈光, 教授,吉林大学第一医院消化器官外.
目前研究铂类配合物的重点和热点是对现有的经典结构的改造, 如将单核的铂类配合物改为双核或多核, 增加特异性和疗效; 增加空间阻位, 防止耐药性的发生; 引入新的极性离子, 增加可溶性; 增加脂溶性, 来改变用药途径, 等等. 以此达到高效、低毒、水溶性好、选择性高、与顺铂无交叉耐药性、可口服的新型铂类.
本课题组前期研究表明, 胃泌素及其受体对大肠癌细胞FAK-Src-ERK1/2通路的影响在大肠癌的侵袭过程中起到了重要的作用.
本课题用Western blot方法探讨JNK、磷酸化JNK, 在FN诱导和抑制剂SP600125特异性抑制大肠癌LoVo细胞中表达的差异, 观察JNK信号通路及下游信号通路MMP-9对大肠癌细胞运动、侵袭和转移的作用机制.
肿瘤转移是多因素相互作用的结果, 不断研究和探讨其机制, 进一步认识肿瘤转移, 可为治疗肿瘤转移提供更可靠的理论依据. 越来越多研究证实JNK与肿瘤转移相关. 给予特异性的阻断剂, 在信号通路水平阻断和调控JNK的表达和活性, 将可能成为治疗大肠癌侵袭和转移一条新的治疗途径. 从而使JNK在临床上可作为一个潜在的大肠癌侵袭和转移的分子治疗靶点.
本研究方法先进, 所得结论客观可信, 具有一定的实际应用价值.
编辑: 李军亮 电编:何基才
| 1. | Zhang YL, Zhang ZS, Wu BP, Zhou DY. Early diagnosis for colorectal cancer in China. World J Gastroenterol. 2002;8:21-25. [PubMed] |
| 2. | 丁 涛, 张 祥宏, 李 学民, 严 霞, 邢 凌霄, 王 俊灵, 张 杰英, 薛 丽英, 赵 晨燕, 崔 晋峰. p-JNK JNK和PPARγ在食管癌变过程中的表达及其意义. 中国肿瘤临床. 2008;35:1348-1352. |
| 4. | Minden A, Lin A, Claret FX, Abo A, Karin M. Selective activation of the JNK signaling cascade and c-Jun transcriptional activity by the small GTPases Rac and Cdc42Hs. Cell. 1995;81:1147-1157. [PubMed] [DOI] |
| 5. | Gupta S, Barrett T, Whitmarsh AJ, Cavanagh J, Sluss HK, Dérijard B, Davis RJ. Selective interaction of JNK protein kinase isoforms with transcription factors. E. MBO J. 1996;15:2760-2770. [PubMed] |
| 6. | Oktay M, Wary KK, Dans M, Birge RB, Giancotti FG. Integrin-mediated activation of focal adhesion kinase is required for signaling to Jun NH2-terminal kinase and progression through the G1 phase of the cell cycle. J Cell Biol. 1999;145:1461-1469. [PubMed] [DOI] |
| 7. | Huynh-Do U, Vindis C, Liu H, Cerretti DP, McGrew JT, Enriquez M, Chen J, Daniel TO. Ephrin-B1 transduces signals to activate integrin-mediated migration, attachment and angiogenesis. J Cell Sci. 2002;115:3073-3081. [PubMed] |
| 8. | Shin EY, Kim SY, Kim EG. c-Jun N-terminal kinase is involved in motility of endothelial cell. Exp Mol Med. 2001;33:276-283. [PubMed] |
| 9. | Huang C, Rajfur Z, Borchers C, Schaller MD, Jacobson K. JNK phosphorylates paxillin and regulates cell migration. Nature. 2003;424:219-223. [PubMed] [DOI] |
| 10. | Javelaud D, Laboureau J, Gabison E, Verrecchia F, Mauviel A. Disruption of basal JNK activity differentially affects key fibroblast functions important for wound healing. J Biol Chem. 2003;278:24624-24628. [PubMed] [DOI] |
| 11. | Kavurma MM, Khachigian LM. ERK, JNK, and p38 MAP kinases differentially regulate proliferation and migration of phenotypically distinct smooth muscle cell subtypes. J Cell Biochem. 2003;89:289-300. [PubMed] [DOI] |
| 12. | Kawauchi T, Chihama K, Nabeshima Y, Hoshino M. The in vivo roles of STEF/Tiam1, Rac1 and JNK in cortical neuronal migration. EMBO J. 2003;22:4190-4201. [PubMed] [DOI] |
| 13. | Yamauchi J, Chan JR, Shooter EM. Neurotrophin 3 activation of TrkC induces Schwann cell migration through the c-Jun N-terminal kinase pathway. Proc Natl Acad Sci U S A. 2003;100:14421-14426. [PubMed] [DOI] |
| 14. | 周 燕红, 于 皆平, 罗 和生, 黄 永兰, 明 媚, 于 红刚. 胃泌素促FAK-Src-ERK1/2通路的活化对大肠癌细胞运动和侵袭的影响. 中华内科杂志. 2007;46:318-319. |
| 15. | Huang C, Jacobson K, Schaller MD. A role for JNK-paxillin signaling in cell migration. Cell Cycle. 2004;3:4-6. [PubMed] |
| 16. | Zhao ZS, Manser E, Loo TH, Lim L. Coupling of PAK-interacting exchange factor PIX to GIT1 promotes focal complex disassembly. Mol Cell Biol. 2000;20:6354-6363. [PubMed] [DOI] |
| 17. | Behrens A, Jochum W, Sibilia M, Wagner EF. Oncogenic transformation by ras and fos is mediated by c-Jun N-terminal phosphorylation. Oncogene. 2000;19:2657-2663. [PubMed] [DOI] |
| 18. | Coussens LM, Tinkle CL, Hanahan D, Werb Z. MMP-9 supplied by bone marrow-derived cells contributes to skin carcinogenesis. Cell. 2000;103:481-490. [PubMed] [DOI] |
| 19. | Bergers G, Brekken R, McMahon G, Vu TH, Itoh T, Tamaki K, Tanzawa K, Thorpe P, Itohara S, Werb Z. Matrix metalloproteinase-9 triggers the angiogenic switch during carcinogenesis. Nat Cell Biol. 2000;2:737-744. [PubMed] [DOI] |
| 20. | Widmann C, Gibson S, Jarpe MB, Johnson GL. Mitogen-activated protein kinase: conservation of a three-kinase module from yeast to human. Physiol Rev. 1999;79:143-180. [PubMed] |
| 21. | Rabbani SA, Mazar AP. The role of the plasminogen activation system in angiogenesis and metastasis. Surg Oncol Clin N Am. 2001;10:393-415, x. [PubMed] |
| 22. | Lakka SS, Bhattacharya A, Mohanam S, Boyd D, Rao JS. Regulation of the uPA gene in various grades of human glioma cells. Int J Oncol. 2001;18:71-79. [PubMed] |