修回日期: 2009-07-12
接受日期: 2009-07-13
在线出版日期: 2009-07-28
目的: 探讨干扰N-WASP功能区对大肠癌细胞侵袭转移能力的影响.
方法: 采用基因克隆方法构建包含N-WASP功能区V片段的重组质粒, 转染大肠癌株LoVo. 采用Transwell穿膜实验观察大肠癌细胞侵袭能力的变化; 应用Capture-ELISA方法检测大肠癌细胞内吞生物素标记的转铁蛋白(Tfn)的能力改变. 脾内注射制备大肠癌肝转移裸鼠模型, 在体内进一步观察大肠癌细胞转移能力改变.
结果: 成功构建了含有N-WASP的V结构区域的重组质粒, 并转染大肠癌株LoVo获得稳定表达. 实验组表达V片段的大肠癌细胞穿膜的细胞数为42.15±7.35, 而对照表达空载体的大肠癌细胞穿膜细胞数为85.25±6.16, 未转染的大肠癌细胞穿膜细胞数为84.35±7.99, 与实验组相比具有显著差异(P<0.05). 表达V片段的大肠癌细胞内吞转铁蛋白的数量较对照组明显减少, 内吞作用能力减弱. 动物实验显示表达V片段的大肠癌细胞肝转移发生数为2/12, 较对照组(10/12)和未转染组(10/12)明显减少.
结论: 靶向干预N-WASP与微丝蛋白结合的功能区域的新方法能够抑制人大肠癌细胞的侵袭和转移能力.
引文著录: 黄宝玉, 赵任, 秦婧, 贾晓斌, 朱建伟. 靶向干预N-WASP功能区对大肠癌细胞侵袭转移能力的影响. 世界华人消化杂志 2009; 17(21): 2137-2141
Revised: July 12, 2009
Accepted: July 13, 2009
Published online: July 28, 2009
AIM: To examine the effect of intervention targeting the G-actin binding domain of N-WASP on the invasion and metastasis of colon cancer cells.
METHODS: Recombinant expression vector encoding the V motif of N-WASP was designed, constructed and transfected into human colon cancer cells (LoVo) to obtain stably expressed cell strain. Transwell assay was used to examine the change in the invasive ability of LoVo cells. Capture-ELISA assay was used to measure transferrin (Tfn) internalization, a hallmark of cell endocytosis. Furthermore, a mouse model of metastatic colon cancer was generated by injection of LoVo cells into the spleen of mice to observe liver metastasis.
RESULTS: The recombinant plasmid was successfully constructed and transfected into LoVo cells. Cells transfected with the recombinant plasmid showed a low invasive ability when compared with untransfected cells or cells transfected with empty plasmid. The number of recombinant plasmid-transfected cells passing through the Transwell membrane were significantly lower than those of untransfected cells or cells transfected with empty plasmid (42.15 ± 7.35 vs 85.25 ± 6.16 and 84.35 ± 7.99, both P < 0.05). Capture-ELISA assay showed that internalization of transferrin in cells transfected with recombinant plasmid was attenuated dramatically when compared to control cells. Animal experiments showed that the number of mice developing liver metastasis in mice injected with recombinant plasmid-transfected cells was significantly lower than that in mice injected with untransfected or empty plasmid-transfected cells (2/12 vs 10/12 and 10/12).
CONCLUSION: Interference targeting the G-actin binding domain of N-WASP is able to inhibit the invasion and metastasis of colon caner cells.
- Citation: Huang BY, Zhao R, Qin J, Jia XB, Zhu JW. Interference targeting the G-actin binding domain of N-WASP inhibits the invasion and metastasis of colon cancer cells. Shijie Huaren Xiaohua Zazhi 2009; 17(21): 2137-2141
- URL: https://www.wjgnet.com/1009-3079/full/v17/i21/2137.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i21.2137
大肠癌在恶性肿瘤致死原因中位居第4位, 肿瘤细胞的侵袭及转移是大肠癌患者主要的死亡原因. 研究发现, 肿瘤细胞侵袭转移与癌细胞的迁移、内吞作用及伪足形成等细胞运动性密切相关. 研究发现, 肌动蛋白骨架是细胞产生运动性的重要介质[1], 肌动蛋白的装配依靠蛋白复合物-ARP2/3复合物的催化作用[2]. 内源性ARP2/3复合体的激活依靠Neural-WASP(N-WASP)[3]的激活作用. N-WASP蛋白质分子V区域是与肌动蛋白单体(G-actin)结合的部位, C与A区域是与ARP2/3复合物结合的部位, 只有完整的VCA结构同时结合G-actin和ARP2/3复合物, 才能发挥N-WASP的促进ARP2/3介导的肌动蛋白聚合作用[4]. 因此, 我们设想将N-WASP的V片段或CA片段单独在癌细胞内高表达, 以此来靶向干扰N-WASP与actin和ARP2/3的结合, 抑制癌细胞的肌动蛋白的装配, 以此带来细胞运动性及侵袭转移能力的减弱. 本研究设计和构建了N-WASP V片段重组DNA, 转染大肠癌细胞, 观察了癌细胞运动性及侵袭转移能力的变化.
人大肠癌细胞株LoVo购自中国科学院上海细胞所, 以含100 mL/L胎牛血清的RPMI 1640培养基(Gibco公司)在37℃, 50 mL/L CO2培养箱中常规培养, 对数生长期细胞用于后续实验. 大肠杆菌DH5α由南通大学医学院微生物与免疫实验室惠赠, 载体pEGFP-N2来自CloneTec公司, 含有N-WASP全长基因的质粒由马里兰大学癌症中心惠赠. Taq DNA聚合酶、dNTP、EcoRⅠ和XhoⅠ限制性内切酶、T4连接酶、Lipofectamine2000(Invitrogen公司), 胰蛋白酶(Amresco公司), Transwell chamber(Corning公司). 其余试剂均为国产分析纯. 质粒提取试剂盒为Axygen公司产品, 琼脂糖凝胶回收试剂盒为Watson公司产品. BALB/C裸小鼠36只, 周龄4-6 wk, ♀, 体质量18-20 g, 饲养于SPF环境下, 来自中国科学院上海实验动物中心.
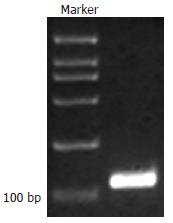
1.2.1 重组表达质粒的构建: 参考GenBank中人N-WASP的V区域序列设计引物, 序列中包含了EcoRⅠ和XhoⅠ的酶切位点序列: 上游引物: 5'-CCG CTC GAG ATG AAC AAA GCA GCT TTT A-3'下游引物: 5'-CGG AAT TCC ACA GAT TTT AGT TGG ATA CCC-3'. PCR条件: 10×Buffer 5 µL, dNTP 1 µL, 上、下游引物各1 µL, Taq DNA聚合酶2.5 U, 质粒模板10 µL, 余用dd-H2O补足50 µL. 反应条件: 94℃ 5 min, 94℃ 1 min, 58℃ 30 s, 72℃ 30 s, 共30个循环, 72℃ 7 min. 产物进行凝胶电泳. 胶回收, DNA片段酶切, 质粒连接. 酶切鉴定和DNA测序.
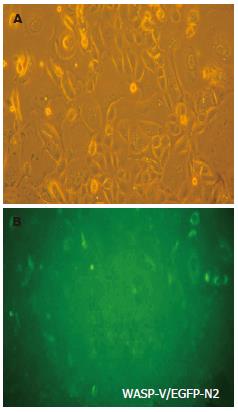
1.2.2 大肠癌细胞质粒转染及稳定株筛选: 大肠癌细胞接种于六孔板. 用50 µL Opti-MEMI培养基稀释1 µg质粒DNA, 每孔用50 µL Opti-MEMI培养基稀释4 µL Lipofectamine2000试剂, 5 min后同稀释的DNA混合. 混合稀释的DNA和稀释的Lipofectamine2000室温保存20 min. 在加入复合物前移去生长培养基, 替换为1.9 mL无血清RPMI 1640培养基, 将复合物加入到每个孔中, 摇动培养板, 轻轻混匀. 在37℃、50 mL/L的CO2中培养6 h后换为完全培养基继续培养, 次日显微镜下观察绿色荧光表达, 并加入G418筛选, 获得稳定表达细胞.
1.2.3 Transwell侵袭实验: 转染48 h后细胞用2.5 g/L的胰酶消化, 调整细胞密度于1×109/L. 37℃、50 mL/L CO2, 细胞悬液100 µL加入Transwell小室, 24孔板下室加入600 µL完全培养基, 培养24 h. 100 g/L甲醛固定细胞30 s, 结晶紫溶液细胞染色. 倒置显微镜下计数移到膜下层的细胞, 每张膜分别计数8个随机视野的穿膜细胞, 计算平均数. 每组细胞行4次Transwell侵袭实验.
1.2.4 Capture-ELISA检测细胞内吞作用: 上述3种细胞置37℃, 50 mL/L CO2培养箱中培养, 30 min后加入bio-Tfn, 浓度为10 mg/L, 冰上培养30 min后, 37℃开始内吞5 min, 冰上终止细胞内吞. 96孔ELISA板, 每孔加入100 µL抗TFN抗体(2 mg/L), 4℃孵育过夜. 细胞裂解物, 每孔100 µL, 4℃孵育12 h, HRP-Streptavidin(1:5000稀释)100 µL, 37℃孵育1 h. TMB底物溶液0.1 mL, 37℃, 10-30 min. 2 mol/L硫酸0.05 mL终止反应, 450 nm处测吸光度值.
1.2.5 结肠癌肝转移动物模型的建立: 选用生长状况良好的细胞, 消化, 洗涤, D-Hanks液悬浮, 血细胞计数板计数, 台盼兰染色观察细胞活力. 实验36只裸小鼠随机分为3组, 每组12只, 分别向脾脏注入1×1010/L细胞(3种不同细胞分别为V片段表达质粒转染细胞、空载体转染细胞、未转染细胞). 实验动物饲养于SPF环境下, 常规喂养给水, 12 h照明. 选用乙醚吸入麻醉, 左上腹切口, 长约0.5-1.0 cm, 进腹暴露脾脏后, 用5号针头将上述3组结肠癌细胞缓慢注入裸鼠脾脏, 每只裸鼠注射细胞悬液0.2 mL, 注射时间约3 min, 术毕, 关腹, 整个操作过程遵循无菌操作原则. 麻醉清醒后常规饲养. 接种8 wk后颈椎脱臼法处死动物, 观察癌细胞局部生长和肝转移情况.
统计学处理 采用多个均数的比较的F检验对数据进行分析, P<0.05表示有统计学意义.
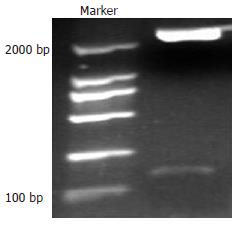
V重组质粒双酶切鉴定行凝胶电泳在大约2000 bp和108 bp处各有一明亮清晰特异条带(图2), 表明目的片段V已经准确连入表达载体的EcoRⅠ和XhoⅠ酶切位点之间, 成功构建重组真核表达质粒pEGFP-V. 经过DNA测序, 插入片段DNA序列正确.
显微镜下观察视野下绿色荧光表达, 结合同视野光镜下细胞形态比较(图3), 可见细胞质内的绿色荧光表达, 转染成功.
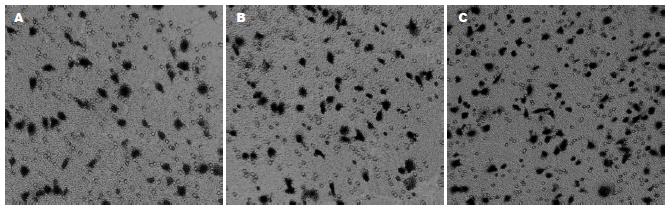
3种细胞经Transwell小室培养模型培养后穿膜细胞进行计数显示V组癌细胞穿膜能力较其他2组明显减少(图4), 差异有统计学意义(P<0.05); 而空质粒组与未转染组间细胞穿膜能力无明显差异, 差异无统计学意义(P>0.05, 表1).
| 分组 | 视野数 | 穿膜细胞数(mean±SD) |
| V片段组 | 8×4 | 42.15±7.35 |
| 空质粒组 | 8×4 | 85.25±6.16 |
| 未转染组 | 8×4 | 84.35±7.99 |
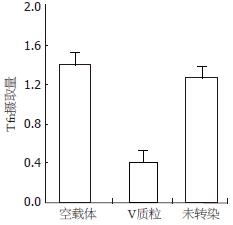
空质粒组与未转染组内吞转铁蛋白的数量相当; V质粒组与空质粒组和未转染组相比较内吞量明显减少(P<0.05, 图5).
对照组(包括空载体转染癌细胞和未转染癌细胞)部分裸鼠有腹腔其他部位转移灶, 实验组未见腹腔其他部位转移. 大体标本观察空载体转染癌细胞和未转染癌细胞组的12只裸鼠分别各有10只发生肝转移, 实验组的12只裸鼠仅有2只发生肝转移.
大肠癌是临床常见的肿瘤类型. 在恶性肿瘤致死原因中位居第4位. 肿瘤细胞的侵袭及转移是大肠癌患者死亡的主要原因. 寻找对抗肿瘤转移的策略一直是临床及基础研究的热点.
肿瘤细胞的转移包括从原发病灶脱落并侵入脉管、在新的器官定植、转移灶形成新生血管并持续增殖等复杂过程[5], 概括起来就是黏附、降解、移动和血管形成等[6], 这一系列的过程都离不开细胞的运动. 通过对体外培养细胞的研究, 人们了解到细胞的运动与细胞皮层(cortex)微丝肌动蛋白的动态组装有着直接关系. 肌动蛋白的装配首先是肌动蛋白单体(G-actin)聚合成肌动蛋白丝(F-actin)的过程, 这一过程需要ARP2/3复合物介导的催化作用[3]. 在细胞内, ARP2/3复合物一般处于失活或低活性状态. ARP2/3复合物的激活需要一种重要分子N-WASP的参与. N-WASP与ARP2/3复合物聚集并活化ARP2/3复合物, 进一步激活了微丝肌动蛋白聚合过程, 导致皮质肌动蛋白组装和分支快速形成[7], 从而迅速驱动了细胞运动的发生. 由此可见, 在肌动蛋白聚合的过程中, N-WASP发挥了重要的作用, 直接影响了细胞运动的发生.
WASP家族是目前了解较多的一种肌动蛋白核化促进因子, 在体外实验中他能和肌动蛋白单体和ARP2/3复合物结合, 促进肌动蛋白微丝生长[8]. WASP家族主要包括WASP[9]和Neural-WASP(N-WASP),在胃肠道组织中主要是N-WASP表达. N-WASP蛋白的羧基端由同源区域(V), 中央区域(C)和酸性区域(A)3个部分组成[10]. 其中的V区域是N-WASP与肌动蛋白单体结合的部位, C与A区域是与ARP2/3复合物结合的部位. 而只有完整的VCA区域同时结合G-actin和ARP2/3才能发挥促进ARP2/3介导的肌动蛋白的聚合作用. 研究发现N-WASP装配速度约是WASP的4倍[11], 这可能与N-WASP有2个V同源区有关, 同时也说明V同源区是细胞信号级联诱导肌动蛋白聚合的关键区域[12].
根据以上作用特点, 我们试图通过靶向抑制N-WASP蛋白结构功能区中与G-actin相结合的区域, 来抑制N-WASP促进ARP2/3的激活和由此介导的肌动蛋白的装配, 期望削弱肿瘤细胞的侵袭转移等运动, 最终达到抑制瘤细胞转移侵袭的目的. 在本研究中, 我们设计了结构中仅含有N-WASP的V区域而没有CA区域的干扰性分子, 并构建重组的表达质粒, 转导进入大肠癌细胞, 用以干扰N-WASP促进ARP2/3介导的微丝聚合作用. 实验通过PCR获得目的片段, 将其和荧光表达载体pEGFP-N2分别以EcoRⅠ和XhoⅠ为酶切位点双酶切后连接, 获得重组质粒. 该质粒通过脂质体介导入大肠癌细胞LoVo. 借助载体自带的绿色荧光在显微镜下观察转染成功. Transwell侵袭实验表明, 与对照组和未转染组比较, 表达V片段的大肠癌细胞的侵袭力明显下降; Capture-ELISA法显示表达V片段的大肠癌细胞的内吞量较对照组和未转染组明显减少. 研究结果显示, 细胞内表达N-WASP的V片段作为拮抗分子, 能够干扰N-WASP结合ARP2/3而促进肌动蛋白装配的功能, 并带来癌细胞的运动性的改变, 最终导致癌细胞侵袭转移能力的抑制. 通过动物实验, 我们发现表达V片段的大肠癌细胞的肝转移数目相比空质粒组和未转染组明显减少.
本研究作为一个初步实验, 显示了N-WASP功能在大肠癌细胞运动和癌细胞的侵袭转移能力方面的重要性. 干扰癌细胞内N-WASP参与的ARP2/3复合物介导的肌动蛋白聚合作用可能是一条对抗大肠癌转移的新的途径. 我们的后续研究将在体外合成干扰性小分子肽, 进一步验证对大肠癌侵袭转移的抑制性作用.
N-WASP与ARP 2/3复合物聚集并活化ARP2/3复合物, 导致皮层肌动蛋白组装和分支结构的快速形成, 从而驱动了细胞运动的发生. 本实验采用基因克隆方法构建重组质粒, 靶向干预大肠癌细胞的N-WASP的功能区, 观察大肠癌细胞的侵袭转移能力的改变.
程斌, 副教授, 华中科技大学同济医学院附属同济医院消化内科.
N-WASP参与了肌动蛋白的装配过程, 促进细胞运动性的改变, 这在乳腺、神经等组织器官的肿瘤细胞中的表达均有报道, 但与大肠癌的关系尚未报道.
有研究表明, N- WASP在头颈部、乳腺、胃、神经等组织肿瘤细胞中均有表达.
干扰癌细胞内N-WASP参与的ARP2/3复合物介导的肌动蛋白聚合作用可能是一条对抗大肠癌转移的新的途径..
本研究具有一定原创性, 立题新颖, 实验设计科学, 研究手段先进, 结果明确可靠, 结论可信, 学术价值较好.
编辑: 李军亮 电编:何基才
| 1. | Chen WT. Proteolytic activity of specialized surface protrusions formed at rosette contact sites of transformed cells. J Exp Zool. 1989;251:167-185. [PubMed] [DOI] |
| 2. | Fukui Y, de Hostos E, Yumura S, Kitanishi-Yumura T, Inou . Architectural dynamics of F-actin in eupodia suggests their role in invasive locomotion in Dictyostelium. Exp Cell Res. 1999;249:33-45. [PubMed] [DOI] |
| 3. | Pollard TD, Borisy GG. Cellular motility driven by assembly and disassembly of actin filaments. Cell. 2003;112:453-465. [PubMed] [DOI] |
| 4. | Kapus A, Szászi K, Sun J, Rizoli S, Rotstein OD. Cell shrinkage regulates Src kinases and induces tyrosine phosphorylation of cortactin, independent of the osmotic regulation of Na+/H+ exchangers. J Biol Chem. 1999;274:8093-8102. [PubMed] [DOI] |
| 5. | Jiang WG, Puntis MC, Hallett MB. Molecular and cellular basis of cancer invasion and metastasis: implications for treatment. Br J Surg. 1994;81:1576-1590. [PubMed] [DOI] |
| 6. | Liotta LA, Stetler-Stevenson WG. Tumor invasion and metastasis: an imbalance of positive and negative regulation. Cancer Res. 1991;51:5054s-5059s. [PubMed] |
| 7. | Uruno T, Liu J, Zhang P, Fan Yx, Egile C, Li R, Mueller SC, Zhan X. Activation of Arp2/3 complex-mediated actin polymerization by cortactin. Nat Cell Biol. 2001;3:259-266. [PubMed] [DOI] |
| 8. | Cooper JA, Wear MA, Weaver AM. Arp2/3 complex: advances on the inner workings of a molecular machine. Cell. 2001;107:703-705. [PubMed] [DOI] |
| 9. | Yarar D, To W, Abo A, Welch MD. The Wiskott-Aldrich syndrome protein directs actin-based motility by stimulating actin nucleation with the Arp2/3 complex. Curr Biol. 1999;9:555-558. [PubMed] [DOI] |
| 10. | Antón IM, Jones GE, Wandosell F, Geha R, Ramesh N. WASP-interacting protein (WIP): working in polymerisation and much more. Trends Cell Biol. 2007;17:555-562. [PubMed] [DOI] |
| 11. | Volkmann N, Amann KJ, Stoilova-McPhie S, Egile C, Winter DC, Hazelwood L, Heuser JE, Li R, Pollard TD, Hanein D. Structure of Arp2/3 complex in its activated state and in actin filament branch junctions. Science. 2001;293:2456-2459. [PubMed] [DOI] |
| 12. | Yamaguchi H, Miki H, Suetsugu S, Ma L, Kirschner MW, Takenawa T. Two tandem verprolin homology domains are necessary for a strong activation of Arp2/3 complex-induced actin polymerization and induction of microspike formation by N-WASP. Proc Natl Acad Sci U S A. 2000;97:12631-12636. [PubMed] [DOI] |