修回日期: 2009-06-25
接受日期: 2009-06-29
在线出版日期: 2009-07-28
目的: 观察Smad7和PDGF-B在纤维化胰腺组织中的表达及应用干扰素-α(IFN-α)对二者表达的影响.
方法: 312只雌性Wistar大鼠, 随机分成对照组、纤维化组和干扰素组. 每周向纤维化组和干扰素组大鼠腹腔内注射2次二乙基二硫代氨基甲酸盐(diethyldithiocarbamate, DDC)造模; 干扰素组于造模同时每天皮下注射IFN-α 10万单位. 纤维化组分别于0, 1, 2, 3, 4, 6, 8 wk末取材, 干扰素组于6 wk末取材, 应用免疫组织化学法测定纤维化胰腺组织中Smad7、PDGF-B的表达.
结果: 与对照组相比, Smad7表达于纤维化第3周开始减少(34.22±7.60 vs 53.46±30.45, P<0.01), 3-8 wk末呈低表达. PDGF-B表达从纤维化开始即呈高表达(均P<0.01), 随时间的延长, PDGF-B表达逐渐增加, 造模8 wk末, PDGF-B下降. 干扰素组6 wk末Smad7的表达较同期纤维化组增加(47.22±17.26 vs 15.27±9.65, P<0.01); PDGF-B表达明显减少(29.13±11.06 vs 57.63±40.66, P<0.01), 其表达同纤维化组3 wk末.
结论: 干扰素的应用可以降低PDGF-B的表达, 增高Smad7的表达.
引文著录: 白一彤, 陈少夫, 郑宏, 黄茜. IFN-α对大鼠胰腺纤维化组织中Smad7及PDGF-B表达的影响. 世界华人消化杂志 2009; 17(21): 2131-2136
Revised: June 25, 2009
Accepted: June 29, 2009
Published online: July 28, 2009
AIM: To investigate the effects of interferon-alpha (IFN-α) on the expression of Smad7 and PDGF-B in fibrotic pancreas in rats with diethyldithiocarbamate (DDC)-induced pancreatic fibrosis.
METHODS: Three hundreds and twelve female Wistar rats were randomly divided into three groups: normal control group, model control group and IFN-α treatment group. Rats in the model control group and IFN-α treatment group were given repeated intraperitoneal injections of DDC to induce pancreatic fibrosis. Meanwhile, a subcutaneous injection of IFN-α was given to rats in the IFN-α treatment. The rats in the model control group were sacrificed at weeks 0, 1, 2, 4, 6 and 8 after initial induction with DDC, respectively, to take samples, while those in the IFN-α treatment group were sacrificed at week 6. The expression of Smad7 and PDGF-B in fibrotic pancreas were detected by immunohistochemistry.
RESULTS: Compared with the normal control group, the expression of Smad7 in the model control group began to decrease from week 3 (34.22 ± 7.60 vs 53.46 ± 30.45, P < 0.01) and was kept at low level from weeks 3 to 8, while the expression of PDGF-B in the model control group was high at the beginning (P < 0.01), gradually increased from weeks 3 to 7, and began to decrease from week 8. The expression level of Smad 7 at week 6 in the IFN-α treatment group was significantly higher than that in the model control group (47.22 ± 17.26 vs 15.27 ± 9.65, P < 0.01). In contrast, the expression level of PDGF-B at week 6 in the IFN-α treatment group was significantly lower than that in the model control group (29.13 ± 11.06 vs 57.63 ± 40.66, P < 0.01).
CONCLUSION: IFN-α is able to inhibit the expression of PDGF-B but promote the expression of Smad7 in fibrotic pancreas in rats.
- Citation: Bai YT, Chen SF, Zheng H, Huang Q. Effects of interferon-alpha on the expression of Smad7 and PDGF-B in fibrotic pancreas in rats. Shijie Huaren Xiaohua Zazhi 2009; 17(21): 2131-2136
- URL: https://www.wjgnet.com/1009-3079/full/v17/i21/2131.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i21.2131
近年来慢性胰腺炎发病率日益增高[1]. 其主要病理学改变为胰腺纤维化, 探讨纤维化胰腺组织的分子学改变为抑制其发生、发展提供可能. 研究发现[2-3]: 胰腺星状细胞通过激活、转化, 促进细胞外基质的形成, 进而导致胰腺纤维化. 血小板源性生长因子(platelet-derived growth factor-B, PDGF-B)和转化生长因子-β1(transforming growth factor-beta1, TGF-β1)在此过程中起最重要作用. Smad基因家族成员是TGF在细胞内的信号转导分子. 本实验研究PDGF-B、Smad7在胰腺纤维化过程中的表达以及干扰素干预对PDGF-B、Smad7表达的影响, 为应用干扰素治疗胰腺纤维化提供理论依据.
♂Wistar大鼠312只, 均购自北京维通利华实验动物公司, 清洁级, 体质量200-250 g. IFN-α为哈药集团生物工程有限公司生产, 批号: 20060101. 兔抗人Smad7多克隆抗体、兔抗大鼠PDGF-B均购自北京博奥森生物技术有限公司.
1.2.1 分组及取材: 应用随机数字法将Wistar大鼠分为对照组(n = 147)、纤维化组(n = 147)及干扰素组(n = 18). 向纤维化组及干扰素组大鼠ip DDC(浓度为150 g/L)1000 mg/kg, 每周2次. 同时, 对照组注射等量生理盐水. 并向干扰素组每天皮下注射IFN-α 10万单位, 其他2组皮下注射等量生理盐水, 纤维化组分别于0、1、2、3、4、6、8 wk末取材, 干扰素组于6 wk末取材.
1.2.2 Smad7、PDGF-B检测: 选取每只大鼠胰腺组织的5个不同部位100 g/L甲醛溶液中固定, 过夜, 石蜡包埋制作切片, 常规HE染色; 免疫组织化学按SP试剂盒说明书进行, DAB显色, 苏木素复染, 中性树胶封片. 以染为淡黄色、黄色、棕黄色、棕褐色为阳性, 每张切片随机选取10个无重叠400倍高倍视野, 应用我院NIS-Elements F2.30图像采集软件进行图像采集, NIS-Elements BR3.0图像分析软件计算积分吸光度值(IA).
统计学处理 实验数据以mean±SD表示, 应用SPSS17.0软件进行方差分析, P<0.05为差异有统计学意义.
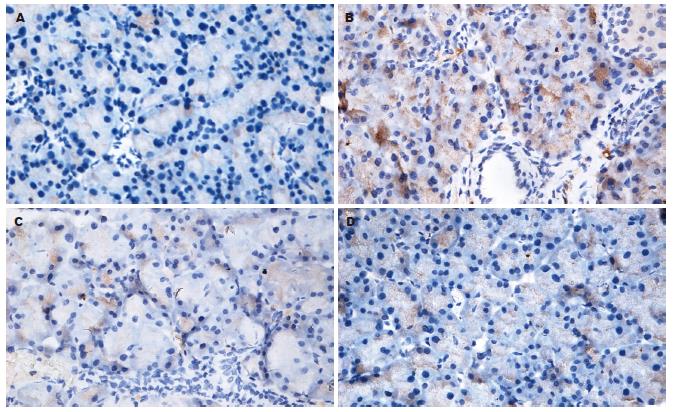
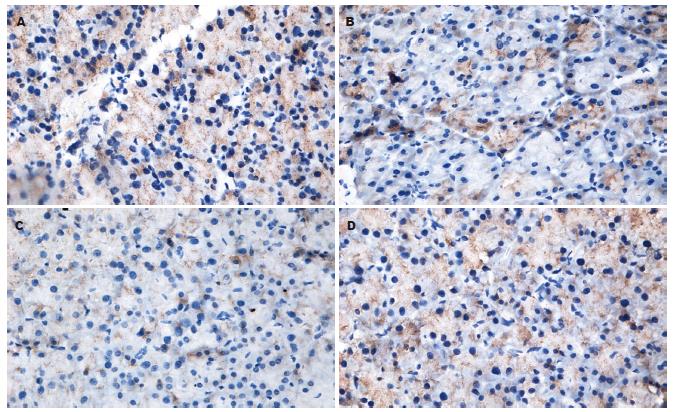
Smad7表达在对照组各组间无显著性差异; 纤维化组与对照组比较, 0、1、2 wk末间无明显差异, 于造模第3 wk开始表达减少(P<0.01), 3-8 wk末呈低表达, 组间无显著性差异. 干扰素组6 wk末表达较同期纤维化组增加, 差异显著(P<0.01), 但较对照组减少, 差异显著(P<0.05, 表1, 图1-2).
PDGF-B表达在对照组各组间无显著性差异; 纤维化组与对照组比较, 从第1周即呈高表达(P<0.05), 1 wk组与2 wk组比较, 其表达无显著性差异, 后随时间延长, 表达逐渐增加, 组间差异显著(P<0.01). 8 wk末PDGF-B下降, 表达同纤维化组3 wk末. 干扰素组6 wk末表达较同期纤维化组减少, 差异显著(P<0.01), 仍较对照组显著增加(P<0.01, 表2, 图1, 3).
3 讨论
胰腺纤维化主要是通过激活胰腺星状细胞, 促进细胞外基质形成所致. 研究发现胰腺星状细胞位于腺细胞间, 围绕于相邻腺细胞的基底部, 占胰腺细胞总数的3.99%[4]. TGF-β1、PDGF在胰腺纤维化的过程中起最重要作用. TGF-β1主要通过TGF-β1/Smad途径发挥生物学效应: TGF-β首先与细胞膜上的TGF-β受体Ⅱ结合, 形成信号受体复合物, 再与TGF-β受体Ⅰ结合, 并激活TGF-β受体Ⅰ, 对Smad2、Smad3进行磷酸化, 后者与Smad4形成复合物, 转移至细胞核中, 发挥转录调控作用[5-7]. Smad蛋白可分为3类: (1)受体激活的Smads; (2)共同介体性Smads; (3)抑制性Smads[8]. Smad7被认为是TGF-β1家族受体激酶的关键作用底物[9-10], TGF-β1信号转导途径中抑制性调节蛋白[11-12]. 目前已知的Smad7抑制作用主要存在以下几种机制: (1)Smad7与TGF-β受体Ⅰ结合, 竞争性抑制Smad2、Smad3磷酸化, 对基因转录调控起负性调节作用; (2)Smad7直接与活化的TGF-β1结合, 从而减少细胞膜上TGF-β1的数量, 与细胞内各转录因子组氨酸去乙酰基酶结合, 影响转录因子的乙酰化, 抑制TGF-β的信号转导; (3)Smad7募集Smad泛素化调节因子(Smurf)至TGF-β受体, 促进TGF-β受体降解, 从而发挥负调控作用[13-16]. 2008年杨小艳 et al[17]采用基因重组技术构建大鼠Smad7真核表达质粒模型, 探讨Smad7在肝星状细胞中的表达, 进一步证实了Smad7参与了TGF-β/Smad信号转导. 同年, 于鸿 et al[18]通过转染Smad7基因, 发现大鼠肾小球系膜细胞中Ⅰ、Ⅲ型胶原表达明显降低, 得出结论: Smad7可以起到减轻肾纤维化的作用. 由此, 如何通过上调Smad7的表达来抑制组织纤维化已为越来越多的学者所关注. 研究证实干扰素-α不仅可以通过依赖或非依赖于P53的途径, 抑制细胞周期进程, 促进细胞凋亡, 还可以干预T淋巴细胞的功能, 调节促炎和抗炎细胞因子的合成与分泌[19-20]. 目前为止, 干扰素应用于抗纤维化的研究已遍布在多个领域, 包括肝脏、心血管、肾脏等. 早在2002年张惠芸 et al[21]对116例慢性乙型肝炎患者进行了临床研究, 证实IFN-α可以减少血清透明质酸、层粘连蛋白、Ⅳ型胶原的表达, 进而抑制纤维组织的形成与沉积. 2006年, 饶慧瑛 et al[22]经研究发现IFN-β能通过上调Smad7的蛋白表达, 抑制肝星状细胞的激活, 发挥抗肝纤维化的作用. 2007年Weng et al[23]对慢性HBV感染患者进行了随机、开放、多中心试验, 发现经IFN-γ治疗9 mo后, 可有效抑制肝组织纤维化, 减少α-SMA阳性肝星状细胞的数量. 同年, 车雷 et al[24]通过体外培养大鼠肝星状细胞, 采用流式细胞仪研究IFN-α对活化的大鼠肝星状细胞凋亡的影响, 结果显示: 肝星状细胞的早期凋亡率随干扰素浓度的增加而提高, 进一步证明了肝星状细胞早期凋亡可能与干扰素抗纤维化相关. 2008年姜琳 et al[25]研究发现IFN-γ可以通过上调肾小球系膜细胞Smad7而减少Ⅳ型胶的表达, 从而抑制肾小球硬化. Hamzavi et al[26]应用IFN-γ干扰大鼠Smad7基因表达, 发现可以减轻大鼠肝损伤及肝纤维化. 认为IFN-γ主要通过STAT-1信号途径诱导Smad7启动因子及蛋白表达, 进而起到抗肝脏细胞纤维化作用. 以上实验均证明了干扰素的应用可能对组织纤维化起到抑制作用. 从而引起了应用干扰素抑制胰腺纤维化的思考.
血小板源生长因子(platelet-derived growth factor, PDGF)是从血小板中分离出的一种重要的促有丝分裂因子, 具有刺激特定细胞群分裂增殖的能力, 对胰腺星状细胞的活化、增殖、合成胶原及细胞外基质均有明显作用[27-28]. PDGF在生理状态下主要储存在血小板的α颗粒中, 体内多种血细胞、组织细胞和某些肿瘤细胞等均可产生和分泌PDGF. 经典的PDGF由A链和B链通过二硫键形成二聚体(PDGF-AA, PDGF-AB, PDGF-BB), 近来发现PDGF还存在C链和D链, 同样形成二聚体(PDGF-CC, PDGF-DD)[29]. PDGF在细胞内与受体结合后, 激活细胞内酪氨酸蛋白激酶, PDGF受体发生自动磷酸化, 与受体位点上的磷酸化酪因同源区2(Src-SH2)或酪氨酸磷酸区域进行结合. 结合于已激活的PDGF受体分子经过一系列磷酸化反应, 可活化核膜上的丝氨酸或苏氨酸残基激酶, 再作用于核内蛋白转录因子, 经信号传递使DNA的一些活性转录区参与基因表达调控, 或增加拓扑异构酶活力, 改变RNA含量, 使细胞生长、分裂[30]. 此外, PDGF对星状细胞具有明显的趋化作用, 可以使活化的星状细胞向受损的部位游走, 加重了受损部位胰腺的纤维化, 而位于胰腺微血管周围激活的胰腺星状细胞具有缩血管效应, 使胰腺微血管灌注不足, 导致微血管缺血从而加重胰腺纤维化和胰腺实质萎缩[31-32]. 2003年吴强 et al[33]应用免疫组织化学法检测大鼠肝纤维化组织中PDGF的表达, 发现其明显增强. 桂乐 et al[34]通过原位杂交法发现干扰素的应用可使动脉粥样硬化的家兔PDGF-β的表达显著减少, 并得出结论: PDGF-β可能是促使血管平滑肌细胞增生、动脉粥样硬化进展的主要原因. 而应用干扰素可以下调PDGF-β mRNA, 从而抑制动脉粥样硬化的形成与发展. 2009年Olson et al[35]认为增加PDGFR-α活性可使结缔组织变异, 促使组织纤维化的形成. 本研究发现PDGF-B表达于纤维化组6 wk末达高峰, 8 wk末下降, 考虑与纤维化晚期, 即使纤维组织增生, 但炎症细胞减少, 使PDGF-B表达减少相关. 于是, 本实验选择干扰素组于6 wk末取材, 避免因炎症细胞减少所致的PDGF-B表达下降而影响对应用干扰素后PDGF-B表达的观察.
本实验结果可见: 干扰素组6 wk末Smad7表达较同期纤维化组增加, 差异显著, 而较对照组减少. PDGF表达较同期纤维化组减少, 而较对照组显著增加.
总之, IFN-α的应用可以提高Smad7的表达并且降低PDGF-B的表达. 但对于诱导胰腺纤维化时间较长组, 即纤维化较严重组, 干扰素的应用仅能起到部分作用, 而不能完全逆转Smad7及PDGF-B的表达. 因此我们主张早期应用干扰素, 方能起到较好的效果.
近年来慢性胰腺炎发病率明显增高, 长期慢性发展可导致胰腺内外分泌功能不全, 为患者带来极大的痛苦, 探讨如何抑制慢性胰腺炎患者胰腺组织纤维化, 成为广大学者研究的对象.
韩天权, 教授, 上海交通大学医学院附属瑞金医院外科、上海消化外科研究所; 任粉玉, 副教授, 延边大学附属医院消化内科.
Smad7、PDGF被认为在胰腺纤维化过程中起到重要的信号转导作用. 能否通过改变二者在纤维化胰腺组织中的表达来抑制胰腺纤维化成为目前研究的焦点.
本文旨在研究胰腺组织纤维化过程中Smad7、PDGF-B表达的变化趋势, 及干扰素-α的应用对二者表达的影响.
Smad7、PDGF-B已被证实在胰腺纤维化过程中起重要作用, 而本研究发现干扰素-α可以改变Smad7、PDGF在纤维化胰腺组织中的表达, 为临床上应用干扰素-α抗胰腺纤维化提供重要的理论依据.
胰腺星状细胞: 1982年Watari et al发现了一种胰腺胞质中富含维生素A的细胞, 该细胞可被激活转化为肌纤维母细胞, 能产生Ⅰ、Ⅲ型胶原、纤维结合蛋白和层粘连蛋白等, 位于胰腺小叶间和腺泡周围区, 围绕临近细胞基底部, 与胰腺纤维化有关, 命名为胰腺星状细胞.
本研究选题尚可, 设计合理, 内容重要, 具有较好的理论意义.
编辑: 李军亮 电编:吴鹏朕
| 2. | Jaskiewicz K, Nalecz A, Rzepko R, Sledzinski Z. Immunocytes and activated stellate cells in pancreatic fibrogenesis. Pancreas. 2003;26:239-242. [PubMed] [DOI] |
| 3. | Schneider E, Schmid-Kotsas A, Zhao J, Weidenbach H, Schmid RM, Menke A, Adler G, Waltenberger J, Grünert A, Bachem MG. Identification of mediators stimulating proliferation and matrix synthesis of rat pancreatic stellate cells. Am J Physiol Cell Physiol. 2001;281:C532-C543. [PubMed] |
| 4. | Apte MV, Haber PS, Applegate TL, Norton ID, McCaughan GW, Korsten MA, Pirola RC, Wilson JS. Periacinar stellate shaped cells in rat pancreas: identification, isolation, and culture. Gut. 1998;43:128-133. [PubMed] [DOI] |
| 5. | Dooley S, Delvoux B, Lahme B, Mangasser-Stephan K, Gressner AM. Modulation of transforming growth factor beta response and signaling during transdifferentiation of rat hepatic stellate cells to myofibroblasts. Hepatology. 2000;31:1094-1106. [PubMed] [DOI] |
| 6. | Inagaki Y, Mamura M, Kanamaru Y, Greenwel P, Nemoto T, Takehara K, Ten Dijke P, Nakao A. Constitutive phosphorylation and nuclear localization of Smad3 are correlated with increased collagen gene transcription in activated hepatic stellate cells. J Cell Physiol. 2001;187:117-123. [PubMed] [DOI] |
| 7. | Kuang C, Xiao Y, Liu X, Stringfield TM, Zhang S, Wang Z, Chen Y. In vivo disruption of TGF-beta signaling by Smad7 leads to premalignant ductal lesions in the pancreas. Proc Natl Acad Sci U S A. 2006;103:1858-1863. [PubMed] [DOI] |
| 8. | Heldin CH, Miyazono K, ten Dijke P. TGF-beta signalling from cell membrane to nucleus through SMAD proteins. Nature. 1997;390:465-471. [PubMed] [DOI] |
| 9. | Stopa M, Benes V, Ansorge W, Gressner AM, Dooley S. Genomic locus and promoter region of rat Smad7, an important antagonist of TGFbeta signaling. Mamm Genome. 2000;11:169-176. [PubMed] [DOI] |
| 10. | Hill CS. The Smads. Int J Biochem Cell Biol. 1999;31:1249-1254. [PubMed] [DOI] |
| 11. | Nakao A, Afrakhte M, Morén A, Nakayama T, Christian JL, Heuchel R, Itoh S, Kawabata M, Heldin NE, Heldin CH. Identification of Smad7, a TGFbeta-inducible antagonist of TGF-beta signalling. Nature. 1997;389:631-635. [PubMed] [DOI] |
| 12. | Schiffer M, von Gersdorff G, Bitzer M, Susztak K, Böttinger EP. Smad proteins and transforming growth factor-beta signaling. Kidney Int Suppl. 2000;77:S45-S52. [PubMed] [DOI] |
| 13. | Datta PK, Moses HL. STRAP and Smad7 synergize in the inhibition of transforming growth factor beta signaling. Mol Cell Biol. 2000;20:3157-3167. [PubMed] [DOI] |
| 14. | Kavsak P, Rasmussen RK, Causing CG, Bonni S, Zhu H, Thomsen GH, Wrana JL. Smad7 binds to Smurf2 to form an E3 ubiquitin ligase that targets the TGF beta receptor for degradation. Mol Cell. 2000;6:1365-1375. [PubMed] [DOI] |
| 15. | Tajima Y, Goto K, Yoshida M, Shinomiya K, Sekimoto T, Yoneda Y, Miyazono K, Imamura T. Chromosomal region maintenance 1 (CRM1)-dependent nuclear export of Smad ubiquitin regulatory factor 1 (Smurf1) is essential for negative regulation of transforming growth factor-beta signaling by Smad7. J Biol Chem. 2003;278:10716-10721. [PubMed] [DOI] |
| 16. | Ebisawa T, Fukuchi M, Murakami G, Chiba T, Tanaka K, Imamura T, Miyazono K. Smurf1 interacts with transforming growth factor-beta type I receptor through Smad7 and induces receptor degradation. J Biol Chem. 2001;276:12477-12480. [PubMed] [DOI] |
| 17. | 杨 小艳, 杨 勇, 郑 勇, 李 睿, 周 婷, 孙 凯, 常 向云, 陈 卫刚. 大鼠Smad7真核表达质粒的构建及在肝星状细胞中的表达. 世界华人消化杂志. 2008;16:3146-3151. [PubMed] |
| 18. | 于 鸿, 陈 琦, 刘 晔, 赵 仲华, 郭 慕依. 转染Smad7基因的大鼠肾小球系膜细胞对Ⅰ、Ⅲ型胶原表达的改变. 复旦学报 (医学版). 2008;35:436-440. |
| 19. | de Veer MJ, Holko M, Frevel M, Walker E, Der S, Paranjape JM, Silverman RH, Williams BR. Functional classification of interferon-stimulated genes identified using microarrays. J Leukoc Biol. 2001;69:912-920. [PubMed] |
| 20. | Paajanen H, Laato M, Jaakkola M, Pulkki K, Niinikoski J, Nordback I. Serum tumour necrosis factor compared with C-reactive protein in the early assessment of severity of acute pancreatitis. Br J Surg. 1995;82:271-273. [PubMed] [DOI] |
| 23. | Weng H, Mertens PR, Gressner AM, Dooley S. IFN-gamma abrogates profibrogenic TGF-beta signaling in liver by targeting expression of inhibitory and receptor Smads. J Hepatol. 2007;46:295-303. [PubMed] [DOI] |
| 26. | Hamzavi J, Ehnert S, Godoy P, Ciuclan L, Weng H, Mertens PR, Heuchel R, Dooley S. Disruption of the Smad7 gene enhances CCI4-dependent liver damage and fibrogenesis in mice. J Cell Mol Med. 2008;12:2130-2144. [PubMed] |
| 27. | Marra F, Gentilini A, Pinzani M, Choudhury GG, Parola M, Herbst H, Dianzani MU, Laffi G, Abboud HE, Gentilini P. Phosphatidylinositol 3-kinase is required for platelet-derived growth factor's actions on hepatic stellate cells. Gastroenterology. 1997;112:1297-1306. [PubMed] [DOI] |
| 28. | Luttenberger T, Schmid-Kotsas A, Menke A, Siech M, Beger H, Adler G, Grünert A, Bachem MG. Platelet-derived growth factors stimulate proliferation and extracellular matrix synthesis of pancreatic stellate cells: implications in pathogenesis of pancreas fibrosis. Lab Invest. 2000;80:47-55. [PubMed] [DOI] |
| 29. | Li X, Eriksson U. Novel PDGF family members: PDGF-C and PDGF-D. Cytokine Growth Factor Rev. 2003;14:91-98. [PubMed] [DOI] |
| 31. | Phillips PA, Wu MJ, Kumar RK, Doherty E, McCarroll JA, Park S, Pirola RC, Wilson JS, Apte MV. Cell migration: a novel aspect of pancreatic stellate cell biology. Gut. 2003;52:677-682. [PubMed] [DOI] |
| 32. | Apte MV, Phillips PA, Fahmy RG, Darby SJ, Rodgers SC, McCaughan GW, Korsten MA, Pirola RC, Naidoo D, Wilson JS. Does alcohol directly stimulate pancreatic fibrogenesis? Studies with rat pancreatic stellate cells. Gastroenterology. 2000;118:780-794. [PubMed] [DOI] |