修回日期: 2009-06-15
接受日期: 2009-06-15
在线出版日期: 2009-07-18
目的: 探讨左金丸及反左金丸对大肠癌发生、发展的干预作用, 及在大肠癌不同时期对甲基转移酶表达的影响.
方法: 在180只大鼠左肩胛骨侧皮下注射1, 2-二甲基酰肼(1, 2-DMH)25 mg/kg, 每周1次, 连续注射12 wk. 随机将大鼠分为3组: 左金丸组、反左金丸组和对照组. 从第1次注射DMH的第2天开始, 左金丸组和反左金丸组每天以中药汤剂1.4 g/kg灌胃, 对照组灌服同等体积的生理盐水, 每日1次, 连续34 wk. 分别在第11、21、34周, 每组取部分大鼠脱颈处死, 通过病理学观察左金丸和反左金丸对大鼠大肠癌发生发展的干预作用, 实时荧光定量PCR法检测不同肿瘤发展时期Dnmt1、Dnmt3a及Dnmt3b mRNA的表达.
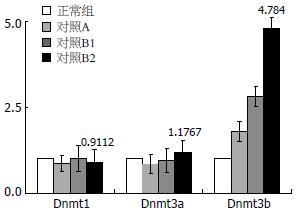
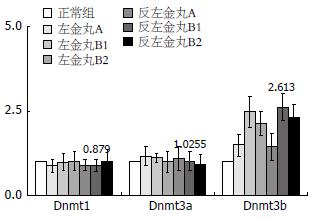
结果: 左金丸和反左金丸均能在肿瘤发生的早期显著抑制癌症的进程, 左金丸作用优于反左金丸, 但后期(34 wk), 二者的作用不明显. 对照组和中药组Dnmt1、Dnmt3a表达没有明显变化. 对照组中Dnmt3b的表达明显高于中药组(4.784 vs 2.613, P<0.01), 且随癌变进程的深入, Dnmt3b表达量增高.
结论: 左金丸和反左金丸均可以有效阻碍早期大肠癌的发生和发展. Dnmt3b参与了组织恶变的过程, 其表达的调控可能是中药干预肿瘤进程的机制之一.
引文著录: 文彬, 熊旻利, 戴伟怡, 梁齐桁, 刘玲, 陈蔚文. 左金丸及反左金丸对实验性大肠癌不同时期甲基转移酶表达的影响. 世界华人消化杂志 2009; 17(20): 2074-2078
Revised: June 15, 2009
Accepted: June 15, 2009
Published online: July 18, 2009
AIM: To investigate the intervention effect of Zuojin Pill and Fanzuojin Pill on the development and progression of colorectal carcinoma, and examine their effects on the expression of methyltransferase expression in colorectal carcinoma at different stages.
METHODS: Rats were given a subcutaneous injection of DMH (25 mg/kg; once a week for 12 weeks) to establish a rat model of colorectal carcinoma. The rats were then randomly divided into Zuojin Pill group (i.g., 1.4 g/kg, once a day), Fanzuojin Pill group (i.g., 1.4 g/kg, once a day) and control group (i.g., 0.9% NaCl, once a day). The rats in each group were killed at weeks 11, 21 and 34 after treatment, respectively. The intervention effect of Zuojin Pill and Fanzuojin Pill on the development and progression of colorectal carcinoma was evaluated by pathological examination. The expression of methyltransferase in colorectal carcinoma at different stages was detected by real-time fluorescent quantitative PCR.
RESULTS: Zuojin Pill and Fanzuojin Pill could effectively suppress the early development of rat colorectal carcinoma induced by DMH though they had no obvious suppressing effects against the late progression of colorectal carcinoma. In the control group and two treatment groups, the expression levels of Dnmt1 and Dnmt3a did not change significantly. However, the expression level of Dnmt3b in the positive control group was significantly higher than those in the two treatment groups (4.784 vs 2.613, P < 0.01). In addition, the expression level of Dnmt3b was gradually elevated as the carcinoma progressed.
CONCLUSION: Zuojin Pill and Fanzuojin Pill can effectively hinder the early development of rat colorectal carcinoma induced by DMH. Dnmt3b is involved in the process of malignant transformation of and rat colorectal carcinoma, which may explain the intervention effects of Zuojin Pill and Fanzuojin Pill.
- Citation: Wen B, Xiong ML, Dai WY, Liang QH, Liu L, Chen WW. Effects of Zuojin Pill and Fanzuojin Pill on the expression of methyltransferase in rats with experimental colorectal carcinoma at different stages. Shijie Huaren Xiaohua Zazhi 2009; 17(20): 2074-2078
- URL: https://www.wjgnet.com/1009-3079/full/v17/i20/2074.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i20.2074
DNA甲基化异常是肿瘤发生的一条重要的机制[1-3]. DNA甲基化异常易引起细胞功能异常, 这可能是向癌变迈进的第1步. 对癌旁组织的研究发现, 癌基因低甲基化在癌症发生之前就已存在, 并且低甲基化状态更易引起肿瘤的浸润和转移. 在哺乳动物细胞中, Dnmts是催化DNA甲基化的主要酶类. 从1991年至今, 人类Dnmt家族中已发现并克隆的成员有: Dnmt1、Dnmt2、Dnmt3(Dnmt3a和Dnmt3b). 迄今, 对Dnmts与肿瘤的关系研究最早且最深入的是其与结肠癌发生、发展的关系[4]. 我们研究小组对黄连、吴茱萸、青黛为主药的加味左金丸(复方连黛片)及其主要成分盐酸小檗碱、靛玉红和吴茱萸碱防治胃肠癌的药理作用及临床已进行了10余年的研究, 左金丸最早收录于《丹溪心法》, 由黄连、吴茱萸按6:1配比组成, 黄连苦寒, 清心泻肝, 吴茱萸辛热, 引热下行, 二药一主一辅, 一寒一热, 相反相成, 反左金丸是后世受左金丸启发而创制, 由黄连、吴茱萸按1:6组成. 现代药理学研究表明, 左金丸对消化系统有广泛的镇痛、抗炎、抑菌, 抗溃疡等作用, 在抗肿瘤方面的研究表明黄连素(小檗碱)和吴茱萸碱均可阻断促癌物质对潜在癌变细胞的作用[5-6]. 我们这些年的研究发现, 黄连素(小檗碱)和吴茱萸(吴茱萸碱)能降低MNNG诱发大鼠胃及十二指肠癌的发生, 减轻病理损伤, 明显抑制癌细胞的增殖, 促进细胞分化, 降低肿瘤转移, 抑制一些癌基因的表达[7-14]等. 本研究采用DMH诱导大鼠大肠癌, 观察中药左金丸和反左金丸对大肠癌发生发展进程的干预作用, 并选择具有甲基转移活性的Dnmt1、Dnmt3a、Dnmt3b作为研究对象, 用实时荧光定量RT-PCR技术检测, 在中药左金丸和反左金丸干预下, DMH诱导大鼠大肠癌过程中, 肿瘤发展不同时期甲基转移酶表达情况.
黄连和吴茱萸购自广州中医药大学第一附属医院, 1, 2-二甲基酰肼(1, 2-DMH)购自美国Sigma公司, TRIzol, Invitrogen(Cat. No. 15596-018), First Strand cDNA Synthesis Kit: GeneCopoeia(Cat. No. C0210A), 2×AllinOneTM Q-PCR Mix: GeneCopoeia(Cat. No. D0101A), SPF级健康Wistar大鼠均购于并饲养于广州中医药大学动物中心(动物合格证号分别为: 0014754, 0017087).
1.2.1 DMH诱导Wistar大鼠大肠癌实验模型制作: DMH诱导大鼠大肠癌模型主要参考Noguera Aguilar et al[15]2005年的研究报告. 健康雌雄各半Wistar大鼠共180只, 体质量180-220 g, 在每只大鼠左肩胛骨侧皮下注射1, 2-DMH 25 mg/kg, 每周1次, 连续注射12 wk. 随机将其分为3小组: 对照组、左金丸组和反左金丸组. 从第1次注射DMH第2天开始, 左金丸组和反左金丸组每天以中药汤剂1.4 g/kg灌胃, 对照组灌服同等体积的生理盐水, 每日1次, 连续34 wk.
1.2.2 标本的采集: 从灌胃11 wk开始, 分批处死大鼠, 开腹分离整段大肠, 剖开, 冰冻生理盐水冲洗干净, 平展于过滤白纸上, 描述并记录肠上皮形态变化(包括息肉数量、颜色、部位、大小形态), 切取肉眼所见表皮发生变化或病变部位(含周围相当于息肉直径范围肠组织), 用40 g/L的中性甲醛溶液固定后, 常规脱水、浸蜡、透明、包埋, 切片, 做病理学观察, 其余病变部位组织迅速冷冻于液氮中, 后转至-70℃冰箱保存, 留待检测, 结肠组织病理形态学观察: 切片HE染色后以Olympus显微镜观察并拍照.
1.2.3 病理分级: 采用改良的Dukes[16]大肠癌分期及预后分期标准: A: 肿瘤限于黏膜层(重度上皮内瘤变); B1: 肿瘤侵及肌层, 但未穿透, 无淋巴结转移; B2: 肿瘤穿透肌层, 但无淋巴结转移; C1: 肿瘤未穿透肌层, 但有区域性无血管根部淋巴结转移; C2: 肿瘤穿透肠壁, 并伴有肠系膜淋巴结转移; D: 有远隔脏器转移.
1.2.4 引物的设计及合成: 根据Dnmt1、Dnmt3a和Dnmt3b基因序列(GenBank NM_053354, NM_001003957, NM_001003959), 用Primer Express Software V2.0设计引物. 引物序列及拟扩增片段送至NCBI BLAST数据库检测特异性. 基因序列及反应条件见表1(引物由广州复能基因公司合成).
| 基因 | 引物 | 退火温度(℃) | 循环数 | 扩增片段长度(bp) |
| Dnmt1 | 5'-Tgtctgtcctgcggtaagaa-3' | 59 | 35 | 130 |
| 5'-ctgatagccgtcctcatcgt-3' | ||||
| Dnmt3a | 5'-Gtgatgatcgacgccaaag-3' | 60 | 35 | 110 |
| 5'-tccagcttatcattcacagtgg-3' | ||||
| Dnmt3b | 5'-Gatgatcgacgccatcaag-3' | 60 | 35 | 123 |
| 5'-cgagcttatcattctttgaagcta-3' |
1.2.5 实时荧光定量PCR检测: (1)总RNA的提取: 取大鼠癌肿组织常规TRIzol法提取总RNA. (2)cDNA第一链合成: 每个样品取总RNA 1 μg, 加入Random Primer 10 μmol/L, 加DEPC水至总体积13 μL, 65℃变性10 min后, 加入反转录反应液(含5×RT Reaction Buffer 5 μL, dNTP 1 mmol/L, RNase Inhibitor 1 U/μL, M-MLV RTase 8 U/μL, DEPC水4 μL, 总体积25 μL), 短暂离心后37℃孵育1 h, 反应结束后, 85℃灭活处理5 min, 最后-20℃保存反转录产物. (3)定量PCR实验: 采用染料法(SYBR GreenⅠ)进行相对定量分析, 实验设计是按照ΔΔCt解析法来进行设计. 将2×AllinOneTM Q-PCR Mix在室温下融解, 轻柔得上下颠倒混匀并进行短暂离心(同时在使用过程中始终保持避光). PCR Reaction Mix的制备: 2×AllinOneTM Q-PCR Mix 10 μL, ddH2O 2 μL, PCR Forward Primer(4 μmol/L)2 μL, PCR Reverse Primer(4 μmol/L)2 μL, cDNA(1:5 diluted), 总体积20 μL. 实验以NTC(No Template Control)为阴性对照, 即在反应中用水来代替模板cDNA, 其他试剂不变, 从而来质控是否体系有污染. 迅速将PCR Reaction Mix稍混匀, 并加入96孔板中. 将96孔板进行短暂离心, 确保所有反应液在反应孔底部. 采用了标准的三步法程序进行PCR反应, 反应后进行熔解曲线分析. (4)反应结果: 根据建立的标准曲线对标本中的Dnmts与管家基因GAPDH进行定量.经条件优化, Ct值与拷贝数的对数值具有密切的相关性(r>0.99), 并且每个基因的扩增都达到了较高的效率, 其余几个基因的标准曲线的结果均显示一致系数R2接近1.000, 可用于计算表达量. RT-PCR扩增结束后, 将所得未知样品的目的基因扩增曲线图的阈值设定为所得的标准曲线阈值而得到相对应的Ct值, 同时为了把目的基因统一化到相同样品数的比较, 减少由于样品数量差异和抽提RNA得率差异所引起的误差, 同样条件下做管家基因的表达, 得到作为内参照的管家基因GAPDH在同一阈值下的Ct值, 通过标准曲线的公式计算在同一条件下的目的基因和管家基因的表达量, 用目的基因表达量/管家基因的表达量得到相对较真实的样品基因的表达量, 然后通过统计画表得到统计用柱状分析图.
统计学处理 数据处理采用SPSS11.5统计软件, 单因素分析用t检验. 以P<0.05为有统计学差异.
在DMH诱导肿瘤的早期(11 wk), 我们观察到, 左金丸组可以有效地阻断肿瘤的发生, 20只大鼠无1例发生癌变, 反左金丸组有2只大鼠检出处于A期的肿瘤, 发病率为10%, 反左金丸的效应略低于左金丸, 2组癌变率均显著低于对照组(20%, P<0.01). 21 wk时, 左金丸组(14.3%)和反左金丸(25%)组均能有效阻碍肿瘤的进程(P<0.01), 肿瘤的发生率均明显低于对照组(50%, P<0.01), 但到了34 wk, 左金丸组和反左金丸组与对照组的肿瘤发生率无明显差别(依次为70%、62.5%、66.7%, 表2).
从表2病理检测结果可以看出, 直到34 wk, 大多数发生癌变的组织都处于A、B1、B2期, 因此, 我们只取这3个时期的大鼠进行Dnmt1、Dnmt3a、Dnmt3b表达分析. 结果表明, 无论在正常组织中, 还是在癌变组织中, Dnmt1和Dnmt3a表达无明显变化, 只有Dnmt3b表达差异较大, 且随着肿瘤的恶化的程度而表达量明显升高, B2期的表达量高于B1期(图1).
从结果(图2)我们可以看到, Dnmt1和Dnmt3a的表达情况与上面对照组的情况类似: 正常组、中药干预组, Dnmt1和Dnmt3a的表达变化不明显, 而Dnmt3b表达变化较大, 在中药处理组中, B1、B2期的表达量高于A期. 环比中药处理组和对照组, 我们发现, 中药处理组Dnmt3b整体表达量(2.613)低于对照组(4.784)(P<0.01), 且中药组B1与B2期的Dnmt3b表达量相比略有下降, 统计学上表达差异不明显(P>0.05).
对药是中药配伍中的最小单位, 为历代医家所重视. 吴茱萸和黄连作为对药配伍的历史非常悠久, 早在北宋《太平圣惠方•治水泻诸方》中就载有茱萸原方, 由黄连和吴茱萸(1:1)组成. 陈蔚文 et al[17]发现黄连与吴茱萸配伍比例及提取方法对主要有效成分有影响. 陈艳芬 et al[18]通过寒热胃模型从实验上证实了左金丸与反左金丸在胃黏膜损伤中的选择性. 在离体实验中, 我们发现小檗碱和吴茱萸碱都表现出同样的抑制HT29细胞增殖、诱导HT29细胞凋亡的效应[13-14], 但在DMH诱导大鼠大肠癌活体实验中, 左金丸和反左金丸虽然均能在肿瘤发生早期起到阻碍作用, 但效应不同, 这尚需要进一步的研究, 从最简单的对药开始研究中药的配伍或许是一条最为有效的途径.
在哺乳动物细胞中, Dnmts是催化DNA甲基化的主要酶类. 同时Dnmts也是外源化学物作用的靶点, 外源化学物通过改变Dnmts的表达水平和酶的活力, 影响DNA的甲基化和表观遗传的调节功能. 近年来研究发现Dnmts的表达异常与疾病如肿瘤的发生发展密切关联, DNA甲基化作用的发生和甲基化水平的高低主要取决于DNA甲基转移酶及其相关蛋白. 一旦甲基转移酶表达异常就会发生基因突变, 细胞分化异常. 参与DNA甲基化的DNA甲基转移酶家族分为Dnmt1、Dnmt2、Dnmt3, 其中Dnmt3又分为Dnmt3a、Dnmt3b、Dnmt3L. 目前研究发现Dnmt1、Dnmt3a及Dnmt3b在正常组织中普遍呈低表达; 而他们在多种实体肿瘤和造血系统肿瘤中高表达, 尤其是Dnmt3b, 与此同时伴有酶活性的升高, 提示他与肿瘤的关系更为密切, 且3种酶在肿瘤发生、发展过程中具有协同作用[19-22]. Issa et al[4]研究结果显示: 11例良性多发大肠息肉的Dnmt1活性较对照组高1.4倍, 较15例大肠癌病变附近未受侵袭的肠黏膜高1.6倍, 而较结肠癌病变处则高5.4倍. 其中1例患者同时患有大肠癌及良性多发息肉, 对其未受损黏膜、良性息肉的黏膜与癌黏膜进行酶活性测定, 结果与正常对照相比, 依次增高1.7、2.7和5.3倍. 在我们的研究中, 我们发现, 无论是对照组还是中药组, 相对于正常组织, Dnmt1和Dnmt3a表达的组间差异不明显, Dnmt3b有较大差异, 且Dnmt3b在对照组中表达量高于中药组. 我们还发现, 经中药处理过的组织样本, Dnmt3b表达量在B1、B2期差异不明显, 而对照中B2期Dnmt3b表达量显著高于B1期, 这可能是中药的干预作用的结果, 虽然甲基化在肿瘤的发生发展中起重要作用, 但也不是唯一的途径, 而中药对DMH诱导肿瘤过程中的阻碍作用可能是通过影响了多条肿瘤发生途径而实现. 其次, 这也有可能是样本量不足, 这还需要进一步研究.
左金丸最早收录于《丹溪心法》, 由黄连、吴茱萸按6:1配比组成, 黄连苦寒, 清心泻肝, 吴茱萸辛热, 引热下行, 二药一主一辅, 一寒一热, 相反相成, 反左金丸是后世受左金丸启发而创制, 由黄连、吴茱萸按1:6组成. 现代药理学研究表明, 左金丸对消化系统有广泛的镇痛、抗炎、抑菌, 抗溃疡等作用, 在抗肿瘤方面的研究表明黄连素(小檗碱)和吴茱萸碱均可阻断促癌物质对潜在癌变细胞的作用.
黄颖秋, 教授, 本溪钢铁(集团)有限责任公司总医院消化内科; 李勇, 副教授, 上海中医药大学附属市中医医院消化科
在DMH诱导大鼠大肠癌活体实验中, 左金丸和反左金丸虽然均能在肿瘤发生早期起到阻碍作用, 但效应不同, 这尚需要进一步的研究, 从最简单的对药开始研究中药的配伍或许是一条最为有效的途径.
陈蔚文 et al发现黄连与吴茱萸配伍比例及提取方法对主要有效成分有影响. 陈艳芬 et al通过寒热胃模型从实验上证实了左金丸与反左金丸在胃黏膜损伤中的选择性.
左金丸和反左金丸均可以有效阻碍早期大肠癌的发生和发展.
本研究目的明确, 实验设计较合理, 实验结论也较客观、明确, 有一定的研究价值.
编辑: 李军亮 电编:何基才
| 1. | Jones PA, Baylin SB. The fundamental role of epigenetic events in cancer. Nat Rev Genet. 2002;3:415-428. [PubMed] |
| 2. | Esteller M, Herman JG. Cancer as an epigenetic disease: DNA methylation and chromatin alterations in human tumours. J Pathol. 2002;196:1-7. [PubMed] [DOI] |
| 3. | Esteller M. Relevance of DNA methylation in the management of cancer. Lancet Oncol. 2003;4:351-358. [PubMed] [DOI] |
| 4. | Issa JP, Vertino PM, Wu J, Sazawal S, Celano P, Nelkin BD, Hamilton SR, Baylin SB. Increased cytosine DNA-methyltransferase activity during colon cancer progression. J Natl Cancer Inst. 1993;85:1235-1240. [PubMed] [DOI] |
| 10. | 陈 蔚文, 李 茹柳, 徐 勤, 叶 富强, 徐 颂芬, 潘 怀耿, 赵 军宁, 王 建华. 连黛片抗大鼠胃癌及对p21ras, c-erbB2, Rb和p53基因蛋白表达的影响. 中国中西医结合杂志. 1998;18:265-267, 407. |
| 15. | Noguera Aguilar JF, Amengual Antich I, Plaza Martínez A, Ibarra de la Rosa J, Tortajada Collado C, Gamundí Gamundí A, Pujol Tugores JJ. Cyclooxygenase-2 inhibition in colon experimental carcinogenesis. Rev Esp Enferm Dig. 2005;97:637-647. [PubMed] |
| 19. | Rhee I, Bachman KE, Park BH, Jair KW, Yen RW, Schuebel KE, Cui H, Feinberg AP, Lengauer C, Kinzler KW. DNMT1 and DNMT3b cooperate to silence genes in human cancer cells. Nature. 2002;416:552-556. [PubMed] [DOI] |
| 20. | Girault I, Tozlu S, Lidereau R, Bièche I. Expression analysis of DNA methyltransferases 1, 3A, and 3B in sporadic breast carcinomas. Clin Cancer Res. 2003;9:4415-4422. [PubMed] |
| 21. | Kim GD, Ni J, Kelesoglu N, Roberts RJ, Pradhan S. Co-operation and communication between the human maintenance and de novo DNA (cytosine-5) methyltransferases. EMBO J. 2002;21:4183-4195. [PubMed] [DOI] |
| 22. | Beaulieu N, Morin S, Chute IC, Robert MF, Nguyen H, MacLeod AR. An essential role for DNA methyltransferase DNMT3B in cancer cell survival. J Biol Chem. 2002;277:28176-28181. [PubMed] [DOI] |