修回日期: 2008-12-09
接受日期: 2008-12-15
在线出版日期: 2009-01-18
目的: 探讨溃疡性结肠炎(ulcerative colitis, UC)患者肠黏膜活检组织中NF-κB的表达及其与细胞因子水平的关系.
方法: 用免疫组化SP方法检测60例活动期UC内镜活检标本及30例正常对照石蜡组织中NF-κB表达情况, 同时用放免法检测UC组和正常对照组血清中IL-1β, TNF-α和IL-10的表达水平.
结果: 60例UC组中NF-κB p65均为阳性表达, 主要分布在结肠黏膜上皮细胞、腺上皮细胞和巨噬细胞. 对照组均为阴性和弱阳性表达, 主要分布于上皮细胞. UC组的NF-κB p65表达平均灰度值与正常对照组比较差异有显著性(166.62±14.88 vs142.30±19.01, P<0.05); 活动期UC组血清中IL-1β、TNF-α表达水平显著高于正常对照组(1.29±0.36 vs 1.29±0.36, 4.47±1.08 vs 1.37±0.26, 均P<0.01), 而IL-10表达水平二组间差异无统计学意义. NF-κB p65的表达与活动期UC病情活动性及内镜分级有相关性(P<0.05或0.01).
结论: NF-κB诱导、参与了UC的发生、发展过程, 并与UC病情活动性及内镜分级有较好相关性, 可客观反应UC的炎症活动情况; 促炎细胞因子IL-1β、TNF-α与抑炎性细胞因子IL-10的表达水平不一致, 可能与NF-κB诱导调控有直接关系.
引文著录: 陈吉, 高美丽, 白晓茹, 崔宏, 王觅柱. 核因子-κB和细胞因子在溃疡性结肠炎中的表达及其意义. 世界华人消化杂志 2009; 17(2): 209-212
Revised: December 9, 2008
Accepted: December 15, 2008
Published online: January 18, 2009
AIM: To investigate the expressions of nuclear factor-KappaB (NF-κB), interleukin-1β (IL-1β), tumor necrosis factor-α (TNF-α) and inter-leukin-10 (IL-10), and to explore the role of those molecules in ulcerative colitis (UC).
METHODS: Thirty outpatients were taken as controls and 60 patients with active UC were recruited after colonscopy. The expression of NF-κB in colonic tissues was detected by immuno-histochemistry. The serum concentration of IL-1β, TNF-α and IL-10 were also measured.
RESULTS: NF-κB p65 was positively expressed in all the tissues, mainly in epithelial cells, and also inflammatory cells in lamina propria, while it was negatively expressed or weakly positive in controls, mainly in epithelial cells. Their expression was significantly higher in UC tissues than in controls (166.62 ± 14.88 vs 142.30 ± 19.01, P < 0.05). The concentrations of IL-1β and TNF-α were significantly higher in active UC patients than in controls (1.29 ± 0.36 vs 1.29 ± 0.36, 4.47 ± 1.08 vs 1.37 ± 0.26, both P < 0.01). The expression of NF-κB p65 was related to active grade and endoscopic classification (P < 0.05 or 0.01).
CONCLUSION: The expression of NF-κB and cytokines may be involved in the pathogenesis of UC, and their levels reflect the disease activity in UC. The expression of preinflammatory cytokines may be modulated by NF-κB.
- Citation: Chen J, Gao ML, Bai XR, Cui H, Wang MZ. Expression of NF-κB and cytokines in human ulcerative colitis and its significance. Shijie Huaren Xiaohua Zazhi 2009; 17(2): 209-212
- URL: https://www.wjgnet.com/1009-3079/full/v17/i2/209.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i2.209
溃疡性结肠炎(ulcerative colitis, UC)是一种原因尚不明确的大肠黏膜慢性炎症和溃疡性病变, 本病在我国发病率呈上升趋势[1]. 近年来, 随着对核因子(nuclear factor kappa B, NF-κB)结构和功能研究的深入, 发现NF-κB是一种转录因子, 广泛存在于各种组织中, 在免疫和炎症反应、细胞生长、病毒感染及其某些疾病急性期反应方面起重要作用[2]. 许多研究证实, 免疫反应的异常是造成UC炎症和组织损伤的内在重要因素, 而细胞因子又在介导这一异常的免疫反应中起重要作用[3], 许多与此密切相关的细胞因子基因启动子或增强子部位均有κB位点, NF-κB在核内与κB序列结合促进各种炎性细胞因子如IL-1β, IL-2, IL-10, TNF-α等基因转录[4], 所以NF-κB活化可能是UC发生发展的关键点. 本实验测定活动期UC患者大肠黏膜NF-κB表达水平及血清中细胞因子IL-1β, TNF-α及IL-10水平含量, 探讨NF-κB在UC发病机制中的作用和作为UC活动性指标的临床价值, 及其与细胞因子的相关性.
溃疡性结肠炎诊断标准: 2007-05在济南召开的第七次全国消化病学术会议上中华医学会消化病学分会炎症性肠病协作组制定的"对我国炎症性肠病诊断治疗规范的共识意见"[6]. 选择2005-07/2007-09在我院门诊及住院经结肠镜检查确诊为UC的患者60例, 其中男34例, 女26例, 年龄21-80(平均49.51±1.82)岁. 所有病例均为活动期, 按Truelove-Witts标准进行病情程度分级[5]: 轻度19例, 中度22例, 重度19例; 采用Truelove内镜分级标准[5]将UC患者分为Ⅰ级15例, Ⅱ级27例, Ⅲ级18例. 同时设立正常对照组30例, 为健康体检者或结肠镜检查正常者, 并排除其他疾患者. 主要试剂及仪器: 兔抗人NF-κB p65多克隆抗体购自Neomarkers公司, SP试剂盒、DAB显色剂、EDTA修复液(1 mmol/L, pH6.0)、IL-1β、TNF-α和IL-10放射免疫分析(RIA)试剂盒购自北京福瑞生物工程公司; Olympus CF-H260电子结肠镜(日本), 德国Leica-DM1000光学显微镜及德国Leica-RM2016石蜡切片机, 北京泰康弘达科贸有限公司, 国产常州TSJ-Ⅲ全自动Y放射免疫计数器.
1.2.1 标本收集: UC组病例全部进行结肠镜检查并取活检, 在炎症最严重部位取活检至少2块, 正常对照组选择距肛门20 cm处结肠取活检. UC组患者均在凌晨空腹抽取静脉血5 mL, 离心后取其血清, 立即放置于-20℃冰箱中保存, 待检测细胞因子.
1.2.2 免疫组化检测步骤: 组织切片脱腊至水30 mL/L H2O2浸泡, 37℃ 15 min, PBS冲洗, 置EDTA抗原修复液中, 95℃ 10 min, 自然冷却至室温, PBS冲洗, 滴加8滴免疫性动物血清, 37℃ 15 min, 滴加兔抗人NF-κB p65多克隆抗体, 4℃过夜, 37℃复温60 min, PBS冲洗, 生物素标记2次, 37℃ 12 min, PBS冲洗; 链霉素抗生物素蛋白-过氧化酶工作液, 37℃孵育12 min, PBS冲洗, DAB溶液显色, 冲洗, 苏木素复染, 脱水, 中性树脂封片, PBS代替一抗作阴性对照.
1.2.3 血液实验室检查: 采用放射免疫法, 按说明书程序操作检测UC组和正常对照组IL-1β、TNF-α和IL-10血清水平.
1.2.4 结果判断: 所有切片均在同一条件的光学显微镜下观察, 结果以胞核或胞质中发现棕黄色或褐色颗粒状物为阳性细胞(NF-κB p65), 每张切片随机取5个不重复的视野, 应用图象分析系统进行扫描分析, 取其灰度值的均值作为该切片的实验结果. 阴性对照应无棕黄色反应产物. 细胞因子测定结果, 由全自动Y放射免疫计数器预先编制程序, 直接给出有关参数、标准曲线及样品浓度.
统计学处理 采用SPSS11.5统计软件处理其数据资料, 结果以mean±SD表示, 进行t检验, 相关分析采用Pearson法.
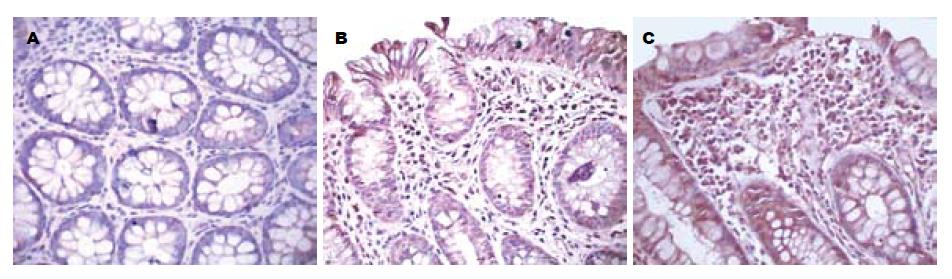
UC组结肠黏膜上皮细胞、腺上皮细胞、固有层单核细胞, 巨噬细胞NF-κB p65表达较强, 且上皮呈连续性, 阳性细胞胞质和胞核都含有棕色颗粒. 正常对照组结肠黏膜见散在的结肠上皮细胞、腺上皮细胞有NF-κB p65表达(图1); UC组的NF-κB p65表达平均灰度值与正常对照组比较差异有显著性(P<0.05, 表1).
在UC组中, IL-1β、TNF-α表达高于正常对照组(P<0.01), IL-10表达与正常对照组无统计学意义(表1).
迄今为止, UC的特异性致病因素和发病机制仍未明确, 细胞因子在UC发病中的作用已得到公认. 近年研究发现NF-κB调控UC患者细胞因子的释放, 从而参与了UC肠道的炎症和免疫反应, 提示NF-κB与UC关系密切[7-8], NF-κB在IBD的发生发展中占举足轻重的地位[9].
NF-κB作为调节细胞基因转录的关键因子, 广泛存在于各种组织中, 能与许多细胞基因的启动子和增强子中的κB转录序列发生特异性结合, 转录因子NF-κB家族组成的二聚体复合物, 参与众多免疫炎症反应有关的基因转录调控以及细胞凋亡、肿瘤细胞的黏附和转移等多种生理病理过程的基因调控, NF-κB可调控任何含有κB位点的基因转录, 包括细胞因子及其受体、促进或抑制凋亡蛋白、急性期反应蛋白、趋化分子、酶分子、转录因子等[10]. 对IBD起主要致病作用的细胞因子如IL-1β、TNF-α、IL-10等在转录水平由NF-κB调控[11-12]. 本研究通过免疫组织化学染色法检测NF-κB表达活性, 结果发现, NF-κB染色多位于肠黏膜腺上皮细胞胞质, 少数位于胞核, 胞质与胞核中出现棕黄色或褐色颗粒状物, 推测这种表达是NF-κB p65的活性形式, UC患者NF-κB表达水平明显增强. 在水肿区、临近溃疡区的表面上皮、隐窝脓肿的隐窝上皮及上皮增生处表达明显, 且与病情活动性及内镜分级有相关性, 而NF-κB p65在正常组织无或低表达. 这表明NF-κB的诱导与UC的发生和发展密切相关[12], 而且其表达水平与UC病情活动性及内镜分级密切相关, 实时地反映了UC活动情况, 而通过检测其表达水平的强度, 亦有助于判断病变处于活动期或缓解期以及病情活动程度.
近年研究发现, 在UC发病机制中免疫因素起主要作用, 细胞因子在调节肠道免疫中扮演重要角色, 他们分为促炎细胞因子与抑炎细胞因子, IL-1β和TNF-α是激活免疫和炎症细胞重要的促炎性细胞因子, 同时, IL-10抑制炎症的作用也十分明显, 而且UC结肠黏膜中细胞因子变化与其血清中变化基本一致[13]. 本实验选取了IL-1β、TNF-α这两种促炎性细胞因子和抑炎性细胞因子IL-10作为实验观察指标, 结果显示, IL-1β、TNF-α在UC组的表达显著高于正常对照组, 并随着病情活动度的加重和内镜下分级的增加而显著增高, 而抑炎性细胞因子IL-10表达水平在UC组与正常对照组间比较, 差别没有统计学意义. 促炎性细胞因子通过免疫上调和促进炎症活性而加重肠道黏膜的炎症反应和组织损伤, 而抑炎性细胞因子通过抑制上述多环节来发挥保护效应[14].
本研究中促炎细胞因子与抑炎细胞因子表达水平不同步, 提示在UC的发病过程中, 可能存在着细胞因子与网络的平衡失调, 肠道炎症的启动及慢性化可能与促炎和抑炎性细胞因子的失衡有关[15]. 而且UC组织中细胞因子IL-1β、TNF-α表达与病情活动性及内镜下严重度分级呈相关性, 可能反映活动期炎症程度的连续变化, 可作为UC活动性监测的指标.
我们的研究表明, NF-κB在UC发病中有重要地位, 他参与了一系列免疫炎症反应有关的基因转录控制, 其表达水平对促炎性和抑炎性细胞因子的表达调控有重要意义, 并与UC的病情活动性密切相关, 通过检测其表达水平的强度及检测血中IL-1β、TNF-α水平对UC患者的病情进行评估及治疗效果的判断, 可能具有潜在指导作用. 这说明NF-κB在UC的疾病活动中可能起到枢纽作用, 当然, NF-κB调控促炎性细胞因子的途径并不是UC的唯一发病机制, 复杂因素及转录因子间相互作用, 有待我们进一步去研究, 从而设计出更为有效的治疗方法.
溃疡性结肠炎是近期发病率上升较快的疾病之一, 有恶变趋势, 病变进展快, 因而临床需要更多更好的检测手段来评价预后、指导治疗.
杜群, 副研究员, 广州中医药大学脾胃研究所药理室; 江学良, 主任医师, 中国人民解放军济南军区总医院消化科
目前在临床上, 没有根治溃疡性结肠炎的特效药物. 因而从新的方面寻找溃疡性结肠炎治疗靶点已成为一个研究热点. 通过研究核因子-κB在溃疡性结肠炎发病中的作用, 寻找可能的溃疡性结肠炎的致病环节, 为溃疡性结肠炎的治疗提供理论依据.
本研究发现UC组织中细胞因子IL-1β、TNF-α表达与病情活动性及内镜下严重度分级呈相关性, 可能反映活动期炎症程度的连续变化, 可作为UC活动性监测的指标.
本文对核因子-κB和细胞因子在溃疡性结肠炎中的表达及其意义进行进行研究, 具有一定临床意义.
编辑: 史景红 电编:吴鹏朕
| 1. | Jiang XL, Cui HF. An analysis of 10218 ulcerative colitis cases in China. World J Gastroenterol. 2002;8:158-161. [PubMed] |
| 3. | Schreiber S, Raedler A, Stenson WF, MacDermott RP. The role of the mucosal immune system in inflammatory bowel disease. Gastroenterol Clin North Am. 1992;21:451-502. [PubMed] |
| 4. | Li MC, He SH. IL-10 and its related cytokines for treatment of inflammatory bowel disease. World J Gastroenterol. 2004;10:620-625. [PubMed] |
| 5. | TRUELOVE SC, WITTS LJ. Cortisone in ulcerative colitis; final report on a therapeutic trial. Br Med J. 1955;2:1041-1048. [PubMed] |
| 7. | Schreiber S, Nikolaus S, Hampe J. Activation of nuclear factor kappa B inflammatory bowel disease. Gut. 1998;42:477-484. [PubMed] |
| 8. | Neurath MF. Pathogenesis of inflammatory bowel disease: transcription factors in the spotlight. Gut. 1998;42:458-459. [PubMed] |
| 9. | 李 可, 邓 长生, 朱 尤庆. NF-κB与炎症性肠病. 国外医学·消化系疾病分册. 2003;23:94-96. |
| 10. | Schmid RM, Adler G. NF-kappaB/rel/IkappaB: implications in gastrointestinal diseases. Gastroenterology. 2000;118:1208-1228. [PubMed] [DOI] |
| 11. | Moynagh PN. The NF-kappaB pathway. J Cell Sci. 2005;118:4589-4592. [PubMed] [DOI] |
| 13. | Goetzl EJ, Burrall BA, Baud L, Scriven KH, Levine JD, Koo CH. Generation and recognition of leukotriene mediators of hypersensitivity and inflammation. Dig Dis Sci. 1988;33:36S-40S. [PubMed] [DOI] |
| 14. | Castro-Santos P, Suarez A, López-Rivas L, Mozo L, Gutierrez C. TNFalpha and IL-10 gene polymorphisms in inflammatory bowel disease. Association of -1082 AA low producer IL-10 genotype with steroid dependency. Am J Gastroenterol. 2006;101:039-1047. [PubMed] |
| 15. | Fiocchi C. Inflammatory bowel disease: etiology and pathogenesis. Gastroenterology. 1998;115:182-205. [PubMed] [DOI] |