修回日期: 2008-12-13
接受日期: 2008-12-15
在线出版日期: 2009-01-18
目的: 观察硼替佐米对HCT8细胞增殖、凋亡及黏附能力的影响.
方法: 不同浓度梯度(12.5-200 nmol/L)的硼替佐米作用于HCT8细胞后, 用MTT检测细胞增殖抑制作用; 25 nmol/L的硼替佐米作用48 h后, 流式细胞仪检测细胞周期和凋亡率; Western blot检测E-cadherin、β-catenin、cyclinD1和NF-κB表达.
结果: 硼替佐米对HCT8细胞的增殖抑制作用有时间和浓度的依赖性. 25 nmol/L的硼替佐米作用48 h诱导细胞的凋亡, 凋亡率为12.3%, 显著高于对照组(P<0.05), 上调了E-cadherin 和β-catenin蛋白的表达, 下降了NF-κB和cyclinD1蛋白的表达.
结论: 硼替佐米可以抑制HCT8细胞的增殖, 诱导细胞凋亡. 抑制NF-κB通路的激活有可能为其作用机制之一; 并有可能增加细胞之间的黏附, 降低肿瘤的远处转移.
引文著录: 陶海云, 李克, 樊青霞. 硼替佐米对HCT8细胞增殖、凋亡及黏附能力的影响. 世界华人消化杂志 2009; 17(2): 190-193
Revised: December 13, 2008
Accepted: December 15, 2008
Published online: January 18, 2009
AIM: To study the effect of bortezomib on growth arrest, proliferation and adhesive ability of HCT8 cells in vitro.
METHODS: The growth arrest by bortezomib at different concentration was determined using MTT. After exposure of HCT8 cells to a lower concentration of bortezomib (25 nmol/L) for 48 h, cell cycle and the apoptosis were assessed by FCM; and the expressions of E-cadherin, β-catenin, cyclinD1 and NF-κB were detected using Western blot.
RESULTS: The inhibitory effect of bortezomib on the proliferation of HCT8 cells showed a time- and dose-dependent relationship. Compared with control group, bortezomib induced apoptosis significantly after 48 h treatment at the concentration of 25 nmol/L, and the apoptotic rate was 12.3% (P < 0.05); the expressions of E-cadherin and β-Catenin were increased, whereas the expressions of NF-κВ and cyclinD1 were down-regulated.
CONCLUSION: Bortezomib inhibits the proliferation of HCT8 cells, induces cell apoptosis, and increases cell-to-cell adhesion. The mechanism may be related to its inhibition on the NF-κB pathway.
- Citation: Tao HY, Li K, Fan QX. Effects of bortezomib on the proliferation, apoptosis and adhesive ability of HCT8 cells. Shijie Huaren Xiaohua Zazhi 2009; 17(2): 190-193
- URL: https://www.wjgnet.com/1009-3079/full/v17/i2/190.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i2.190
结肠癌严重威胁着人类的生命, 随着化疗方案的改进, 结肠癌的缓解率虽然有所提高, 但晚期结肠癌患者的预后仍然较差. 因此开发出新型的抗肿瘤药物仍然十分必要. 目前有代表性的是蛋白酶体抑制剂. 硼替佐米(万柯, 最初被命名为PS-341)是一种蛋白酶体抑制剂, 主要用于治疗多发性骨髓瘤[1], 有研究用于治疗实体瘤取得了良好的疗效[2], 但硼替佐米对结肠癌作用的研究文献却较少. 为此, 本研究通过选用不同浓度梯度的硼替佐米作用于人结肠癌HCT8细胞株, 观察其对HCT8细胞增殖、细胞周期、凋亡率的影响, 并用Western blot检测与硼替佐米作用机制相关的NF-κB分子、细胞周期蛋白分子cyclinD1, 以及与细胞黏附、迁移相关且经泛素化途径代谢的E-cadherin和β-catenin蛋白表达水平的变化, 初步探讨了硼替佐米对结肠癌的作用及其可能机制, 从而为今后硼替佐米对结肠癌的临床应用奠定一定的理论基础.
硼替佐米购自西安杨森制药公司, 用生理盐水配制, 4℃保存不超过8 h. β-actin抗体(兔抗人多克隆抗体)、E-cadherin抗体(兔抗人多克隆抗体)、β-catenin抗体(小鼠抗人多克隆抗体)、cyclinD1抗体(兔抗人多克隆抗体)及辣根过氧化物酶标记的二抗均购自Santa Cruz公司, NF-kB抗体(小鼠抗人多克隆抗体)购自美国Cell Signaling公司. 人结肠腺癌HCT8细胞系由本院肿瘤中心提供.
1.2.1 MTT试验: 实验分为四组: 对照组、12.5 nmol/L组、25 nmol/L组、100 nmol/L组、200 nmol/L组. 方法参见文献[3], 在酶标仪上测定570 nm吸光度值.
1.2.2 流式细胞仪检测: 分别收集空白对照组及25 nmol/L硼替佐米作用48 h后HCT8细胞, 70 mL/L冷乙醇固定, RNase消化, 碘化丙锭(PI)染色, 流式细胞仪检测.
1.2.3 Western blot: 取35 μg细胞总蛋白, 用10% SDS-PAGE分离胶分离. 将蛋白转移至硝酸纤维膜. 用5%脱脂奶粉的TBS-T封闭膜, 然后加入用封闭液稀释的一抗, 4℃震荡过夜, TBST洗膜, 加入辣根过氧化物酶标记的二抗, 室温结合1 h. TBST洗膜后, 加发光剂Immobilon WesternTM(Millipore)作用1 min后, 曝光.
统计学处理 采用SPSS10.0医学统计软件的c2检验和概率分析. 检验水准为α = 0.05, P<0.05为差异显著.
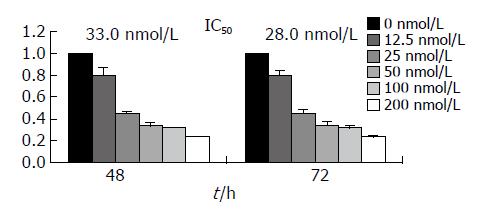
随着时间及药物浓度的增加, 硼替佐米对HCT8细胞的增殖抑制作用就越明显(P<0.05, 图1). 硼替佐米作用48 h和72 h的IC50值分别为33 nmol/L和28 nmol/L.
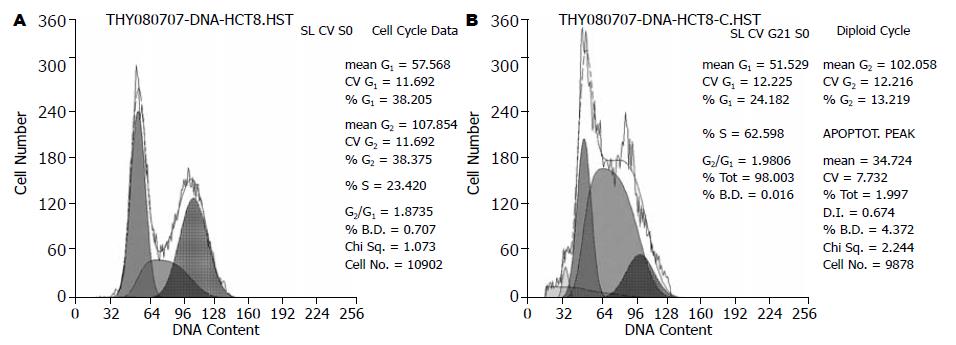
48 h后, 对照组G0/G1期、S期和G2/M期细胞比例分别为38.21%, 23.42%, 38.37%, 细胞无明显的凋亡峰; 而25 nmol/L组G0/G1期、S期和G2/M期细胞比例分别为24.18%, 62.60%,和13.22%, 出现了明显的凋亡峰, 凋亡率为12.3%(P<0.05, 图2).
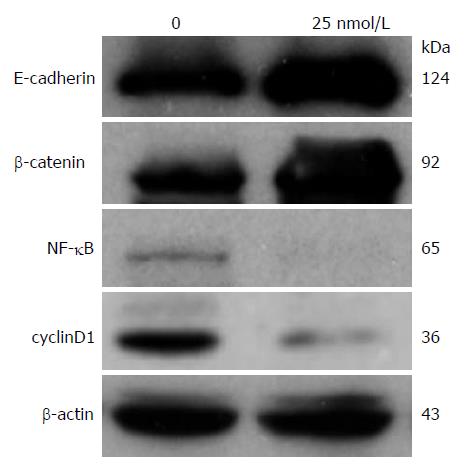
25 nmol/L硼替佐米作用于HCT8细胞48 h后, 上调了E-cadherin和β-catenin蛋白表达, 下调了NF-κB和cyclinD1蛋白的表达(图3).
硼替佐米是第一个被美国食品及药物管理局(FDA)批准用于临床治疗的蛋白酶体抑制剂, 主要通过干扰泛素-蛋白酶体通路(ubiquitin-proteasome pathway, UPP), 促进多种与肿瘤细胞增殖、分化、存活和凋亡相关的蛋白代谢发生紊乱, 诱导肿瘤细胞的凋亡.
NF-κB是一种分布和作用十分广泛的真核细胞转录因子, 在机体的免疫应答、炎性反应、细胞生长分化和凋亡等方面的重要作用已经被广泛接受. 在静息状态下, NF-κB通常与NF-κB抑制因子IκB(inhibitory protein of NF-κB)结合成三聚体, 并覆盖了核定位信号, 使NF-κB锚定于胞质中, 处于失活状态. 近年来研究发现NF-κB的激活与肿瘤的发生、发展和浸润转移有关[4-6]. 目前为止, NF-κB激活途径有两种: 有经典途径和替代途径. 我们了解较多的是经典的NF-κB途径的促肿瘤作用. 当细胞外有刺激因素(如肿瘤坏死因子、细胞因子以及病毒感染等)存在时, 可激活IκB激酶(IKK)复合物, 从而导致IκB磷酸化、泛素化, IκB的泛素化修饰触发26S蛋白酶体快速降解IκB, 从而暴露了NF-κB核定位序列, NF-κB进入细胞核中与靶基因结合[7], 启动这些基因的转录, 抑制细胞的凋亡, 刺激肿瘤细胞的增生, 促进血管的生成和浸润转移[4]. 最近的动物学实验也提供了直接的遗传学证据, 支持NF-κB在促进肿瘤发展中所扮演的关键角色[8]. 反之, 如果抑制NF-κB的激活可抑制肿瘤的持续增生状态, 诱导细胞的凋亡. 本研究中, 用Western blot检测硼替佐米可以下调NF-κB蛋白的表达, 从而提示: 在人结肠癌细胞系中, 硼替佐米可能通过下调NF-κB的表达, 抑制NF-κB通路的激活, 进而促进肿瘤细胞的凋亡.
细胞的增生依赖于细胞周期的顺利进行. 而真核生物细胞周期进程由周期素(cyclin)和周期素依赖性激酶(cyclin dependent kinase, Cdks)共同驱动, 当某一时相表达充分后可适时转入下一个时相. 目前研究证实了UPP介导的蛋白降解是调控细胞周期基础的普遍机制, 周期素及周期素抑制物都是通过泛素化降解的. 有研究表明cyclinD1在结肠癌中的表达高于正常的结肠组织. 起初, 研究细胞株的专家不认为cyclinD1是结直肠癌发病的重要因素, 但最近的研究发现他的过表达不仅是肿瘤进展中的重要事件, 而且cyclinD1的表达与结肠癌临床分期和淋巴结的转移有关. 本研究中硼替佐米改变肿瘤细胞周期的分布, 促进肿瘤细胞的凋亡, 有可能与硼替佐米下调了cyclinD1蛋白表达有关.
恶性肿瘤的侵袭、转移是肿瘤治疗的难点之一, 肿瘤的侵袭转移是一个十分复杂的生物学现象, 包括肿瘤细胞黏附于基质-蛋白水解酶降解基质-肿瘤细胞移行等过程; 其关键步骤是癌细胞脱离原发灶并附着转移部位, 细胞黏附分子(cell adhesion molecules, CAM)是黏附功能的执行者. CAM又分为钙黏蛋白家族(cadherin)、整合素蛋白家族(integrins)、免疫球蛋白超家族和选择素家族等四大类[9]. 其中上皮钙黏连素E-cadherin普遍存在于各类上皮细胞中, 介导同种细胞间黏附. E-cadherin通常与连接蛋白(β-catenin)形成E-钙黏附蛋白/连接蛋白复合体, 由β-catenin与细胞骨架的肌动蛋白分子相连接[10], 从而介导上皮细胞间的黏附. 当E-cadherin及β-catenin表达减低或缺失会破坏粘着连接, 使肿瘤细胞间的黏附性减弱, 易于脱离和迁移, 侵入周围组织和血管[11]. 我们知道而E-cadherin和β-catenin均通过泛素化途径降解. 近来有研究显示, 硼替佐米可以增加细胞间的黏附性. 本研究中, Western blot检测发现硼替佐米可以上调E-cadherin和β-catenin的表达, 提示硼替佐米可能通过抑制蛋白酶体对E-cadherin和β-catenin的降解, 从而增加细胞之间的黏附性.
总之, 本研究显示, 硼替佐米可以抑制HCT8细胞的增殖, 诱导其凋亡, 其可能的作用机制为下调NF-kB和cyclinD1蛋白的表达; 上调了E-cadherin和β-catenin蛋白的表达, 有可能通过增加细胞之间的黏附, 而降低结肠癌的远处转移.
硼替佐米是一种特异性选择26S蛋白酶体的蛋白酶体抑制剂, 可抑制蛋白酶体的活性. 主要用于多发性骨髓瘤的治疗, 近年已有将其用于其他血液肿瘤或实体瘤的报道, 但用于治疗结肠癌的研究很少.
李瑗, 教授, 广西肿瘤研究所
本文首先观察了硼替佐米对HCT8细胞增殖、凋亡的影响, 然后又检测了硼替佐米作用前后HCT8细胞中E-cadherin、β-catenin、NF-κB和cyclinD1蛋白表达的改变, 并对硼替佐米影响HCT8凋亡的可能分子机制进行了初步探讨.
本文对硼替佐米作用于人结肠癌HCT8细胞株进行了研究, 发现硼替佐米可以抑制HCT8细胞的增殖, 诱导细胞的凋亡, 为以后的临床研究提供理论基础.
本研究探讨硼替佐米对人结肠癌细胞系HCT8的作用机制, 对将该药应用于结肠癌的治疗有一定意义.
编辑: 李军亮 电编:何基才
| 1. | Ocio EM, Mateos MV, Maiso P, Pandiella A, San-Miguel JF. New drugs in multiple myeloma: mechanisms of action and phase I/II clinical findings. Lancet Oncol. 2008;9:1157-1165. [PubMed] [DOI] |
| 2. | Ryan DP, O'Neil BH, Supko JG, Rocha Lima CM, Dees EC, Appleman LJ, Clark J, Fidias P, Orlowski RZ, Kashala O. A Phase I study of bortezomib plus irinotecan in patients with advanced solid tumors. Cancer. 2006;107:2688-2697. [PubMed] [DOI] |
| 3. | Voortman J, Checinska A, Giaccone G, Rodriguez JA, Kruyt FA. Bortezomib, but not cisplatin, induces mitochondria- dependent apoptosis accompanied by up-regulation of noxa in the non-small cell lung cancer cell line NCI-H460. Mol Cancer Ther. 2007;6:1046-1053. [PubMed] [DOI] |
| 4. | Lee SH, Lee CW, Lee JW, Choi MS, Son DJ, Chung YB, Lee CK, Oh KW, Moon DC, Kwon BM. Induction of apoptotic cell death by 2'-hydroxycinnamaldehyde is involved with ERK-dependent inactivation of NF-kappaB in TNF- alpha-treated SW620 colon cancer cells. Biochem Pharmacol. 2005;70:1147-1157. [PubMed] [DOI] |
| 5. | Lee CW, Lee SH, Lee JW, Ban JO, Lee SY, Yoo HS, Jung JK, Moon DC, Oh KW, Hong JT. 2-hydroxycinnamaldehyde inhibits SW620 colon cancer cell growth through AP-1 inactivation. J Pharmacol Sci. 2007;104:19-28. [PubMed] [DOI] |
| 6. | Yu LL, Yu HG, Yu JP, Luo HS, Xu XM, Li JH. Nuclear factor-kappaB p65 (RelA) transcription factor is constitutively activated in human colorectal carcinoma tissue. World J Gastroenterol. 2004;10:3255-3260. [PubMed] |
| 7. | Lorch JH, Thomas TO, Schmoll HJ. Bortezomib inhibits cell-cell adhesion and cell migration and enhances epidermal growth factor receptor inhibitor-induced cell death in squamous cell cancer. Cancer Res. 2007;67:727-734. [PubMed] [DOI] |
| 8. | Gerondakis S, Grossmann M, Nakamura Y, Pohl T, Grumont R. Genetic approaches in mice to understand Rel/NF-kappaB and IkappaB function: transgenics and knockouts. Oncogene. 1999;18:6888-6895. [PubMed] [DOI] |
| 9. | Albelda SM. Role of integrins and other cell adhesion molecules in tumor progression and metastasis. Lab Invest. 1993;68:4-17. [PubMed] |
| 10. | Hartsock A, Nelson WJ. Adherens and tight junctions: structure, function and connections to the actin cytoskeleton. Biochim Biophys Acta. 2008;1778:660-669. [PubMed] |