修回日期: 2008-12-03
接受日期: 2008-12-08
在线出版日期: 2009-01-18
目的: 探讨唑来膦酸对人末梢血γδT细胞杀伤SGC-7901作用的影响.
方法: 异戊烯焦磷酸法体外扩增人外周血γδT细胞, 用不同浓度的唑来膦酸诱导γδT细胞和SGC-7901细胞株24 h, MTT法检测唑来膦酸对这两种细胞生长抑制率的影响和LDH法检测γδT细胞的杀伤活性, 流式细胞术检测诱导前后的γδT细胞和SGC-7901的凋亡率.
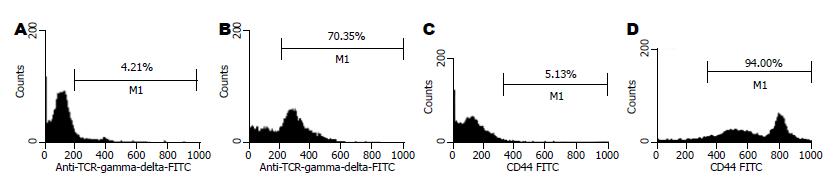
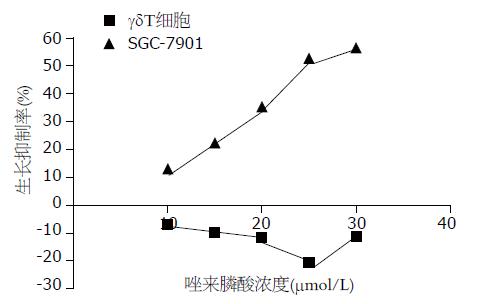
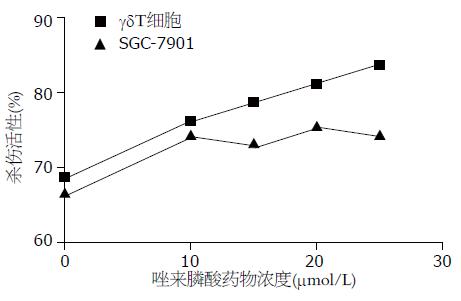
结果: γδT细胞培养10 d时从扩增前4.21%增加到70.35%, CD44达94.0%. 唑来膦酸各浓度对SGC-7901细胞株的抑制率均明显高于γδT细胞, 当唑来膦酸的浓度在5-25 mmol/L时γδT细胞负抑制率呈剂量依赖关系, 且γδT细胞的杀伤活性也逐渐增强, 且于25 mmol/L时杀伤活性最强, 唑来膦酸诱导γδT细胞和SGC-7901细胞株24 h, γδT细胞凋亡率明显低于SGC-7901(3.57% vs56.70%, P<0.05).
结论: 唑来膦酸在临床常规使用浓度下, 能够促进γδT细胞的增殖, 同时能够抑制肿瘤细胞的生长, 且能够增强γδT细胞的杀伤活性.
引文著录: 韩露艳, 费素娟, 陈复兴, 刘军权, 陈桂林. 唑来膦酸对人末梢血γδT细胞杀伤胃癌细胞株SGC-7901作用的影响. 世界华人消化杂志 2009; 17(2): 181-185
Revised: December 3, 2008
Accepted: December 8, 2008
Published online: January 18, 2009
AIM: To explore the effect of zoledronate on human's γδT cells killing gastric cancer cell lines SGC-7901.
METHODS: Isopentenyl pyrophosphate method was used to amplify human peripheral blood γδT cells in vitro. Zoledronate at various concentrations was used to induce γδT cells and gastric cancer cell lines SGC-7901 for 24 hours, MTT assays was used to detect inhibitory effect of zoledronate on these cell lines, LDH assays was used to measure the cytotoxic activity of γδT cells, and flow cytometry was used to detect apoptosis percentage of γδT cells and SGC-7901 before and after treatment.
RESULTS: Ten days after cultivation, proliferation ratio of γδT cells increased from 4.21% to 70.35% and CD44 was up to 94.0%. Inhibitory rate of zoledronate on SGC-7901 at various concentrations was significantly higher than that of γδT cells, and negative inhibitory ratio of γδT cells showed a dose-dependent manner with zoledronate's concentrations ranging from 5 to 25 mmol/L and γδT cells cytotoxic activity to SGC-7901 was higher than SGC-7901 induced group, and apoptosis was significantly lower in γδT cells than in SGC-7901 (3.57% vs 56.70%, P < 0.05).
CONCLUSION: Zoledronate, within routine concentration ranges, can promote γδT cells' proliferation and inhibit tumor cell growth and enhance γδT cells' cytotoxic activity.
- Citation: Han LY, Fei SJ, Chen FX, Liu JQ, Chen GL. Effect of zoledronate on human γδT cells killing gastric cancer cell lines SGC-7901. Shijie Huaren Xiaohua Zazhi 2009; 17(2): 181-185
- URL: https://www.wjgnet.com/1009-3079/full/v17/i2/181.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i2.181
近年来消化系肿瘤发病率日趋增加, 目前主要以手术, 化疗以及放疗为一体的治疗方案, 但是对于晚期癌症患者、不能耐受放疗、化疗的患者仍然比较棘手. 如何提高患者的生存率及生活质量成为治疗关键. 随着肿瘤免疫学的发展, 肿瘤过继免疫治疗成为目前新的治疗热点. γδT淋巴细胞是一组构成T淋巴细胞的重要亚群, 其作用近年来已基本被阐明. γδT淋巴细胞在固有免疫中发挥着十分重要的作用, 在抵抗微生物感染和肿瘤方面显示出广泛的作用, 其有着和巨噬细胞, 自然杀伤细胞, NKT细胞等固有效应细胞相似的功能性质. 唑来膦酸是第三代双磷酸盐类药物, 在临床上主要用于早期及进展期癌症患者如乳腺癌, 多发性骨髓瘤, 肺癌, 前列腺癌以及多种实体瘤引起的骨转移和高钙血症[1], 妇女绝经后的骨质疏松, 以及应用于因类固醇皮质激素引起的骨质疏松等; 同时国外研究显示唑来膦酸能够促进人末梢血γδT细胞的生长, 活化, 增殖, 但对于已成熟的γδT细胞有无作用未见相关报道. 本文以胃癌细胞株SGC-7901为研究对象, 以探讨唑来膦酸对人γδT细胞杀伤SGC-7901作用的影响.
人胃癌细胞株SGC-7901(中国科学院上海细胞所), 唑来膦酸注射液(江苏正大天晴药业股份有限公司, 批号0710261)rhIL-2、rhIFN-γ(厦门特宝生物工程股份有限公司); 异戊烯焦磷酸(isopentenyl pyrophosphate, IPP), RPMI 1640培养基、小牛血清、胰蛋白酶(Gibco公司)四甲基偶唑蓝(MTT)、二甲亚砜(DMSO)(Sigma公司); PI染液(联科生物有限公司); 抗人TCR-γδ-FITC和抗人CD44-FITC均购自杭州联科生物(immunotech, France), 恒温CO2培养箱(Heraeuas公司)、倒置显微镜(德国Wilovert公司)、超净工作台、流式细胞仪(FCM, 美国BD公司)、低速离心机、Encore自动生化分析仪和配套的LDH试剂盒. SEAC全自动酶免系列分析仪(北京希亚克技术有限公司).
1.2.1 γδT细胞的培养和鉴定: 取健康献血者末梢抗凝血10 mL, 加入淋巴细胞分离液上, 以2000 r/min离心15 min, 吸取单个核细胞层, 用生理盐水洗涤3遍(1500 r/min离心, 每次10 min), 用RPMI 1640培养液(含100 mL/L小牛血清、50 mL/L人AB血清和IPP 3 μg/L)调整细胞数为1×108 个/L, 置75 cm2细胞培养瓶中, 于37℃、50 mL/L CO2 培养箱中培养, 根据细胞生长情况及时添加培养液. 收集培养10 d的细胞进行细胞表面标志检测和其他试验.
1.2.2 唑来膦酸对人SGC-7901细胞和γδT细胞生长的影响: 取培养10 d的γδT细胞和对数生长期SGC-7901细胞, 配成1×109 个/L, 分别接种于96 孔板中, 0.2 mL/孔, 于37℃、50 mL/L CO2培养箱中培养, 24 h后加入唑来膦酸(浓度分别为5、10、15、20、25、30 μmol/L), 设不加药物及无细胞的空白对照孔, 每组设5个复孔. 继续孵育24 h后每孔加人MTT液20 μL, 37℃孵育4 h后弃上清, 每孔加入DMSO 150 μL, 轻轻震荡10 min使甲瓒充分溶解, 在540 nm波长酶标仪上测定各孔吸光度值(A), 求其平均值后计算细胞抑制率.
1.2.3 唑来膦酸对γδT细胞杀伤活性的影响: 将培养10 d的γδT细胞和对数生长期SGC-7901细胞均配成2×108 个/L, 加入6孔细胞培养板中, 每孔3 mL, 培养24 h后加入不同浓度的唑来膦酸, 同时设未加药的对照组, 继续孵育24 h后, 用2.5 g/L胰蛋白酶消化后收集SGC-7901细胞, γδT细胞直接收集, 用RPMI 1640培养基洗涤3遍, 将靶细胞SGC-7901细胞配成2×108个/L, 效应细胞γδT细胞配成2×109 个/L的悬液, 用本室建立的乳酸脱氢酶释放法[4]测定γδT细胞杀伤活性, 效靶细胞数按10:1比例混合, 以500 r/min离心5 min, 置37℃、50 mL/L CO2孵箱中孵育6 h后, 轻轻混匀细胞, 再以1500 r/min离心10 min, 每检测样本设5个复管, 收集上清液在全自动生化分析仪(OlympusAU1000)340 nm波长下测定吸光度值(A). 杀伤活性(%) = (A实验组-A效应细胞自然释放组)/(A靶细胞最大释放组-A靶细胞自然释放组)×100%.
1.2.4 唑来膦酸对γδT细胞和SGC-7901细胞凋亡率的影响: 取培养10 d的γδT细胞和对数生长期SGC-7901细胞以每孔2×105个细胞接种于24孔板, 用唑来膦酸浓度分别为(5、10、15、20、25、30 μmol/L)诱导, 每组设3个复孔. 细胞经药物诱导24 h后弃上清, 用2.5 g/L胰蛋白酶消化后收集SGC-7901细胞, γδT细胞直接收集, 用RPMI 1640培养基洗涤3遍, 加入700 mL/L冷乙醇固定, 4℃过夜. PBS洗涤3次, 加入PI染液(生理盐水129.6 mL, PI 10 mg, RNA酶2 mg, TritonX-100 1 mL, 枸橼酸钠200 mg, 加双蒸水至200 mL), 4℃避光染色30 min, 用FCM检测, 记录激发波长488 nm处的红色荧光.
统计学处理 采用SPSS14.0软件, 数据以mean±SD表示, 卡方检验比较γδT细胞和SGC-7901生长抑制率细胞凋亡率及杀伤活性有无统计学意义, 各组之间比较用单因素方差分析, P<0.05认为差异有统计学意义.
PBMC在γδT细胞培养基中培养24 h即可见贴壁生长, 48 h后集落开始变大, 培养10 d可见大的集落和单个贴壁生长细胞, 单个细胞可见细胞呈条梭状, 也有少量浮悬生长细胞. 收集培养10 d时的细胞进行mAb荧光标记后经流式细胞术检测并分析结果. PBMC 未培养前γδT细胞数为4.21%, CD44的表达率为5.13%, 培养10 d的γδT细胞数为70.35%, 而培养10 d的γδT细胞表面CD44表达率达94%(图1).
唑来膦酸浓度在5-25 mmol/L时能够显著促进γδT细胞的生长, 且呈剂量依赖性, 与对照组相比较均具有统计学意义(P<0.05). 在5 mmol/L以下时对γδT细胞的生长无明显影响, 在30 mmol/L以上浓度时促进对γδT细胞的生长现象逐渐减弱. 而唑来膦酸浓度在5-30 mmol/L时对SGC-7901细胞的生长起抑制作用, 与对照组比较均具有统计学意义(P<0.05), 且随着剂量的增加, SGC-7901的抑制率越大, 当唑来膦酸浓度在30 mmol/L以上时, 抑制率降低(图2).
γδT细胞经不同浓度的唑来膦酸诱导24 h后, 其浓度在10-25 mmol/L时, γδT细胞对SGC-7901细胞的杀伤活性逐渐增加, 呈剂量依赖关系, 在25 mmol/L时, γδT细胞的杀伤活性最强, 且各药物浓度组之间也具有统计学意义(P<0.05). SGC-7901细胞经不同浓度的唑来膦酸诱导24 h后, γδT细胞对SGC-7901细胞的杀伤活性与对照组比较具有显著意义(P<0.05)各浓度组之间无明显差异(图3).
结果显示, 唑来膦酸浓度在10-25 mmol/L时对γδT细胞作用24 h的凋亡率显著低于SGC-7901细胞, 与对照组相比较, 均有显著的统计学意义(P<0.05)唑来磷酸诱导γδT细胞的各药物浓度组之间无明显差别(P>0.05), 但唑来磷酸诱导SGC-7901的各浓度组之间具有统计学意义(P<0.05, 表1).
γδT细胞占T细胞总数的5%以下, 大多为CD4-CD8-, 主要分布于皮肤、小肠、食管、肺、生殖器官及皮下组织, 在小肠上皮内淋巴细胞占10%-18%, 在人大肠中其比例高达25%-37%, 是皮肤表皮内淋巴细胞和黏膜组织上皮内淋巴细胞的主要成分之一为非特异性免疫细胞. 活化的γδT细胞具有较强的杀伤活性, 具有抗感染、抗肿瘤作用[1-2]; γδT细胞还可以维持免疫耐受, 调节免疫应签, 异常可导致自身免疫性疾病的发生. 因此尽管γδT细胞在人类庞大复杂的免疫体系中数量较少, 但却具有不可替代的重要功能[3].
随着对γδT细胞结构和功能研究不断深入, 人们发现γδT细胞除了有与αβT细胞类似的一些功能特征外, 还有其他的一些独特的功能, 如识别抗原不需要分子提呈, 直接识别蛋白质和肽类抗原以及非肽类抗原, 具有抗原提呈细胞的一些特征, 并能通过细胞接触和分泌的细胞因子起免疫调节作用[4], 近几年来, 应用γδT细胞基因敲除的小鼠证明, γδT细胞在肿瘤免疫监视中具有重要的作用. 从本实验结果可以看出, 人外周血中培养的γδT细胞高表达CD44, CD44属于黏附分子家族的跨膜糖蛋白, 他能与许多蛋白相结合, 高表达CD44的γδT细胞能更容易与肿瘤细胞黏附, 有效杀伤靶细胞, 这与肿瘤细胞上γδTCR刺激物(如甲羟戊酸途径代谢物IPP)和NKG2D受体如MICA/B, MHCⅠb和F1-AYP合酶以及黏附分子如ICAM-1等的表达水平密切相关[5]. 因此, γδT细胞在抗肿瘤和免疫监视以及免疫耐受等方面有重要作用. 双磷酸盐类药物是近20年发展起来的一类新药, 目前已发展至第三代, 临床上常用的是唑来膦酸, 诺米磷酸, 主要用于早期及进展期癌症患者如乳腺癌, 多发性骨髓瘤, 肺癌, 前列腺癌以及多种实体瘤引起的骨转移和高钙血症[6], 妇女绝经后的骨质疏松, 同时应用于因类固醇皮质激素引起的骨质疏松, 在帕吉特病治疗中双磷酸盐可减少破骨细胞的数量和活性, 改善骨质结构和相关症状, 尤其是唑来膦酸能够明显减少骨骼相关事件的发生率[7], 同时双磷酸盐能够缓慢骨疾患的进展和防止骨转移[8], 双磷酸盐类药物可通过抑制甲羟戊酸途径, 阻止细胞周期来诱导破骨细胞和单核细胞前体细胞的凋亡, 达到抑制骨吸收的目的. 而且双磷酸盐类药物能阻断肿瘤细胞产生的各种各样的刺激因子可诱导钙离子的释放, 减慢骨转移的发生和发展, 并可直接导致某些肿瘤细胞的死亡.
目前国外研究表明多种非肽类抗原可以活化Vγ9δ2T细胞, 如IPP, DMAPP, GGPP, 包括双磷酸盐类药物, 其结构和异戊烯焦磷酸抗原相似[9].
同时国外文献报道唑来膦酸和IL-2联合应用可以快速, 大量扩增γδT细胞, 但是对于已经活化的γδT细胞是否有影响, 无相关报道, 通过本实验研究表明, 唑来膦酸能够促进成熟γδT细胞的增殖, 更重要的是通过唑来膦酸诱导γδT细胞24 h后, 能够明显增强γδT细胞的杀伤活性, 且在25 mmol/L时γδT细胞杀伤活性最强, 大于25 mmol/L时杀伤活性呈下降趋势, 说明唑来膦酸对γδT细胞作用有浓度窗现象, 这为临床应用提供了用药剂量依据, 同时唑来膦酸分别诱导γδT细胞和SGC-7901、24 h后, γδT细胞的凋亡率明显低于对照组, 而SGC-7901的凋亡率明显高于对照组, 从而说明唑来膦酸即能够促进γδT细胞的生长, 同时也能够抑制肿瘤细胞的生长, 可更好的应用于肿瘤的临床治疗. 但是通过本实验的研究只是发现唑来膦酸能够促进γδT细胞生长以及增强其杀伤活性的这种现象, 然而对于其机制不是很明确, 仍需要进一步的研究, 为什么能够促进γδT细胞的生长同时增强杀伤活性呢, 有可能是因为唑来膦酸是磷酸化抗原能够被TCR所识别, 能够增强γδT细胞表面TCR、NKG2D的表达、以及增强γδT细胞细胞因子的分泌如γ-干扰素, 肿瘤坏死因子等. 这些都有待于实验的进一步研究.
近年来研究发现γδT细胞以MHC非限制方式杀伤肿瘤细胞在免疫监视中具有重要作用, 同时也是适应性免疫中的起始因子. 国外研究表明, 唑来磷酸能够明显促进外周血γδT细胞的生长、活化、增殖、但是对于成熟的γδT细胞作用尚无报道. 因此, 本课题组研究唑来膦酸对γδT细胞杀伤胃癌细胞株SGC-7901作用的影响.
万军, 主任医师, 解放军总医院南楼老年消化科
γδT细胞不同于αβT细胞, 其以MHC非限制性方式杀伤肿瘤细胞. 因此, 如何在体内外大量快速扩增γδT细胞及对其的作用机制进行深入研究, 是目前致力于研究的问题.
Corvaisier et al对γδT细胞对自身和异体肿瘤细胞的杀伤机制进行了较详细地研究, 发现对自身肿瘤细胞和异体肿瘤细胞均有杀伤活性, 而对自身正常细胞无杀伤作用, 这种杀伤是MHC非依赖性的, 并与γδTCR刺激物的产生和ICAM-1表达密切相关; Kobayashi et al最近报告用体外激活的γδT细胞治疗7例晚期肾癌患者, 发现治疗后能明显增加外周血中γδT细胞数, 无毒副作用, 患者能够耐受治疗.
通过本文研究发现唑来膦酸在体外能够促进γδT细胞的增殖, 同时能够促进γδT细胞对肿瘤细胞的杀伤活性, 有益于唑来膦酸应用于肿瘤的过继免疫治疗, 并提供了临床治疗肿瘤的用药依据.
本研究设计合理, 方法得当, 为唑来膦酸应用于肿瘤的过继免疫治疗提供了依据.
编辑: 李军亮 电编:何基才
| 1. | 陈 复兴, 刘 军权, 冯 霞, 王 涛, 张 娟, 张 颂, 陈 桂林. 人末梢血γδT细胞对消化系统肿瘤细胞的杀伤作用. 世界华人消化杂志. 2007;15:1591-1595. [DOI] |
| 2. | Bouet-Toussaint F, Cabillic F, Toutirais O, Le Gallo M, Thomas de la Pintière C, Daniel P, Genetet N, Meunier B, Dupont-Bierre E, Boudjema K. Vgamma9Vdelta2 T cell-mediated recognition of human solid tumors. Potential for immunotherapy of hepatocellular and colorectal carcinomas. Cancer Immunol Immunother. 2008;57:531-539. [PubMed] [DOI] |
| 3. | Jameson JM, Cauvi G, Sharp LL, Witherden DA, Havran WL. Gammadelta T cell-induced hyaluronan production by epithelial cells regulates inflammation. J Exp Med. 2005;201:1269-1279. [PubMed] [DOI] |
| 5. | Corvaisier M, Moreau-Aubry A, Diez E, Bennouna J, Mosnier JF, Scotet E, Bonneville M, Jotereau F. V gamma 9V delta 2 T cell response to colon carcinoma cells. J Immunol. 2005;175:5481-5488. [PubMed] |
| 6. | Coleman RE. Bisphosphonates: clinical experience. Oncologist. 2004;9 Suppl 4:14-27. [PubMed] [DOI] |
| 7. | Watanabe N, Narita M, Yokoyama A, Sekiguchi A, Saito A, Tochiki N, Furukawa T, Toba K, Aizawa Y, Takahashi M. Type I IFN-mediated enhancement of anti-leukemic cytotoxicity of gammadelta T cells expanded from peripheral blood cells by stimulation with zoledronate. Cytotherapy. 2006;8:118-129. [PubMed] [DOI] |
| 8. | Miller PD, Brown JP, Siris ES, Hoseyni MS, Axelrod DW, Bekker PJ. A randomized, double-blind comparison of risedronate and etidronate in the treatment of Paget's disease of bone. Paget's Risedronate/Etidronate Study Group. Am J Med. 1999;106:513-520. [PubMed] [DOI] |
| 9. | Clézardin P. The antitumor potential of bisphosphonates. Semin Oncol. 2002;29:33-42. [PubMed] [DOI] |