修回日期: 2008-12-24
接受日期: 2008-12-29
在线出版日期: 2009-01-18
目的: 本研究旨在探讨COX-2、β-cat和MMP-7表达与HNPCC特殊侵袭转移生物学行为间的关系.
方法: 应用免疫组化SP法检测HNPCC(n = 28)、散发性大肠癌(n = 30)和正常大肠黏膜(n = 10)中COX-2, β-cat和MMP-7的表达情况. 所有标本预先经过hMSH2和hMLH1免疫组化染色筛查, 并结合其临床病理特点进行回顾性分析.
结果: 在HNPCC组和散发性大肠癌组中COX-2、异位β-cat和MMP-7的表达差异显著(χ2 = 14.8352, P = 0.0001; χ2 = 5.6425,P = 0.0175; χ2 = 10.6454, P = 0.0011). 两组异位β-cat和MMP-7的阳性率与大肠癌的侵袭深度和淋巴结转移密切相关(P = 0.0127, 0.0001; P = 0.0227, 0.0261), 而与性别、肿瘤的大小和部位无关. COX-2在HNPCC组中与肿瘤侵袭深度相关(P = 0.0166), 与淋巴结转移无关; 散发性大肠癌组中与肿瘤侵袭深度和淋巴结转移均无关. 两组中COX-2、异位β-cat和MMP-7三者阳性表达呈正相关(COX-2与异位β-cat: r = 0.417, P = 0.011, r = 0.504, P = 0.006; 异位β-cat与MMP-7: r = 0.396, P= 0.027, r = 0.429, P = 0.021; COX-2与MMP-7: r = 0.315, P = 0.028, r = 0.429, P = 0.021).
结论: COX-2、异位β-cat和MMP-7在HNPCC、散发性大肠癌和正常黏膜中的阳性表达率差异显著, 这可能是HNPCC相对于散发性大肠癌侵袭弱、转移少的原因之一.
引文著录: 顾国利, 王石林, 魏学明, 任力, 熊梅, 胡益云, 李德昌, 邹福先, 成健. COX-2、β-cat、MMP-7表达与遗传性非息肉病性大肠癌特殊侵袭转移行为的关系. 世界华人消化杂志 2009; 17(2): 151-157
Revised: December 24, 2008
Accepted: December 29, 2008
Published online: January 18, 2009
AIM: To detect cyclooxgenase-2 (COX-2), β-catenin (β-cat) and matrix metalloproteinase-7 (MMP-7) expression in hereditary nonpolyposis colorectal cancer (HNPCC) and sporadic colorectal carcinoma (CRC), and to analyze their relationship with the biological behaviour of HNPCC.
METHODS: The SP Immunohistochemical staining was used to detect COX-2, β-cat and MMP-7 protein expression in sample tissues of 28 HNPCC, 30 sporadic CRC and 10 normal colorectal cancer. All of the specimens were selected beforehand by hMSH2 and hMLH1 Immunohistochemical staining. And their corresponding clinical data were analyzed retrospectively.
RESULTS: The positive expression rates of COX-2, β-cat in cytoplasm and MMP-7 expression differed significantly between HNPCC and sporadic CRC (χ2 = 14.8352, P = 0.0001; χ2 = 5.6425, P = 0.0175; χ2 = 10.6454, P = 0.0011). Positive rates of malposed β-cat and MMP-7 were closely correlated with the neoplastic invasive depth in HNPCC group and sporadic CRC group (P = 0.0127, P = 0.0001; P = 0.0227, P = 0.0261) and lymph node metastasis (P = 0.0000, P = 0.0001; P = 0.0227, P = 0.0261), but not with the sex, the size or position of the tumour. COX-2 expression was bound up with the neoplastic invasive depth (P = 0.0166) in HNPCC group, but not with the lymph node metastasis. However, in sporadic CRC group, COX-2 expression was related with neither neoplastic invasive depth nor lymph node metastasis. There was a stable positive relationship among COX-2, malposed β-cat and MMP-7 expression both in HNPCC and sporadic CRC (COX-2 and malposed β-cat: r = 0.417, P = 0.011, r = 0.504, P = 0.006; malposed β-cat and MMP-7: r = 0.396, P = 0.027, r = 0.429, P = 0.021; COX-2 and MMP-7: r = 0.315, P = 0.028, r = 0.429, P = 0.021).
CONCLUSION: The present study demonstrates that the COX-2, β-cat in cytoplasm and MMP-7 expression has marked difference among HNPCC, sporadic CRC and normal colorectal tissues. This may be an important reason why HNPCC tumors have a less invasive and metastatic potential compared with sporadic variants.
- Citation: Gu GL, Wang SL, Wei XM, Ren L, Xiong M, Hu YY, Li DC, Zou FX, Cheng J. Cyclooxgenase-2, β-catenin and matrix metalloproteinase-7 expression and their correlation with invasion/metastasis behaviours of hereditary nonpolyposis colorectal cancer. Shijie Huaren Xiaohua Zazhi 2009; 17(2): 151-157
- URL: https://www.wjgnet.com/1009-3079/full/v17/i2/151.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i2.151
遗传性非息肉病性大肠癌(hereditary non-polyposis colorectal cancer, HNPCC)又称Lynch综合征, 是由人类错配修复基因(MMR)种系突变和微卫星不稳定而引起的常染色体显性遗传病[1], 约占全部大肠癌的5%-15%. HNPCC的遗传病因特殊、临床病理特点突出[1-3], 是遗传性结直肠肿瘤的代表. 其生物学行为与散发性大肠癌不同. 研究发现: 在获得诊断时, HNPCC比散发性大肠癌的侵袭更弱、转移更少、预后更好[4]. 诸多因素参与大肠癌的发生发展和侵袭转移行为, 其中环氧合酶-2(cyclooxgenase-2, COX-2)、Wnt/APC/TCF信息通路及其下游基因产物是已知的重要环节[5-9]. COX-2又称前列腺素合酶, 是花生四烯酸代谢的关键限速酶; 同时具有抑制肿瘤细胞凋亡、调控肿瘤细胞周期、促进肿瘤血管形成和增加肿瘤细胞侵袭、转移的潜能[10-11]. β-链接素(β-catenin, β-cat)不但参与细胞间黏附, 而且也是Wnt/APC/TCF通路中将信息由胞膜传递至细胞核的关键因子[12]. 而基质金属蛋白酶-7(matrix metalloproteinase-7, MMP-7)则是Wnt/APC/TCF通路的靶基因产物, 可直接分解基底膜和细胞外基质造成肿瘤侵袭和转移[13-14]. 因此, COX-2, β-cat和MMP-7的表达情况直接影响肿瘤的侵袭和转移, 并与预后密切相关. 我们采用免疫组化方法检测COX-2, β-cat和MMP-7在HNPCC、散发性大肠癌和正常大肠黏膜组织中的表达, 探讨其与HNPCC特殊侵袭转移生物学行为之间的关系, 并为COX-2抑制剂药物用于大肠癌的临床防治提供参考.
收集我院1980-05/2007-12间收治的大肠癌病例, 按以下入选条件分别组成试验组(n = 28)、阳性对照组(n = 30)和阴性对照组(n = 10). 试验组(HNPCC组)入选条件: 符合AmsterdamⅡ标准[15], hMSH2和hMLH1染色至少一个结果为阴性. 阳性对照组(散发性大肠癌组)入选条件: 年龄≥60岁, 没有家族遗传倾向和多原发癌, hMSH2和hMLH1染色均为阳性表达. 阴性对照组(正常黏膜组)入选条件: 因其他疾病而切除的大肠黏膜组织, hMSH2和hMLH1染色结果均为阳性.
上述标本均经甲醛固定、石蜡包埋, 并经HE染色病理确诊. 全部肿瘤病例术前均未行放化疗. 即用型hMLH1鼠抗人mAb(ZM-0154)、即用型hMSH2鼠抗人mAb(ZM-0156)、即用型β-cat鼠抗人mAb(ZM-0442)、即用型MMP-7鼠抗人mAb(ZM-0334)均购自北京中杉金桥生物公司. 即用型COX-2兔抗人mAb(RMA-0549)、即用型SP试剂盒、DAB显色试剂盒均购自福州迈新生物技术开发公司. 试验由LAB vision Autostainer360自动染色仪系统(福建迈新公司)程控完成、镜下图像以Olympus Dp70图像采集分析仪进行采集、分析.
实验按产品说明书操作. 切片常规脱蜡至水, hMSH2、hMLH1、COX-2和β-cat均经抗原热修复, MMP-7组不需抗原修复. 30 mL/L H2O2孵育10 min, 蒸馏水冲洗, PBS浸泡5 min, 滴加正常兔血清工作液, 孵育10 min后倾去, 不洗; 滴加一抗37℃孵育2 h, PBS冲洗3 min×3次. 滴加二抗, 孵育15 min, PBS冲洗3 min×3次. 滴加三抗, 孵育15 min, PBS冲洗3 min×3次, DAB显色, 苏木素复染, 脱水, 透明, 封片. PBS代替一抗作阴性对照, 正常大肠黏膜上皮表达情况作阳性对照. 在200倍的视野下随机选取10个视野, 记数每个视野中正常黏膜或肿瘤细胞的染色情况, 取平均值. hMLH1、COX-2、MMP-7均定位于细胞质, hMSH2定位于细胞核. 依据染色强度和阳性细胞率来计算评分. 染色强度: 0为无染色; 1为染色弱; 2为中等染色强度; 3为染色强. 阳性细胞率: 0为<1%, 1为<10%, 2为<50%, 3为<80%, 4为≥80%. 以染色强度与阳性细胞率之和计算评分, 0-2分为阴性(-), 3-5分为阳性(+), 6-7分为强阳性(++). 从胞膜和胞质胞核两方面观察β-cat的表达[16]. β-cat在胞膜阳性细胞数≥70%记为β-cat正常表达, β-cat在胞质阳性细胞数≥30%或在胞核表达≥10%记为β-cat异位表达. 评分过程由两名高年资病理科医生双盲法独立完成.
统计学处理 应用SPSS15.0统计软件包进行统计分析. 计数资料采用两个(或多个)样本率比较的χ2检验, 正态分布的计量资料采用随机设计的两总体均数的t检验, 年龄资料采用单因素多个样本均数比较的q检验(Newman-Keuls法). 积分相关性采用Spearman等级相关分析, P<0.05为差异有统计学意义.
三组病例具体的临床资料见表1. 三组病例的年龄统计学差异显著(HNPCC组和散发大肠癌组的Q = 14.0060,P<0.01; HNPCC组和正常黏膜组的Q = 4.0805, P<0.01; 散发大肠癌和正常黏膜组的Q = 5.9623, P<0.01). 而性别、标本部位和肿瘤的Dukes分期无统计学差异. hMSH2和hMLH1染色结果因入选条件的原因造成统计学差异(图1).
| 分组 | n | 男 | 女 | 年龄(mean±SD, 岁) | 部位 | Dukes分期 | hMSH2 | hMLH1 | ||||||
| 结肠 | 直肠 | A | B | C | D | +~++ | - | +~++ | - | |||||
| HNPCC组 | 28 | 22 | 6 | 18-58(45.0±8.6) | 18 | 10 | 3 | 16 | 8 | 1 | 11 | 17 | 17 | 11 |
| 散发大肠癌 | 30 | 20 | 10 | 60-84(66.3±7.9) | 17 | 13 | 1 | 12 | 15 | 2 | 30 | 0 | 30 | 0 |
| 正常黏膜组 | 10 | 7 | 3 | 35-67(53.7±7.8) | 7 | 3 | 10 | 0 | 10 | 0 | ||||
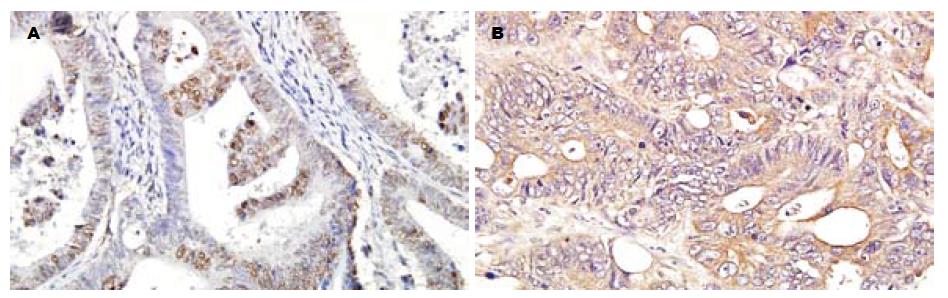
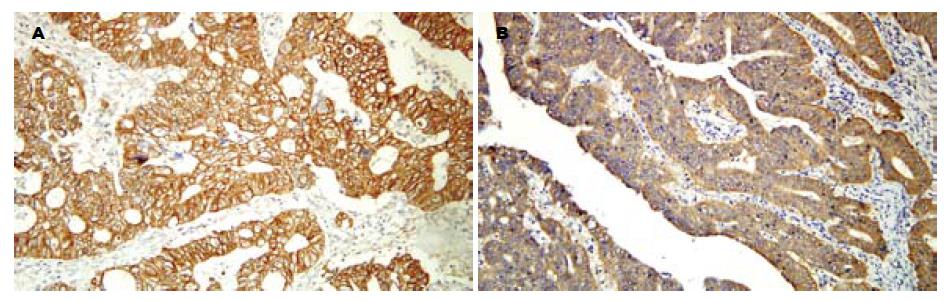
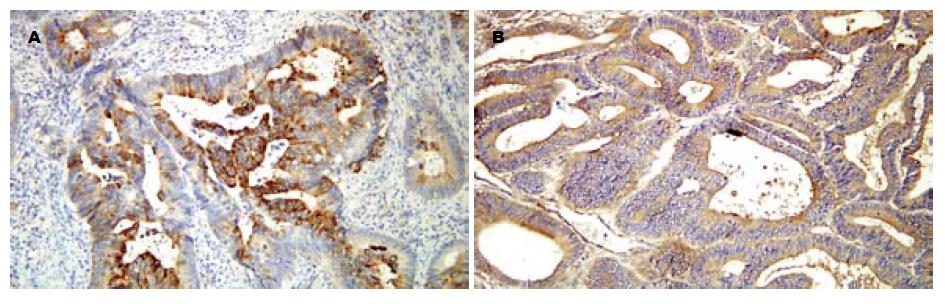
β-cat呈棕黄色细颗粒表达于上皮细胞-细胞接触侧的胞膜上(图2A), 也可在胞质和胞核中异位表达(图2B); 肿瘤间质不染色. COX-2主要表达于黏膜细胞的胞质中, 呈棕褐色颗粒状; 部分胞膜着色, 肿瘤间质不染色(图3A). MMP-7主要表达在胞质, 呈棕黄色颗粒状, 部分胞膜染色, 肿瘤间质不染色(图3B). 三组中COX-2, β-cat, MMP-7的表达情况见表2, 其中HNPCC和散发大肠癌两组间统计学差异显著(COX-2: χ2 = 14.8352, P = 0.0001; 异位β-cat: χ2 = 5.6425, P = 0.0175; MMP-7: χ2 = 10.6454, P = 0.0011). HNPCC和正常黏膜组之间差异不显著.
COX-2, β-cat, MMP-7在HNPCC和散发性大肠癌两组中表达的情况见表3. 异位β-cat和MMP-7的阳性率与大肠癌的侵袭深度(HNPCC组中异位β-cat: P = 0.0127; MMP-7: P = 0.0001. 散发性大肠癌组中异位β-cat: P = 0.0227; MMP-7: P = 0.0261)和淋巴结转移(HNPCC组中异位β-cat: P = 0.0000; MMP-7: P = 0.0001. 散发性大肠癌组中异位β-cat: P = 0.0227; MMP-7: P = 0.0261)密切相关, 而与性别、肿瘤的大小和部位无关; COX-2在HNPCC组中与肿瘤侵袭深度相关(P = 0.0166), 与淋巴结转移无关; 而在散发性大肠癌组中COX-2与肿瘤侵袭深度和淋巴结转移均无关. 因此, 异位β-cat和MMP-7的表达与大肠癌的Dukes分期密切相关.
| 分组 | n | COX-2 | β-cat表达 | MMP-7 | ||
| 正常 | 异位 | |||||
| HNPCC组 | ||||||
| 性别 | 男 | 22 | 9 | 15 | 6 | 9 |
| 女 | 6 | 3 | 4 | 3 | 4 | |
| 肿瘤大小 | <4 cm | 16 | 7 | 10 | 5 | 7 |
| ≥4 cm | 12 | 5 | 9 | 4 | 6 | |
| 部位 | 右半结肠 | 14 | 6 | 10 | 4 | 6 |
| 左半结肠 | 4 | 2 | 3 | 2 | 3 | |
| 直肠 | 10 | 4 | 6 | 3 | 4 | |
| 侵袭深度 | 浆膜内 | 19 | 5 | 16a | 3 | 4 |
| 浆膜外 | 9 | 7a | 3 | 6a | 9a | |
| 淋巴结转移 | 无 | 19 | 7 | 13 | 1b | 4b |
| 有 | 9 | 5b | 6b | 8a | 9a | |
| 散发大肠癌组 | ||||||
| 性别 | 男 | 20 | 17 | 7 | 11 | 18 |
| 女 | 10 | 7 | 4 | 8 | 8 | |
| 肿瘤大小 | <4 cm | 14 | 11 | 5 | 8 | 11 |
| ≥4 cm | 16 | 13 | 6 | 11 | 15 | |
| 部位 | 右半结肠 10 | 8 | 3 | 6 | 9 | |
| 左半结肠 | 7 | 5 | 2 | 5 | 6 | |
| 直肠 | 13 | 11 | 6 | 8 | 11 | |
| 侵袭深度 | 浆膜内 | 13 | 8b | 8a | 5 | 9b |
| 浆膜外 | 17 | 16a | 3 | 14a | 17a | |
| 淋巴结转移 | 无 | 13 | 8 | 9a | 5 | 9 |
| 有 | 17 | 16a | 2 | 14a | 17a | |
HNPCC和散发性大肠癌两组中COX-2, 异位β-cat, MMP-7的表达均呈正相关(表4). 其中HNPCC组中COX-2与异位β-cat的r = 0.417, P = 0.011; 异位β-cat与MMP-7的r = 0.396, P = 0.027; COX-2与MMP-7的r = 0.315, P = 0.028. 而散发大肠癌中散发性大肠癌中COX-2与异位β-cat的r = 0.504, P = 0.006; 异位β-cat与MMP-7的r = 0.429, P = 0.021; COX-2与MMP-7的r = 0.429, P = 0.021.
| 分组 | 项目 | n | COX-2 | 异位β-cat | ||
| - | + | - | + | |||
| HHNPCC组 | ||||||
| 异位β-cat | (-) | 19 | 14 | 5 | ||
| (+) | 9 | 2 | 7 | |||
| MMP-7 | (-) | 15 | 11 | 4 | 12 | 3 |
| (+~++) | 13 | 5 | 8 | 7 | 6 | |
| 散发大肠癌组 | ||||||
| 异位β-cat | (-) | 11 | 3 | 8 | ||
| (+) | 19 | 3 | 16 | |||
| MMP-7 | (-) | 4 | 3 | 1 | 2 | 2 |
| (+~++) | 26 | 3 | 23 | 9 | 17 | |
Wnt/APC/TCF信息通路在肿瘤的发生、发展、侵袭、转移过程中起着非常重要的作用[17-18]. β-cat是该信息通路的关键因子, 其既可与细胞膜上的钙黏附蛋白结合, 参与介导上皮细胞黏附、保持肿瘤组织的完整性、阻止肿瘤细胞脱离原发灶, 从而抑制肿瘤转移[19]. 如不能被APC分解, β-cat也可在胞质和胞核中的积累和异常表达, 并启动Wnt/APC/TCF信息通路的下游靶基因[20]. 而MMP-7就是一个靶基因产物. 因其分子结构中缺乏与组织抑制因子(TIMP)相互作用的C末端区域, 使MMP-7具有强大的基质降解功能和广泛的底物特异性, 同时受TIMP的负调节作用较小. 因此, 在大肠癌的侵袭转移过程中MMP-7的作用比其他MMP成员更重要[21]. 在分解基底膜和细胞外基质造成肿瘤侵袭、转移的同时, MMP-7还参与胞膜中的钙黏附蛋白与β-cat连接的分解, 加速β-cat在胞质中的积累表达. 因此, β-cat和MMP-7与大肠癌的侵袭、转移密切相关. 本研究显示: 大肠癌中β-cat在胞膜正常表达明显少于正常组织; 而异位β-cat和MMP-7的表达则相反. 且随肿瘤侵袭深度和淋巴结转移而表达明显增加, 统计学差异显著. 这显示β-cat蛋白表达异常贯穿了大肠癌从早期发生直至晚期转移的全过程. 分析散发性大肠癌组织中异位β-cat和MMP-7表达明显增多的原因: HNPCC多由MMR突变引起, 而散发性大肠癌则多由APC基因突变引起[22]. APC基因突变将导致APC蛋白失活, 从而无法分解进入胞质的β-cat复合物, 造成β-cat在胞质堆积并进入细胞核, 启动Wnt/APC/TCF信息通路下游靶基因的转录; 促进MMP-7的产生. 这可能是造成HNPCC侵袭弱、转移少、预后较好的原因之一.
COX是前列腺素合成过程中的一个重要限速酶, 催化花生四烯酸最终生成一系列内源性前列腺素从而参与大肠癌的发生发展[23]. 本研究显示: 在HNPCC和散发性大肠癌中COX-2, 异位β-cat, MMP-7的表达均呈正相关. 这说明三者在大肠癌中的作用是一致的. 研究已证实[23-26]: COX-2具有增加肿瘤转移和侵袭潜能、提高细胞的生存能力及抑制凋亡、与新生血管的生成及预后、导致大肠癌组织的局部免疫抑制的作用. 因此, COX-2的高表达将造成肿瘤细胞凋亡减少、生长加速、侵袭和转移增加、预后差. 本研究显示: COX-2在HNPCC中的表达较散发性大肠癌明显减少. 此结果与其他学者报道一致[27-29]. 因此, 这可能也是造成HNPCC侵袭弱、转移少、预后好的特殊生物学行为的原因之一. 分析产生此结果的原因: (1)散发性大肠癌APC突变造成β-cat在胞质堆积, 而胞质中的β-cat可以诱导COX-2的mRNA转录并增加mRNA的稳定性, 从而调节COX-2的表达[6,30-31], 导致COX-2的表达增加、细胞凋亡减少、诱导肿瘤的生长. (2)COX-2的高表达可以引起转化生长因子β的Ⅱ型受体(TβRⅡ)的表达减少[22], 而TβRⅡ则是TGFβ/Smad信息通路传导的关键环节, 其表达减少将使肿瘤逃逸TGFβ的抑制作用, 从而促进肿瘤的发生发展. 同时, TGFβ/Smad和Wnt/APC/TCF这两个信息通路也是相互联系的. COX-2高表达可通过TGFβ/Smad信息通路中的Smad4影响Wnt/APC/TCF信息通路中β-cat在胞质中的堆积.
流行病学调查研究发现长期服用阿司匹林药物的人群大肠腺癌、大肠腺瘤性息肉的发生率明显下降[32-34]. 有规律的服用阿司匹林可以降低结直肠癌致死的危险性, 而舒林酸可以减少腺瘤性结肠息肉病息肉的数量. 因此, COX-2抑制剂具有抑制和治疗大肠肿瘤的作用. 非选择性抑制剂因其副作用较大而在临床应用受限; 而选择性抑制剂具有药物作用特异性强、副作用小的特点, 临床应用前景广. 塞来昔布等选择性COX-2抑制剂已成为目前结肠息肉病和大肠癌的药物干预性治疗的热点. 目前化学合成的β-cat抑制剂药物也已开始进入临床并成为肿瘤治疗领域的热点. 他们的应用开辟了大肠癌靶向治疗阶段. 研究显示[35]: 部分COX-2抑制剂也是通过调节胞质中的β-cat水平从而达到抑制COX-2的作用. 因此, COX-2抑制剂和β-cat抑制剂药物在作用机理方面有共通之处. 本研究显示: 虽然HNPCC中COX-2和异位β-cat较散发性大肠癌明显减少, 但仍明显高于正常大肠组织, 我们认为: 临床上应用COX-2抑制剂和β-cat抑制剂药物治疗HNPCC也是适合的. 因此, 本研究结果为临床应用COX-2抑制剂和β-cat抑制剂药物治疗大肠癌和HNPCC的治疗提供了一个有益的参考.
遗传性非息肉病性大肠癌(HNPCC)又称Lynch综合征, 是由人类错配修复基因(MMR)种系突变和微卫星不稳定而引起的常染色体显性遗传病, 约占全部大肠癌的5%-15%. HNPCC的遗传病因特殊、临床病理特点突出, 是遗传性结直肠肿瘤的代表.
房林, 副教授, 同济大学附属上海市第十人民医院普外科; 高泽立, 副教授, 上海交通大学医学院附属第三人民医院感染科; 王正康, 教授, 北京中日友好医院普外科
Wnt/APC/TCF信息通路及其下游产物、COX-2和HNPCC均是目前肿瘤学的研究热点. Wnt/APC/TCF信息通路和COX-2在大肠癌的发生、发展、侵袭、转移中起着非常重要的作用. 研究发现异位的β-cat、MMP-7和COX-2的表达与大肠癌的侵袭转移密切相关. 但研究其在HNPCC中的作用的文章却鲜有报道.
目前化学合成的、选择性的COX-2、MMP和β-cat的抑制剂已开始用于肿瘤的临床治疗, 本研究为新药物的临床应用提供了一些有益的参考.
本文内容新颖, 紧密配合近代流行的肿瘤生物靶向治疗, 值得临床及基础学者阅读.
编辑: 史景红 电编:吴鹏朕
| 2. | Jass JR. Hereditary Non-Polyposis Colorectal Cancer: the rise and fall of a confusing term. World J Gastroenterol. 2006;12:4943-4950. [PubMed] |
| 4. | Behrens P, Mathiak M, Mangold E, Kirdorf S, Wellmann A, Fogt F, Rothe M, Florin A, Wernert N. Stromal expression of invasion-promoting, matrix-degrading proteases MMP-1 and -9 and the Ets 1 transcription factor in HNPCC carcinomas and sporadic colorectal cancers. Int J Cancer. 2003;107:183-188. [PubMed] [DOI] |
| 5. | Fujimura T, Ohta T, Oyama K, Miyashita T, Miwa K. Role of cyclooxygenase-2 in the carcinogenesis of gastrointestinal tract cancers: a review and report of personal experience. World J Gastroenterol. 2006;12:1336-1345. [PubMed] |
| 7. | 段 光杰, 阎 晓初, 章 容, 卞 修武, 王 清良, 刘 丽梅, 陈 春燕. β-catenin和MMP-7表达与大肠癌侵袭转移的关系研究. 第三军医大学学报. 2006;28:227-230. |
| 9. | Clevers H. Wnt/beta-catenin signaling in development and disease. Cell. 2006;127:469-480. [PubMed] [DOI] |
| 10. | Eizayaga FX, Aguejouf O, Desplat V, Belon P, Doutremepuich C. Modifications produced by selective inhibitors of cyclooxygenase and ultra low dose aspirin on platelet activity in portal hypertension. World J Gastroenterol. 2007;13:5065-5070. [PubMed] |
| 14. | Brabletz T, Jung A, Dag S, Hlubek F, Kirchner T. beta-catenin regulates the expression of the matrix metalloproteinase-7 in human colorectal cancer. Am J Pathol. 1999;155:1033-1038. [PubMed] |
| 15. | Lenz HJ. First Amsterdam, then Bethesda, now Melbourne? J Clin Oncol. 2005;23:6445-6449. [PubMed] [DOI] |
| 16. | 黄 琼, 朱 益民, 邢 晓明, 来 茂德. β-catenin在结直肠肿瘤中的异常表达及其意义. 浙江大学学报(医学版). 2004;33:121-124. |
| 17. | Behrens J, Lustig B. The Wnt connection to tumorigenesis. Int J Dev Biol. 2004;48:477-487. [PubMed] [DOI] |
| 18. | 顾 国利, 魏 学明, 王 石林, 任 力, 郑 爱民, 黄 蓉蓉, 胡 益云. 大肠癌E-cadherin, β-catenin, MMP-7表达及其临床意义. 世界华人消化杂志. 2007;15:375-380. [DOI] |
| 20. | Chen WC, Lin MS, Zhang BF, Fang J, Zhou Q, Hu Y, Gao HJ. Survey of molecular profiling during human colon cancer development and progression by immunohistochemical staining on tissue microarray. World J Gastroenterol. 2007;13:699-708. [PubMed] |
| 21. | 顾 国利, 王 石林, 李 捷雷, 魏 学明, 黄 蓉蓉. 基质金属蛋白酶-7和组织抑制因子-2表达与遗传性非息肉病性大肠癌患者肿瘤侵袭转移关系的研究. 中华医学杂志. 2006;86:3367-3370. |
| 22. | Navaratnam RM, Chowaniec J, Winslet MC. The molecular biology of colorectal cancer development and the associated genetic events. Ann R Coll Surg Engl. 1999;81:312-319. [PubMed] |
| 24. | Cutler NS, Graves-Deal R, LaFleur BJ, Gao Z, Boman BM, Whitehead RH, Terry E, Morrow JD, Coffey RJ. Stromal production of prostacyclin confers an antiapoptotic effect to colonic epithelial cells. Cancer Res. 2003;63:1748-1751. [PubMed] |
| 25. | 汪 斐, 莫 烨, 周 世权, 陈 森林, 宁 文锋, 姚 茂金, 王 永俊, 施 小六. COX-2和HER-2在结直肠癌中的表达及其意义. 中国普通外科杂志. 2007;16:693-695. |
| 26. | Xing LL, Wang ZN, Jiang L, Zhang Y, Xu YY, Li J, Luo Y, Zhang X. Cyclooxygenase 2 polymorphism and colorectal cancer: -765G>C variant modifies risk associated with smoking and body mass index. World J Gastroenterol. 2008;14:1785-1789. [PubMed] [DOI] |
| 27. | Castells A, Payá A, Alenda C, Rodríguez-Moranta F, Agrelo R, Andreu M, Piñol V, Castellví-Bel S, Jover R, Llor X. Cyclooxygenase 2 expression in colorectal cancer with DNA mismatch repair deficiency. Clin Cancer Res. 2006;12:1686-1692. [PubMed] [DOI] |
| 28. | Lal G, Ash C, Hay K, Redston M, Kwong E, Hancock B, Mak T, Kargman S, Evans JF, Gallinger S. Suppression of intestinal polyps in Msh2-deficient and non-Msh2-deficient multiple intestinal neoplasia mice by a specific cyclooxygenase-2 inhibitor and by a dual cyclooxygenase-1/2 inhibitor. Cancer Res. 2001;61:6131-6136. [PubMed] |
| 29. | 韦 金英, 韩 彩丽, 宋 伟庆, 张 轶华, 陈 怡, 刘 玉. 微卫星不稳定结直肠癌中COX-2、hMLH1、hMSH2的表达. 临床与实验病理学杂志. 2006;22:571-574. |
| 30. | Kawasaki T, Nosho K, Ohnishi M, Suemoto Y, Kirkner GJ, Dehari R, Meyerhardt JA, Fuchs CS, Ogino S. Correlation of beta-catenin localization with cyclooxygenase-2 expression and CpG island methylator phenotype (CIMP) in colorectal cancer. Neoplasia. 2007;9:569-577. [PubMed] [DOI] |
| 31. | 周 世权, 施 小六, 陈 森林, 莫 烨, 王 永俊, 李 陈婕, 宁 文峰, 姚 茂金, 汪 斐. β-catenin和COX-2在大肠癌中的表达及临床意义. 中国医师杂志. 2005;7:889-891. |
| 32. | Jacoby RF, Seibert K, Cole CE, Kelloff G, Lubet RA. The cyclooxygenase-2 inhibitor celecoxib is a potent preventive and therapeutic agent in the min mouse model of adenomatous polyposis. Cancer Res. 2000;60:5040-5044. [PubMed] |
| 33. | Seno H, Oshima M, Ishikawa TO, Oshima H, Takaku K, Chiba T, Narumiya S, Taketo MM. Cyclooxygenase 2- and prostaglandin E(2) receptor EP(2)-dependent angiogenesis in Apc(Delta716) mouse intestinal polyps. Cancer Res. 2002;62:506-511. [PubMed] |
| 34. | Takeda H, Miyoshi H, Tamai Y, Oshima M, Taketo MM. Simultaneous expression of COX-2 and mPGES-1 in mouse gastrointestinal hamartomas. Br J Cancer. 2004;90:701-704. [PubMed] [DOI] |
| 35. | Eisinger AL, Nadauld LD, Shelton DN, Prescott SM, Stafforini DM, Jones DA. Retinoic acid inhibits beta-catenin through suppression of Cox-2: a role for truncated adenomatous polyposis coli. J Biol Chem. 2007;282:29394-29400. [PubMed] [DOI] |