修回日期: 2009-06-12
接受日期: 2009-06-23
在线出版日期: 2009-07-08
目的: 探讨分离细胞克隆的最佳细胞密度和最适琼脂浓度, 为肿瘤干细胞的筛选提供更广阔的思路.
方法: 将HepG2单细胞悬液与10 g/L的琼脂糖相混合, 在2 g/L(A组)和3 g/L(B组)琼脂中接种不同密度的HepG2细胞, 14 d后观察克隆形成.
结果: 100-1000个/孔的各个实验组中, A组细胞的克隆数高于B组, 差异有统计学意义(t = 4.36, P<0.05); 在细胞密度为100-500个/孔时, A、B组细胞克隆形成率随着细胞密度的增加逐渐增加; 600-1000个/孔, A、B组均随着细胞密度的逐渐加大, 克隆形成率呈现下降趋势.
结论: 在进行软琼脂克隆形成实验时, 可以采用2 g/L的上层琼脂浓度, 并采用10 g/L的琼脂糖凝胶作为储备胶, HepG2细胞在500个/孔时的克隆形成率最高.
引文著录: 丁洁, 魏德全, 蒋吉英, 王宝松, 姜栋栋, 于树娜, 王晓萃. HepG2细胞在不同琼脂糖浓度下克隆形成能力的比较. 世界华人消化杂志 2009; 17(19): 1986-1989
Revised: June 12, 2009
Accepted: June 23, 2009
Published online: July 8, 2009
AIM: To determine the optimal cell density and agar concentration for separation of cell clones and thereby provide a reference for screening of tumor stem cells.
METHODS: HepG2 cells were mixed with 10 g/L agarose and inoculated in 2 g/L (group A) and 3 g/L (group B) soft agar at different densities. After 14 d of culture, the number of cell clones was counted and the rate of colony formation was calculated.
RESULTS: The number of clones formed in group A was significantly higher than that in group B (t = 4.36, P < 0.05). The rates of colony formation observed in both group A and group B increased with the increase in cell density that varied between 100 and 500 cells per well. In contrast, the rate of colony formation decreased with the increase in cell density that varied between 600 and 1000 cells per well.
CONCLUSION: The optimal concentration of agar in the upper layer for colony formation is 3 g/L, with 10% agarose as a stock agar. The maximum rate of colony formation is achieved when cells are inoculated at a density of 500 cells per well.
- Citation: Ding J, Wei DQ, Jiang JY, Wang BS, Jiang DD, Yu SN, Wang XC. Comparison of colony-forming capacity of HepG2 cells in different soft agar systems. Shijie Huaren Xiaohua Zazhi 2009; 17(19): 1986-1989
- URL: https://www.wjgnet.com/1009-3079/full/v17/i19/1986.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i19.1986
软琼脂克隆形成实验作为体外检测细胞增殖能力和致瘤性的一种常规方法, 常用来分离和纯化肿瘤细胞[1], 单克隆抗体杂交瘤细胞的克隆筛选以及抗肿瘤药物体外抑瘤能力的评价[2-4], 随着肿瘤干细胞学说的兴起, 也被用来筛选具有干细胞性质的细胞[5], 为此, WHO及美国FDA等机构认为可采用软琼脂克隆法等体外方法检测细胞的致瘤性. 但以往报道中所采用的凝胶浓度以及细胞密度不尽相同, 从而使克隆形成率不一致[6-7]. 因此, 本课题对不同细胞密度和不同琼脂糖浓度下HepG2细胞的克隆形成能力进行了比较.
DMEM高糖培养基购自美国Gibco公司; 低熔点琼脂购自上海YITO Bio-instrument公司; 胎牛血清购自杭州四季青生物技术有限公司; HepG2细胞株由本校免疫学教研室梁淑娟博士惠赠.
1.2.1 制备底层琼脂: (1)50 g/L储备胶的制备: 称取琼脂糖粉末0.5 g, 溶于装有10 mL D-Hanks液的青霉素小瓶中, 高压灭菌备用. (2)10 g/L储备胶的制备: 称取琼脂糖粉末0.1 g, 溶于装有10 mL D-Hanks液的青霉素小瓶中, 高压灭菌备用. (3)6 g/L底层琼脂的制备: 将10 g/L的琼脂糖凝胶置于沸水浴中融化, 待冷却至50 ℃时取出6份与4份预热至37 ℃的新鲜培养基充分混匀后迅速倒入24孔培养板中, 每孔0.8 mL, 室温静置冷却备用.
1.2.2 制备上层琼脂: (1)不同密度细胞悬液的制备: 取对数生长期的HepG2细胞, 用2.5 g/L的胰蛋白酶消化后, 用细胞计数板计数, 调整细胞密度为1×107/L. (2)2 g/L上层琼脂的制备: 将10 g/L的琼脂糖凝胶置于沸水浴中融化后, 待冷却至50 ℃时, 用刻度吸管取出0.48 mL迅速分别与预热至37 ℃的1.92 mL的不同密度的细胞悬液相混合, 制备2 g/L上层琼脂, 同法制备3 g/L上层琼脂, 分别为A组和B组. 然后分别将各组的上层琼脂迅速倒入到24孔板中, 每孔0.8 mL, 每种细胞密度重复接种3个孔, 调节6种细胞密度最终分别为100、300、500、600、800、1000个/孔. 所有的实验组重复3次.
1.2.3 细胞培养及结果观察: 在各孔添加适当的完全培养基覆盖琼脂表面, 防止表面干燥, 然后放入37 ℃, 含50 mL/L CO2的培养箱中培养, 每隔1-2 d补加适量培养基, 连续培养至14 d, 参考Li et al[8]的方法, 将≥50 μm或50个细胞的细胞团视为一个克隆, 观察所形成的克隆数目, 并计算克隆形成率. 克隆形成率 = 克隆数/接种细胞数×100%.
统计学处理 统计数据用SAS 8.2软件进行处理, 采用t检验, 检验水准α = 0.05.
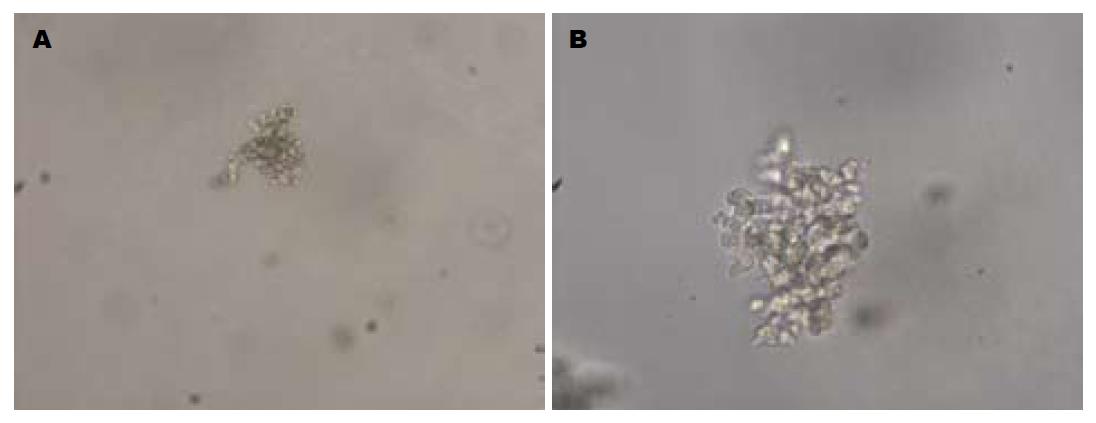
在培养的第1-2天, 细胞呈单个、散在的均匀分布; 第3天时开始形成克隆, 此时的克隆呈桑葚状, 由4-6个细胞组成, 随着克隆的增长, 克隆中心细胞相互重叠, 克隆边缘有不规则的互相延续的单个细胞存在(图1). 随着培养时间的延长, 细胞在2 g/L的上层琼脂中的克隆增殖速度大于其在3 g/L的上层琼脂中的克隆增殖速度.
在克隆培养14 d时, 100、300、500 个/孔的3个实验组在2 g/L的上层琼脂中的克隆形成数分别为35.04±2.11个、170.37±4.23个、294.00±7.65个, 克隆形成率分别为35.04%±2.11%、56.79%±1.53%、58.80%±1.41%; 其在3 g/L的上层琼脂中的克隆形成数分别为28.56±2.31个、149.19±4.74个、260.50±7.50个, 克隆形成率分别为28.56%±2.31%、49.73%±1.58%、52.10%±1.50%. 随着细胞密度的增加, HepG2细胞在2种浓度的上层胶中克隆形成率逐渐增加. 600、800、1000个/孔的3个实验组在2 g/L的上层琼脂中的克隆形成数分别为326.22±11.28个、427.92±18.88个、523.30±12.90个, 克隆形成率分别为54.37%±1.88%、53.49%±2.36%、52.33%±1.29%; 其在3 g/L的上层琼脂中的克隆形成数分别为305.34±11.46个、400.48±11.20个、489.6±13.30个, 克隆形成率分别为50.89%±1.91%、50.06%±1.40%、48.96%±1.33%. 随着细胞密度的逐渐加大, 在2种不同浓度的上层胶中细胞克隆形成率均呈现下降趋势. 从100个/孔到1000个/孔的各个实验组中, HepG2细胞在2 g/L的上层琼脂中的克隆形成率均高于其在3 g/L的上层琼脂中克隆形成率, 经统计学处理, 差异显著(t = 4.36, P<0.05).
对于储备胶的制备, 以往文献报道不一, 有研究者[9]使用50 g/L的琼脂糖凝胶作为储备胶, 亦有人[10-11]使用10 g/L的琼脂糖凝胶作为储备胶, 本课题组通过实验发现50 g/L的凝胶融化速度较慢, 而且由于胶的浓度较大, 在与培养基混合时容易形成小的凝块, 不利于使细胞分布均匀, 从而影响克隆的生长和分离. 10 g/L的琼脂糖凝胶由于浓度低, 不易形成凝块, 细胞分布也较均匀, 因此在进行软琼脂克隆形成实验时, 可以采用10 g/L的琼脂糖凝胶作为储备胶.
祝葆华 et al[12]采用上层琼脂糖浓度为3 g/L的琼脂, HepG2细胞密度为400个/孔, 其结果显示细胞的克隆形成率为50.40%±3.21%. 张鸽文 et al[13]发现, 在相同的上层琼脂糖浓度下, 细胞密度为500个/孔, HepG2细胞的克隆形成率为33.24%±1.91%, 二者的结果提示在上层琼脂糖浓度不变的情况下, 同一细胞的克隆形成率随着细胞密度的改变而发生变化.
本研究结果显示, 在2 g/L的上层琼脂中细胞的克隆数明显多于其在上层琼脂为3 g/L中的克隆数, 提示上层胶浓度増大不利于细胞克隆的形成. 另外, 我们在预实验中发现, 由于1 g/L上层琼脂的硬度较小, 在移动培养板时, 克隆容易移位, 从而与其周围的克隆或细胞混合. 因此在进行软琼脂克隆形成实验时, 可以采用2 g/L的上层琼脂浓度. 本实验还发现, 在细胞密度为100-500个/孔时, HepG2细胞的克隆形成数和克隆形成率随着细胞浓度的增加而逐渐增加; 在细胞密度在500-1000个/孔时, 细胞克隆形成数和克隆形成率均随细胞浓度的升高呈现下降趋势, 表明细胞的克隆形成率并非是随着细胞数量的增加而增加, 而是存在着一个最佳的细胞浓度, HepG2细胞在500个/孔时的克隆形成率最高.
细胞克隆可采用眼科镊挑取[14]或是加样器吸取的方法分离, 然后将取出的单克隆放在96孔板中培养, 而后放入12孔板、6孔板直至培养瓶中扩大培养. 本实验发现, 在上层胶浓度比较稀时, 可以用微量加样器吸取的方法分离克隆, 但用吸取时要注意吸引的力度, 以避免克隆群落边缘细胞向克隆方向的扩散; 在上层胶的浓度较大时, 琼脂具有一定的硬度, 可用眼科镊挑取克隆的方法进行分离.
软琼脂克隆形成实验是一种可用于分离具有不同增值能力的细胞的方法. 通过将单个细胞在软琼脂中形成集落, 可以筛选不同增殖能力的细胞.
梁力建, 教授, 中山大学附属第一医院肝胆外科
本研究通过软琼脂克隆形成实验分离出克隆形成细胞, 并探索了分离细胞克隆的最佳细胞密度和最佳琼脂浓度.
软琼脂克隆形成实验可用于分离不同增殖能力的细胞, 为肿瘤的基础与临床研究提供基础.
本研究选题实用, 设计尚可, 结果可靠, 具有很好的参考价值.
编辑: 李军亮 电编: 何基才
| 1. | Helgason CD, Miller CL. Basic cell culture protocols. New Jersey: Humana Press 2002; 72. |
| 2. | 谢 斌, 左 莉, 江 志奎, 徐 大林, 朱 华庆, 周 青, 胡 若磊, 桂 淑玉, 汪 渊. 全反式维甲酸诱导HepG2细胞分化和降低软琼脂克隆形成. 安徽医科大学学报. 2007;42:143-146. |
| 3. | Hansen NJ, Wylie RC, Phipps SM, Love WK, Andrews LG, Tollefsbol TO. The low-toxicity 9-cis UAB30 novel retinoid down-regulates the DNA methyltransferases and has anti-telomerase activity in human breast cancer cells. Int J Oncol. 2007;30:641-650. [PubMed] |
| 4. | Ikezoe T, Hisatake Y, Takeuchi T, Ohtsuki Y, Yang Y, Said JW, Taguchi H, Koeffler HP. HIV-1 protease inhibitor, ritonavir: a potent inhibitor of CYP3A4, enhanced the anticancer effects of docetaxel in androgen-independent prostate cancer cells in vitro and in vivo. Cancer Res. 2004;64:7426-7431. [PubMed] [DOI] |
| 5. | Dou J, Pan M, Wen P, Li Y, Tang Q, Chu L, Zhao F, Jiang C, Hu W, Hu K. Isolation and identification of cancer stem-like cells from murine melanoma cell lines. Cell Mol Immunol. 2007;4:467-472. [PubMed] |
| 6. | Zhu BH, Yao ZX, Luo SJ, Jiang LM, Xiao JW, Liu SC, Liu JB, Sun JM, Pei ZY. Effects of antisense oligonucleotides of PKC-alpha on proliferation and apoptosis of HepG2 in vitro. Hepatobiliary Pancreat Dis Int. 2005;4:75-79. [PubMed] |
| 7. | Simile MM, De Miglio MR, Muroni MR, Frau M, Asara G, Serra S, Muntoni MD, Seddaiu MA, Daino L, Feo F. Down-regulation of c-myc and Cyclin D1 genes by antisense oligodeoxy nucleotides inhibits the expression of E2F1 and in vitro growth of HepG2 and Morris 5123 liver cancer cells. Carcinogenesis. 2004;25:333-341. [PubMed] [DOI] |
| 8. | Li X, Pan Y, Fan R, Jin H, Han S, Liu J, Wu K, Fan D. Adenovirus-delivered CIAPIN1 small interfering RNA inhibits HCC growth in vitro and in vivo. Carcinogenesis. 2008;29:1587-1593. [PubMed] [DOI] |
| 9. | 乔 玲, 徐 治立, 谭 旭, 叶 丽虹, 张 晓东. 间充质干细胞释放Dkk-1抑制乳腺癌细胞Wnt/β-catenin途径的实验研究. 生物化学与生物物理进展. 2007;34:702-708. |
| 14. | 章 静波, 张 世馥, 黄 东阳. 组织和细胞培养技术. 第1版. 北京: 人民卫生出版社 2002; 154-155. |