修回日期: 2009-06-24
接受日期: 2009-06-29
在线出版日期: 2009-07-08
目的: 探讨细胞外基质金属蛋白酶诱导因子(EMMPRIN)、人表皮生长因子受体2(HER-2/neu)蛋白表达与人胃癌侵袭转移的关系, 以及2种蛋白表达之间的关系.
方法: 应用量子点免疫荧光组织化学技术检测人胃癌组织芯片150芯(包括70例胃癌组织和5例正常胃黏膜组织)中EMMPRIN和HER2的蛋白表达, 并分析他们与临床病理特征的相关性.
结果: 胃癌和正常胃黏膜组织中的EMMPRIN阳性表达率分别为72.86%和20.00%, 差异有显著性(P = 0.029). 在胃癌组织中HER-2蛋白的阳性率为47.14%(33/70), 高于正常胃黏膜组织, 但差异无显著性(P = 0.063). EMMPRIN、HER-2蛋白表达与胃癌患者年龄、性别、分化程度、肿瘤的浸润深度以及临床TNM分期之间差异均无显著性(P>0.05), 仅与淋巴结转移显著相关(P<0.05). 在70例胃癌组织中EMMPRIN与HER-2蛋白表达之间呈显著正相关(r = 0.383, P = 0.001).
结论: EMMPRIN与HER-2/neu可能协同促进了胃癌的淋巴结转移.
引文著录: 高俊, 陈洪雷, 薛敬玲, 朱润庆. EMMPRIN、HER-2蛋白表达与胃癌侵袭转移的关系. 世界华人消化杂志 2009; 17(19): 1952-1956
Revised: June 24, 2009
Accepted: June 29, 2009
Published online: July 8, 2009
AIM: To investigate the correlation of the expression of extracellular matrix metalloproteinase inducer (EMMPRIN) and human epidermal growth factor receptor 2 (HER-2/neu) with the invasiveness and metastasis of human gastric carcinomas, as well as the correlation between the expression of these two proteins in human gastric carcinoma.
METHODS: The expression of EMMPRIN and HER-2 proteins was detected by quantum dot-based immunofluorescence histochemistry using 150 tissue microarrays containing 70 gastric carcinoma specimens and 5 normal gastric mucosal specimens to analyze the correlation of their expression with the clinicopathologic characteristics of gastric carcinoma.
RESULTS: The positive rate of EMMPRIN protein in the gastric carcinoma was significantly higher than that in normal gastric mucosa (72.86% vs 20.00%, P = 0.029), whereas no significant difference (P = 0.063) was observed in the positive rate of HER-2 protein though the rate in the gastric carcinoma (47.14%) was higher than that in normal gastric mucosa. EMMPRIN and HER-2 protein expression was not correlated with patient age and sex, the degree of differentiation, the depth of tumor invasion and clinical TNM stage (P > 0.05), but significantly associated with lymph node metastasis (P < 0.05). Moreover, a positive correlation was observed between the expression of EMMPRIN and HER-2 proteins in 70 gastric carcinoma specimens (r = 0.383, P = 0.001).
CONCLUSION: EMMPRIN and HER-2 may synergistically promote the lymph node metastasis of gastric carcinomas.
- Citation: Gao J, Chen HL, Xue JL, Zhu RQ. Correlation of the expression of EMMPRIN and HER-2 proteins with the invasiveness and metastasis of human gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2009; 17(19): 1952-1956
- URL: https://www.wjgnet.com/1009-3079/full/v17/i19/1952.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i19.1952
胃癌是严重危害人类健康的常见恶性肿瘤之一. 胃癌的扩散及转移是导致患者死亡的重要原因. 细胞外基质金属蛋白酶诱导因子(extracellular matrix metalloproteinase inducer, EMMPRIN)属于免疫球蛋白超家族, 在多种肿瘤细胞和组织中高表达, 通过诱导基质金属蛋白酶(matrix metalloproteinase, MMP)的分泌促进肿瘤的浸润、转移[1]. 人表皮生长因子受体2(human epidermal growth factor receptor 2, HER-2/neu)基因是一种原癌基因. 体内外研究证实HER-2癌基因也是肿瘤转移驱动因子, 即HER-2过度表达的恶性肿瘤具有更强的侵袭、转移能力, 预后较差[2]. 关于EMMPRIN和HER-2联合检测与人胃癌侵袭转移的关系国内外鲜见相关报道. 本研究利用新型量子点(quantum dots, QDs)免疫荧光组织化学技术检测EMMPRIN和HER-2蛋白在人胃癌组织芯片上的表达及其与胃癌侵袭转移的关系, 以及EMMPRIN和HER-2蛋白表达之间的相关性, 为胃癌侵袭转移及预后判断提供客观指标.
STC150芯片4张由桂林泛谱生物技术有限公司构建, 15×10点阵, 每点直径1.1 mm, 4 μm厚, 其中包括70例胃癌组织, 5例正常胃黏膜组织, 每例组织均有2点. 所有组织来自临床外科切除标本, 经40 g/L中性甲醛溶液固定24 h. 胃癌患者中, 男47例, 女23例, 年龄26-80(平均56.8)岁. 参照1997年美国癌肿委员会(AJCC)拟订的胃癌TNM分期标准: Ⅰ+Ⅱ期59例, Ⅲ+Ⅳ期11例. 伴有淋巴结转移的胃癌组织36例, 不伴有淋巴结转移的胃癌组织34例. 根据癌细胞分化程度: 高分化11例, 中分化26例, 低分化33例. 兔抗人EMMPRIN多克隆抗体、鼠抗人HER-2 mAb(Santa Cruz公司, 工作浓度均为1:100); 羊抗兔/鼠生物素化二抗; 量子点超敏荧光试剂盒(Quantum dots streptavidin conjugate, QDs-SA)以上试剂均购自武汉珈源量子点技术开发有限责任公司.
采用量子点免疫荧光组织化学方法检测胃癌组织芯片中EMMPRIN和HER-2的蛋白表达. 操作步骤严格按试剂盒说明书进行. 组织芯片滴加900 mL/L甘油封片后, 上荧光显微镜蓝光激发QDs, 以细胞内出现橙红色的荧光颗粒为阳性. 用TBS代替一抗作阴性对照, 以已知阳性片作阳性对照. 镜下观察显示EMMPRIN和HER-2蛋白阳性信号主要定位于细胞膜内. 参照文献[3]方法, 在高倍镜下取4个不同视野, 各计数200个细胞, 按阳性细胞所占的百分比计算: "-"为阴性, "+"为阳性细胞≤10%, "++"为11%-50%, "+++"为>51%. "++"及以上则判断为阳性表达.
统计学处理 采用χ2检验和四格表的精确概率法判断EMMPRIN、HER-2蛋白表达与胃癌临床病理特征的关系, 并运用Spearman等级相关系数来判断EMMPRIN、HER-2蛋白表达之间的相互关系. P<0.05具有统计学意义. 所有数据均在SPSS13.0软件上进行.
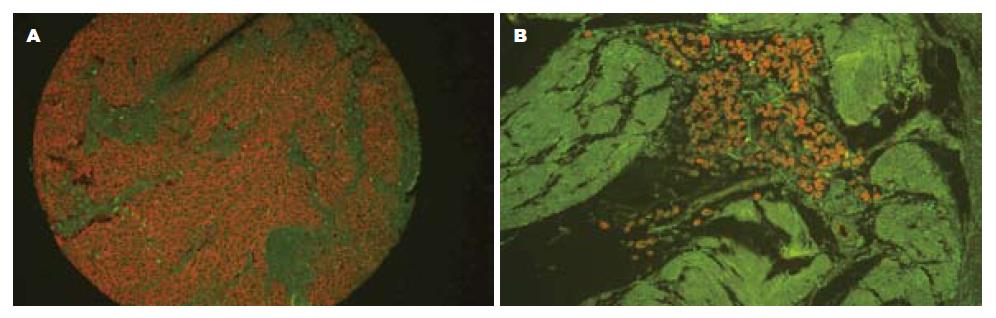
EMMPRIN蛋白主要表达在癌细胞膜和胞质, 其表达呈明显的异质性, 在肿瘤浸润的边缘部位阳性细胞数有相对增加的趋势, 而在癌旁正常腺体和间质细胞中也有少量表达(图1). 胃癌和正常胃黏膜组织中的EMMPRIN蛋白的阳性表达率分别为72.86%和20.00%, 差异有显著性(P =0.029, 表1). EMMPRIN蛋白表达阳性率与胃癌患者年龄、性别、肿瘤浸润深度、分化程度和临床TNM分期之间的差异均无显著性(P>0.05). 有淋巴结转移的癌组织中EMMPRIN蛋白的阳性表达率明显高于无淋巴结转移组(83.33% vs 61.76%, P = 0.043, 表2).
| 分组 | n | EMMPRIN | HER-2 | ||
| - | + | - | + | ||
| 正常胃组织 | 5 | 4 | 1 | 5 | 0 |
| 胃癌组织 | 70 | 19 | 51 | 37 | 33 |
| 临床病理 | n | EMMPRIN | P值 | HER-2 | P值 | ||
| - | + | - | + | ||||
| 性别 | 0.315 | 0.729 | |||||
| 男 | 47 | 11 | 36 | 25 | 21 | ||
| 女 | 23 | 8 | 15 | 12 | 12 | ||
| 年龄(岁) | 0.363 | 0.358 | |||||
| ≤60 | 38 | 12 | 26 | 22 | 16 | ||
| >60 | 32 | 7 | 25 | 15 | 17 | ||
| 肿瘤浸润深度 | 0.194 | 0.607 | |||||
| T1 | 4 | 1 | 3 | 3 | 1 | ||
| T2 | 18 | 2 | 16 | 10 | 8 | ||
| T3 | 48 | 16 | 32 | 24 | 24 | ||
| 分化程度 | 0.745 | 0.678 | |||||
| 高 | 11 | 4 | 7 | 7 | 4 | ||
| 中 | 26 | 7 | 19 | 14 | 12 | ||
| 低 | 33 | 8 | 25 | 16 | 17 | ||
| TNM分期 | 0.715 | 0.064 | |||||
| Ⅰ+Ⅱ | 59 | 17 | 42 | 34 | 25 | ||
| Ⅲ+Ⅳ | 11 | 2 | 9 | 3 | 8 | ||
| 淋巴结转移 | 0.043 | 0.016 | |||||
| 有 | 36 | 6 | 30 | 14 | 22 | ||
| 无 | 34 | 13 | 21 | 23 | 11 | ||
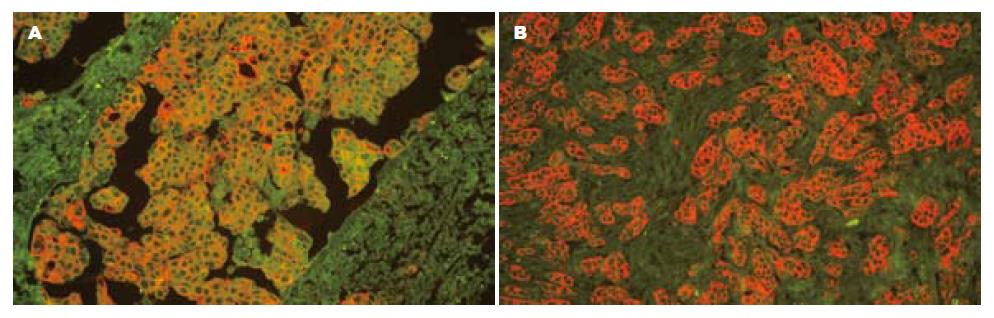
HER-2蛋白主要表达于癌细胞膜, 而在正常胃黏膜和癌旁组织中均为阴性(图2). 在70例胃癌标本中HER-2蛋白阳性率为47.14%, 与正常胃黏膜组织相比, 差异无显著性(P = 0.063, 表1). HER-2蛋白表达与临床病理特征的关系见表2. HER-2蛋白表达阳性率与患者的性别、年龄、分化程度、肿瘤的浸润深度以及临床TNM分期均无相关性(P>0.05), 而淋巴结转移呈显著相关(P = 0.016).
在70例人胃癌组织中有51例EMMPRIN蛋白呈阳性表达, 其中HER-2有30例也呈阳性, EMMPRIN蛋白阴性表达的19例中, HER-2有16例也呈阴性, 二者呈显著正相关(P = 0.001, r = 0.383).
组织芯片又称为组织微阵列技术, 他的特点是体积小, 信息含量高, 一次性实验即可获大量结果. 本研究采用150芯胃癌组织芯片, 双芯布阵, 仅用几张芯片即完成了全部实验, 极大节约了研究经费和降低了工作量, 在最短的时间内获得了胃癌中EMMPRIN和HER-2蛋白表达的全部数据. 与传统的病理学技术方法相比, 所得结果均一可靠, 可比性强, 具有省时、经济、信息量大等优点, 有十分广阔的应用前景. 新型荧光半导体纳米微晶体-量子点与传统的有机荧光标记试剂相比, 其激发光谱宽而连续, 吸光系数大, 荧光强度高, 荧光发射峰窄而对称, 具有耐光漂白, 可以经受反复多次的激发, 并点亮了病理学, 可用于肿瘤的分子诊断和影像学检查[4].
EMMPRIN在人体内广泛分布, 具有多种不同的功能, 而他在肿瘤的生长、浸润和转移中的作用是目前肿瘤细胞生物学领域的研究热点之一. EMMPRIN在人胃癌组织中的研究报道鲜见, Zheng et al[5]在胃癌中的研究认为, EMMPRIN的表达水平与微血管密度(MVD)呈正相关, EMMPRIN表达的上调有助于胃癌的发生发展和局部浸润. EMMPRIN表达也是肠型胃癌具有高增殖和发生肝转移的分子基础[6].
在本研究中, 胃癌和正常黏膜组织中的EMMPRIN蛋白的阳性表达差异有显著性, 表明EMMPRIN蛋白与胃癌组织产生的异质性蛋白有关联. EMMPRIN蛋白表达阳性率与胃癌患者年龄、性别和分化程度之间, 差异均无统计学意义, 提示EMMPRIN蛋白表达与胃癌患者的性别和年龄无关, 也与胃癌细胞的分化程度没有相关性. 胃癌不同临床分期和肿瘤浸润深度中的EMMPRIN蛋白的表达均有所不同, 但差异均无显著性, 仅在有淋巴结转移的癌组织中EMMPRIN蛋白的阳性表达率为83.33%(30/36)明显高于无淋巴结转移组61.76%(21/34)(P = 0.043), 表明EMMPRIN蛋白表达与胃癌向深层浸润关系不明显但与淋巴结的转移密切相关, 与文献报道结果部分相同[5,7]. 还需扩大病例数继续深入研究EMMPRIN与胃癌浸润深度和临床TNM分期的关系.
HER-2在正常人体腔上皮、腺上皮等组织中可有微弱的表达, 但无基因扩增, 其在组织中的过度表达与细胞的癌变有关, 因此, 检测组织中过度表达的HER-2蛋白产物, 便可间接反映HER-2癌基因的扩增[8]. 而在某些人类肿瘤中有HER-2过表达, 其表达在某些肿瘤的发生和发展中起重要作用, 并对肿瘤的预后和治疗产生影响. 但有关HER-2基因与胃癌关系的研究较少, 且结论不一, 有学者认为该基因的过表达与胃癌组织的不同分化程度之间显著相关, 而与肿瘤大小、TNM分期和预后无明显关系[9], 还有学者认为该基因的过表达与胃癌患者良好预后相关[10]. Lee et al[11]认为HER-2的表达与胃癌的早期发生和组织学类型相关. 大多数研究表明, HER-2是胃癌的一个不良的预后因素和治疗靶点[12].
大多数免疫组织化学染色结果报道表明, 胃癌组织中HER-2蛋白定位于胞膜的阳性率为10%-45%[13-14]. 而本研究中HER-2蛋白在正常胃黏膜中均未见阳性表达, 而在70例胃癌中表达率为47.14%, 表明HER-2的过表达可能与胃癌的发生有关, 他可作为胃癌诊断的辅助指标. 本研究中, HER-2蛋白表达与患者的性别、年龄和肿瘤的浸润深度无明显相关性(P>0.05), 表明癌基因HER-2在胃癌中的表达无性别和年龄的差异, 随着原发肿瘤向深处浸润, HER-2蛋白表达的阳性率差异无显著性, 提示胃黏膜一旦发生癌变, 即可有稳定的HER-2表达; HER-2蛋白表达的阳性率在高、中和低分化的胃癌中、不同临床TNM分期之间差异均无显著性(P>0.05), 揭示了HER-2蛋白与胃癌的细胞分化程度和临床TNM分期均无关. 以上结果与Oshima et al[14]的报道一致. 本研究还发现在伴有局部淋巴结转移的36例胃癌中, HER-2阳性表达22例(61.11%), 而在不伴有局部淋巴结转移的34例胃癌中, HER-2阳性表达11例(32.35%), 两组间差异有显著性(P = 0.016), 提示HER-2蛋白表达与胃癌的淋巴结转移密切相关.
虽然EMMPRIN在肿瘤细胞中呈高表达, 但在肿瘤进展中诱导他表达的因子人们知道得很少. 研究表明, 双调蛋白(amphiregulin, AR)和表皮生长因子(epidermal growth factor, EGF)是一种能诱导EMMPRIN表达的调节效应剂, 可以通过EGFR酪氨酸蛋白激酶的激活诱导EMMPRIN表达, 同时AR和EGF的反义cDNA可以抑制EMMPRIN的表达和MMP活性, 从而证实EGFR信号在此调节过程中具有决定性的作用[15]. 本研究发现, EMMPRIN与HER-2在胃癌各临床病理特征分组中, 有着相似的表现. EMMPRIN和HER-2在胃癌细胞中多同时表达, 联合表达率为42.86%(30/70), EMMPRIN和HER-2表达具有显著正相关, 提示EMMPRIN和HER-2可能通过共同调节MMPs的活性协同促进胃癌的淋巴结转移. 鉴于EMMPRIN和HER-2均阳性表达与胃癌淋巴结转移的密切关系, 对EMMPRIN和HER-2阻抑剂进一步探索, 可能成为抑制胃癌浸润转移的一条新途径, 对于改善胃癌患者预后具有重要意义.
胃癌是消化系常见的恶性肿瘤, 患者就诊时多数已属中晚期, 常形成深度浸润或难治的复发及转移, 死亡率较高. 胃癌的浸润转移是多步骤、多因素参与的复杂过程, 多种相关基因的激活是导致肿瘤细胞发生浸润转移的重要因素. 而量子点是一种新型的生物荧光探针. 本研究采用量子点免疫荧光组织化学和组织芯片技术检测人胃癌组织中EMMPRIN和HER2的蛋白表达, 并分析其与临床病理特征的相关性.
刘勇钢, 副主任医师, 天津市传染病医院病理科
随着分子生物学技术的进展, EMMPRIN和HER2对肿瘤的发生、发展、浸润和转移以及预后和治疗的指导作用逐渐被人们所重视, 研究EMMPRIN和HER2的作用机制及其信号转导途径将会是今后研究的热点, 相信阻断其表达或功能将能更有效地抑制肿瘤的浸润和转移.
相关研究表明, EMMPRIN是一类属于免疫球蛋白超家族的跨膜糖蛋白, 已被证实是一种在肿瘤细胞中高度表达的胞膜监视分子, 能刺激肿瘤细胞周围的成纤维细胞及肿瘤细胞产生基质金属蛋白酶(MMPs), 从而促进肿瘤细胞的浸润和转移. 目前大量的研究发现, HER-2在胎盘、胚胎上皮组织及许多恶性肿瘤(乳腺、卵巢、肺、胃、前列腺等)细胞中呈高表达, 而在正常组织中为阴性或微量表达. HER-2表达水平及其活性的变化, 增加了肿瘤细胞的浸润和转移, 并且与其预后不良有关.
本课题采用量子点免疫荧光和组织芯片技术对EMMPRIN和HER2蛋白在正常胃黏膜和胃癌组织中的表达进行了分析, 结果提示EMMPRIN和HER2可能协同促进了胃癌的淋巴结转移. 量子点免疫荧光组织化学技术能很好地检测石蜡包埋组织中诸多抗原的表达.
量子点(QD): 是一种由Ⅱ-Ⅵ族或Ⅲ-Ⅴ族元素组成, 粒径约为2 nm -6 nm, 能够接受激发光产生荧光的半导体纳米微晶体, 目前研究较多的主要是CdX(X = S、Se、Te). 与传统的荧光标记试剂如罗丹明6G相比, 量子点具有以下特性: (1)荧光强度高, 是罗丹明6G的20倍; (2)荧光稳定, 是罗丹明6G的100倍以上, 耐光漂白; (3)颜色丰富, 不同粒径大小的量子点具有不同的颜色, 用同一波长的光可激发多种颜色的量子点, 使多组分同时检测成为可能. 这些独特的光学特性, 使量子点成为一种最佳的荧光标记物应用于生物医学领域.
本研究选题新颖, 研究内容重要, 对临床医师有一定的参考价值.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Dalberg K, Eriksson E, Enberg U, Kjellman M, Bäckdahl M. Gelatinase A, membrane type 1 matrix metalloproteinase, and extracellular matrix metalloproteinase inducer mRNA expression: correlation with invasive growth of breast cancer. World J Surg. 2000;24:334-340. [PubMed] [DOI] |
| 2. | Meert AP, Martin B, Paesmans M, Berghmans T, Mascaux C, Verdebout JM, Delmotte P, Lafitte JJ, Sculier JP. The role of HER-2/neu expression on the survival of patients with lung cancer: a systematic review of the literature. Br J Cancer. 2003;89:959-965. [PubMed] [DOI] |
| 4. | Tholouli E, Sweeney E, Barrow E, Clay V, Hoyland JA, Byers RJ. Quantum dots light up pathology. J Pathol. 2008;216:275-285. [PubMed] [DOI] |
| 5. | Zheng HC, Takahashi H, Murai Y, Cui ZG, Nomoto K, Miwa S, Tsuneyama K, Takano Y. Upregulated EMMPRIN/CD147 might contribute to growth and angiogenesis of gastric carcinoma: a good marker for local invasion and prognosis. Br J Cancer. 2006;95:1371-1378. [PubMed] [DOI] |
| 6. | Zheng H, Takahashi H, Murai Y, Cui Z, Nomoto K, Miwa S, Tsuneyama K, Takano Y. Pathobiological characteristics of intestinal and diffuse-type gastric carcinoma in Japan: an immunostaining study on the tissue microarray. J Clin Pathol. 2007;60:273-277. [PubMed] [DOI] |
| 7. | 唐 忠辉, 陈 华生, 邹 宗楷, 蔡 韶滨, 苏 海燕, 沈 洪武, 吴 文乔, 林 莉, 王 元亨. TFF3和CD147在不同胃黏膜病变中的表达及其与血管生成的关系. 世界华人消化杂志. 2008;16:3631-3636. [DOI] |
| 8. | Lohrisch C, Piccart M. An overview of HER2. Semin Oncol. 2001;28:3-11. |
| 9. | Lee KE, Lee HJ, Kim YH, Yu HJ, Yang HK, Kim WH, Lee KU, Choe KJ, Kim JP. Prognostic significance of p53, nm23, PCNA and c-erbB-2 in gastric cancer. Jpn J Clin Oncol. 2003;33:173-179. [PubMed] [DOI] |
| 10. | Jain S, Filipe MI, Gullick WJ, Linehan J, Morris RW. c-erbB-2 proto-oncogene expression and its relationship to survival in gastric carcinoma: an immunohistochemical study on archival material. Int J Cancer. 1991;48:668-671. [PubMed] [DOI] |
| 11. | Lee SW, Kang SB, Kim YS, Nam SW, Lee DS, Lee HK, Han SW. [Expression of c-erbB-2 and c-met proteins in gastric adenoma and adenocarcinoma]. Korean J Gastroenterol. 2007;49:152-157. [PubMed] |
| 12. | Gravalos C, Jimeno A. HER2 in gastric cancer: a new prognostic factor and a novel therapeutic target. Ann Oncol. 2008;19:1523-1529. [PubMed] [DOI] |
| 13. | Kim MA, Jung EJ, Lee HS, Lee HE, Jeon YK, Yang HK, Kim WH. Evaluation of HER-2 gene status in gastric carcinoma using immunohistochemistry, fluorescence in situ hybridization, and real-time quantitative polymerase chain reaction. Hum Pathol. 2007;38:1386-1393. [PubMed] |
| 14. | Oshima CT, Lanzoni VP, Iriya K, Forones NM. C-erbB-2 oncoprotein in gastric carcinoma: correlation with clinical stage and prognosis. Int J Biol Markers. 2001;16:250-254. [PubMed] |
| 15. | Menashi S, Serova M, Ma L, Vignot S, Mourah S, Calvo F. Regulation of extracellular matrix metalloproteinase inducer and matrix metalloproteinase expression by amphiregulin in transformed human breast epithelial cells. Cancer Res. 2003;63:7575-7580. [PubMed] |