修回日期: 2009-05-21
接受日期: 2009-06-08
在线出版日期: 2009-07-08
目的: 探讨常氧及缺氧培养条件下RNA干扰沉默人食管鳞癌细胞Eca-109缺氧诱导因子-1α(HIF-1α)对血管生成拟态相关基因表达的影响.
方法: 选择未转染处理的食管鳞癌Eca-109细胞和3株稳定转染HIF-1α SiRNA的Eca-109细胞, 分别予以常氧和缺氧培养, 缺氧培养12、24、36、48、60、72、96 h, 采用Western blot法和逆转录聚合酶链反应(RT-PCR)检测HIF-1α蛋白及mRNA表达, 同时Western blot法检测上皮细胞激酶(EphA2)、血管上皮钙黏附素(VE-cadherin)、基质金属蛋白酶-2(MMP-2)、层粘连蛋白5γ2链(LN-5γ2)等血管生成拟态相关基因的表达.
结果: 缺氧条件下培养Eca-109细胞HIF-1α蛋白表达较常氧时增高, 以24-48 h为明显, 72-96 h开始减弱, 而HIF-1α mRNA检测差异无统计学意义(F = 0.70, P = 0.67); RNA干扰后细胞在常氧下HIF-1α、EphA2、LN-5γ2蛋白几乎无表达, 缺氧后亦无增强现象, VE-cadherin、MMP-2蛋白表达较未干扰细胞稍有减弱, 缺氧后表达稍增强, 但差异无显著性(均P>0.05).
结论: RNA干扰能抑制Eca-109细胞的HIF-1α基因表达, HIF-1α基因沉默后可以不同程度减少EphA2、LN-5γ2等血管生成拟态相关基因的表达.
引文著录: 华杰, 施瑞华, 张红杰, 于莲珍, 朱宏, 肖斌, 张国新, 郝波. RNA干扰HIF-1α对血管生成拟态相关基因表达的影响. 世界华人消化杂志 2009; 17(19): 1913-1918
Revised: May 21, 2009
Accepted: June 8, 2009
Published online: July 8, 2009
AIM: To investigate the effect of RNA interference-based silencing of HIF-1α gene on the expression of vasculogenic mimicry-associated genes in esophageal squamous carcinoma cells (Eca-109) cultured in either a normoxia or a hypoxia environment.
METHODS: Eca-109 cells were divided into four groups, namely, untransfected Eca-109 cells and three different strains of Eca-109 cells stably transfected with HIF-1α siRNA (H2/20, H3/10 and H3/15 strains). After the cells were cultured in a normoxia environment or in a hypoxia environment for 12, 24, 36, 48, 60, 72 and 96 h, respectively, the expression of HIF-1α protein and mRNA was detected by Western blot and semiquantitative reverse transcription-polymerase chain reaction (RT-PCR), and the expression of EphA2, VE-cadherin, matrix metalloproteinase-2 (MMP-2) and laminin-5 gamma-2 chain (LN-5γ2) was determined by Western blot.
RESULTS: After Eca-109 cells were cultured in a hypoxia environment, the expression of HIF-1α protein was upregulated, reaching its peak at 24 and 48 h and beginning to decline at 72 and 96 h. However, there was no significant difference in the expression of HIF-1α mRNA (F = 0.70, P = 0.67). The expression of HIF-1α, EphA2 and LN-5γ2 proteins was hardly detected in HIF-1α-silenced cells, and could not be upregulated in a hypoxia environment. In contrast, the expression of VE-cadherin and MMP-2 proteins was slightly down-regulated in HIF-1α silenced cells, and could be upregulated in a hypoxia environment though the upregulation was not statistically significant (all P > 0.05).
CONCLUSION: RNA interference targeting the HIF-1α gene is able to efficiently silence the expression of HIF-1α gene in human esophageal squamous carcinoma cells (Eca-109) and thereby inhibit the expression of vasculogenic mimicry-associated genes (EphA2, VE-cadherin, MMP-2 and LN-5γ2) to a different extent.
- Citation: Hua J, Shi RH, Zhang HJ, Yu LZ, Zhu H, Xiao B, Zhang GX, Hao B. Effect of RNA interference-based silencing of HIF-1α gene on the expression of vasculogenic mimicry-associated genes in esophageal squamous carcinoma cells. Shijie Huaren Xiaohua Zazhi 2009; 17(19): 1913-1918
- URL: https://www.wjgnet.com/1009-3079/full/v17/i19/1913.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i19.1913
缺氧诱导因子-1(hypoxia inducible factor-1, HIF-1)是缺氧条件下广泛存在于哺乳动物和人体内的一种转录因子, 在多数肿瘤组织中均有HIF-1α的过表达. 当实体肿瘤处在低氧环境时, HIF-1活性显著增高, 涉及改善低氧条件的基因血管内皮生长因子(vascular endothelial growth factor, VEGF)、红细胞生成素(erythropoietin, EPO)、葡萄糖转运蛋白1和3、血红素氧化酶1和糖酵解酶等大量的表达, 从而促进肿瘤血管的再生和细胞能量代谢的加强, 导致肿瘤细胞的生物学特性的变化, 这正是肿瘤细胞的一种自我保护机制的体现. 血管生成拟态是近年来在部分恶性实体肿瘤中发现的一种不同于新生毛细血管的肿瘤微循环供血系统, 缺氧条件下更易形成, 其存在对肿瘤的发生发展、侵袭转移等起着非常重要的作用. 食管癌组织中已证实有血管生成拟态现象的存在, 且食管癌细胞中HIF-1α表达阳性, 并与肿瘤分期、浸润深度、淋巴结转移和患者的预后相关. 本研究中, 我们在常氧和缺氧条件下培养RNA干扰前后的食管癌细胞, 检测HIF-1α及血管生成拟态相关基因, 探讨他们之间的联系及HIF-1α在血管生成拟态形成机制和信号传导通路中的可能的作用.
人食管鳞癌细胞Eca-109购自中科院上海细胞所, RNA干扰HIF-1α后经鉴定筛选稳定转染的3株单克隆细胞(H2/20、H3/10、H3/15号细胞)为本实验室构建保存. 胎牛血清及DMEM培养液购自Gibco公司. 总RNA提取试剂TRIzol购自Invitrogen公司, RNA逆转录试剂盒为Fermentas公司产品, PCR试剂2×Tag PCR MasterMix、DNA Marker为北京天根科技公司产品, 普通PCR引物由上海申能博彩公司合成. 鼠抗人HIF-1α mAb、鼠抗人LN5γ2 mAb购自Chemicon公司, 鼠抗人Tubulin-α mAb购自Sigma公司, 鼠抗人EphA2 mAb、鼠抗人VE-cadherin mAb购自R&D公司, 兔抗人MMP-2 mAb购自Abcam公司, HRP标记羊抗鼠、羊抗兔二抗购自上海晶美公司. BCA蛋白定量试剂盒、ECL化学发光试剂盒购自Pierce公司, PVDF膜购自Roche公司, 蛋白预染Marker购自Fermentas公司. 细胞培养箱为Thermo Forma Series II, 厌氧培养箱为上海新苗医疗器械制造有限公司生产的YQX-II型, 普通光学倒置显微镜为Nikon公司ECLIPSETE2000-S型. 普通PCR仪为MyGeneTM Series Peltier Thermal Cycler MG48+, 核酸电泳仪为北京六一仪器厂DYY-6C型, 凝胶成像分析系统为上海天能科技有限公司Tanon 3500. 蛋白电泳及转膜系统为Bio-Rad公司产品, 酶标仪为Bio-Rad公司Model680.
1.2.1 细胞培养: 4组细胞均用含100 mL/L胎牛血清及100 kU/L青霉素和100 mg/L链霉素的DMEM培养液, 在50 mL/L CO2、37 ℃培养箱中培养.
1.2.2 缺氧处理: 细胞传代贴壁后置入缺氧培养箱缺氧处理, 培养箱中混合气体浓度为50 mL/L CO2、850 mL/L N2、100 mL/L H2, 缺氧时间为12、24、36、48、60、72、96 h; 相应设置空白对照组.
1.2.3 半定量RT-PCR检测HIF-1α mRNA的表达: 将常氧和缺氧处理后的各组细胞用TRIzol一步法提取细胞总RNA, 按RNA逆转录试剂盒行逆转录合成cDNA. 引物以Primer 5软件自行设计, 交由上海申能博彩公司合成, HIF-1α上游引物5'-GCAAGACTTTCCTCAGTCGACACA-3', 下游引物5'-GCATCCTGTACTGTCCTGTGGTGA-3', 扩增片段长度207 bp; GAPDH上游引物5'-TGAAGGTCGGAGTCAACGGATTTGGT-3', 下游引物5'-CATGTGGGCCATGAGGTCCACCAC-3', 扩增片段长度983 bp. 体系为20 μL: 10 μL 2×Tag PCR MasterMix, 10 μmol/L HIF-1α上、下游引物各1 μL, 10 μmol/L GAPDH上、下游引物各0.5 μL, 1 μL cDNA, 其余用ddH2O补足, 行HIF-1α及GAPDH双重PCR反应. 程序为: 94 ℃ 8 min→(94 ℃ 28 s→58 ℃ 28 s→72 ℃ 28 s)×28 cycles→72 ℃ 8 min→4 ℃. 扩增结束后取PCR产物上样, 10 g/L琼脂糖凝胶电泳, EB染色, Tanon凝胶成像系统摄片并分析结果.
1.2.4 Western blot检测HIF-1α蛋白及血管生成拟态相关基因的表达: 冷PBS洗细胞2次, 加蛋白裂解液制备总蛋白, 超声破碎后8000 r/min, 离心30 min, 取上清, 重复超声破碎并离心取上清, 采用BCA法定量蛋白浓度. 取总蛋白60 µg于100 ℃加热变性5 min后上样, 行稳流SDS-PAGE电泳, 稳压冰浴电转至PVDF膜, 50 g/L脱脂奶粉室温封闭1 h后TBST漂洗3×5 min, 加入适当浓度一抗(MMP-2 1:2000、EphA2 1:500、LN5γ2 1:200、HIF-1α 1:500、VE-cadherin 1:500、Tubulin-α 1:4000)4 ℃孵育过夜. 次日TBST漂洗3×5 min后再加HRP标记的二抗(羊抗鼠1:5000, 羊抗兔1:4000)室温孵育1 h, TBST漂洗3×5 min. ECL化学发光法显影.
1.2.5 结果灰度分析: Tanon Gis软件对凝胶电泳条带和感光胶片条带进行灰度值分析, 以目的条带与内参照条带的比值代表目的基因mRNA和蛋白的表达水平.
统计学处理 所有数据均在SAS 9.1.3软件下分析, 以mean±SD表示, 分别采用单因素及多因素方差分析, P<0.05认为有统计学意义.
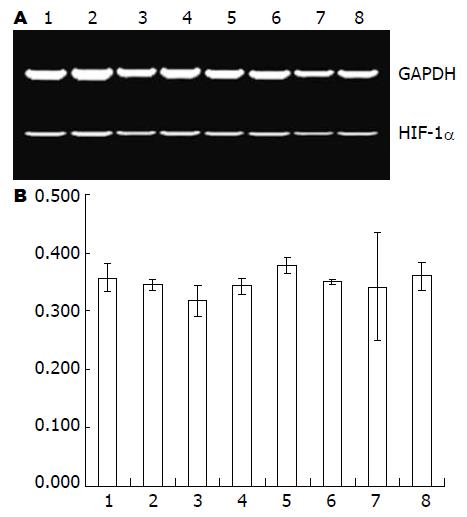
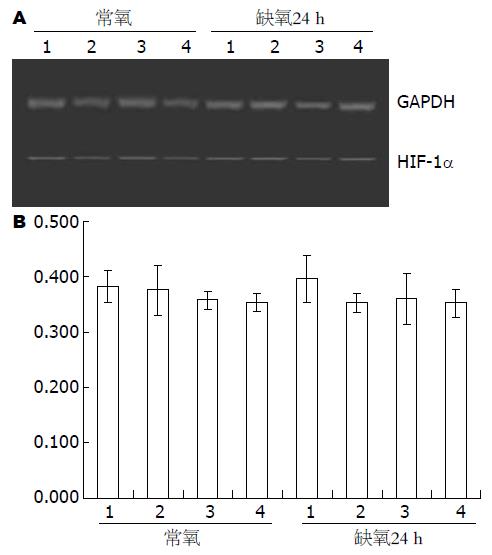
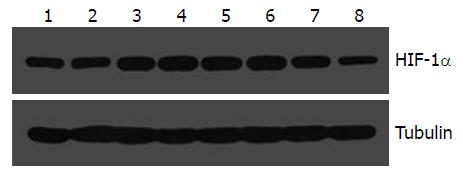
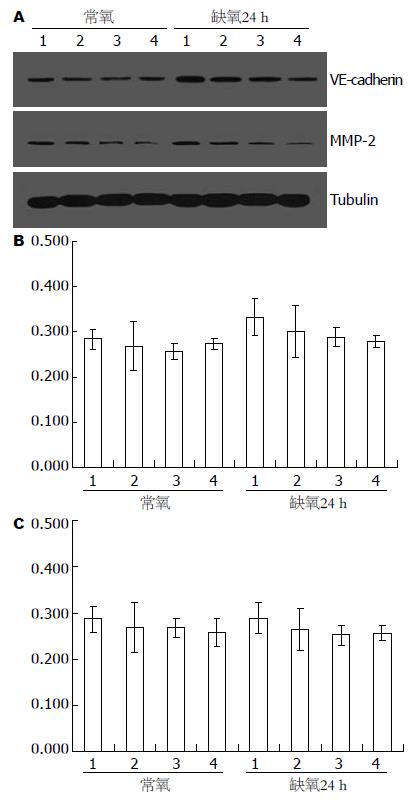
在常氧和缺氧不同时间点检测Eca109细胞HIF-1α的表达, 发现各个时间点HIF-1α mRNA表达无明显差异(F = 0.70, P = 0.67, 图1). Eca109细胞和干扰处理的各组细胞在常氧和缺氧培养24 h后检测, 各组细胞HIF-1α mRNA表达无明显差异(F = 0.02, 0.23, P = 0.8949, 0.8731, 图2). 在Eca-109细胞中HIF-1α蛋白表达在缺氧处理时较常氧培养时增加, 在缺氧后24-48 h明显升高, 60 h略有降低, 72-96 h逐渐减少(图3). 3组RNA干扰的细胞常氧下HIF-1α蛋白表达被明显抑制, 且在缺氧处理后亦无明显递增趋势(图4).
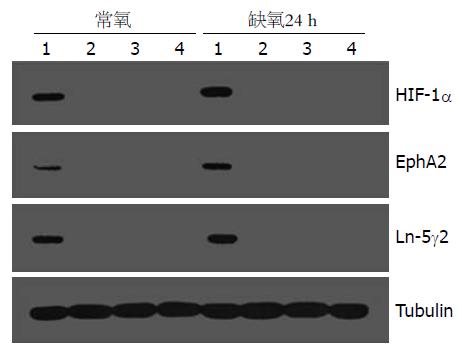
干扰细胞常氧下EphA2、LN5γ2表达比未干扰的Eca-109细胞明显减少, 缺氧处理24 h后亦无明显增加(图4); VE-cadherin、MMP-2表达较未干扰细胞略减少, 缺氧处理后表达稍增强, 但差异无统计学意义(VE-cadherin: F = 0.20, 1.34, P = 0.6637, 0.2922; MMP-2: F = 0.11, 0.20, P = 0.7460, 0.8959, 图5).
肿瘤增生过快造成肿瘤微环境始终处于相对缺氧和代谢紊乱状态, 这是恶性肿瘤的生长特点之一. 研究表明缺氧可触发机体产生一系列应激性保护反应, 新生血管形成和细胞无氧代谢增加是肿瘤细胞得以在缺氧环境下免受损伤或死亡, 继续生长、增殖的重要途径[1-4]. 其中HIF-1的表达和活性增强是肿瘤细胞适应缺氧环境的重要原因. HIF-1由HIF-1α和HIF-1β 2个亚基组成异源二聚体, HIF-1α是主要的氧调节亚基和功能亚基. HIF-1α在常氧下迅速降解而在缺氧时稳定表达并活化[5-6], 因而其在细胞适应缺氧途径中是连接上下游基因激活的重要调节因子. 常氧条件下, HIF-1α的脯氨酸残基被羟化, 导致HIF-1α通过E3泛素化-蛋白酶体途径迅速降解. 缺氧时, 细胞可能通过多个通路感受缺氧, 脯氨酸羟化酶(prolyl hydroxylase, PHDs)无活性, 泛素-蛋白酶体对HIF-1α的降解受阻, HIF-1α大量积聚并转移至细胞核中, 与HIF-1β聚合形成稳定的HIF-1; HIF-1与靶基因的缺氧反应元件(hypoxia-response element, HRE)结合, 形成转录起始复合物, 启动靶基因转录. 目前已知HIF-1的靶基因有60余种, 涉及血管生成、能量代谢、侵袭转移、离子代谢和儿茶酚胺代谢等[7]. 本实验发现, 食管癌细胞(Eca-109)在常氧和缺氧培养各个时间点HIF-1α mRNA表达无明显差异, 而Western blot显示HIF-1α蛋白表达在缺氧处理时较常氧培养时增加. HIF-1α蛋白表达与缺氧有时间依赖关系, HIF-1α mRNA表达没有明显差异, 提示缺氧诱导的HIF-1α调节发生在蛋白水平而非转录水平[8].
RNA干扰是生物进化过程中基因组水平上的免疫监控机制[9], 他作为一种特异性基因沉默技术, 正越来越多的在反向遗传学研究、细胞信号转导通路研究和某些疾病, 如病毒感染、肿瘤及多种遗传相关性疾病的发病机制和治疗学研究中发挥着重要作用. 相对于传统上反义寡核苷酸和核酶等基因沉默手段来说, 由于siRNA具有RNA双链结构和3'端双核苷酸悬垂, 较难被核酶降解, 所以RNA干扰具有更好的稳定性和更优越的抑制效果[10], 是高通量基因功能研究的得力工具. 我们前期设计了3对HIF-1α siRNA寡核苷酸片段, 并通过分子克隆技术成功构建了质粒pGCsi-HIF-1、pGCsi-HIF-2和pGCsi-HIF-3, 经脂质体转染食管鳞癌细胞系Eca-109, 挑克隆筛选稳定转染细胞, 经筛选培养6 mo以上得到几株干扰效率较高的细胞. 本实验所选3株细胞干扰效率均较高, 干扰后HIF-1α蛋白表达明显抑制, 且缺氧后亦无明显增强.
1999年Maniotis et al通过对葡萄膜黑色素瘤微循环的研究, 提出了一种与经典的肿瘤血管生成途径完全不同的肿瘤血管生成模式-血管生成拟态(vasculogenic mimicry, VM), 即在侵袭性的葡萄膜黑色素瘤中的瘤细胞通过自身变形和基质重塑形成一种无内皮细胞被覆的、由细胞外基质界定的微循环管道, 血液可以在这种管腔中流动[11]. 这一现象相继在多种肿瘤中被发现(乳腺癌、卵巢癌、肺癌、前列腺癌、食管癌、滑膜肉瘤、横纹肌肉瘤、嗜铬细胞瘤、星形胶质细胞瘤、食管间质瘤等), 而且发现VM的存在与疾病发展和预后不良相关[12-13]. 所以, VM可能是某些肿瘤的重要微循环体系, 或是血管生成以外的肿瘤微循环的重要补充. 目前VM的生成机制尚不明确, 可能的原因主要是: (1)肿瘤细胞的可塑性机制; (2)基因表达的改变; (3)分子信号传递的改变; (4)微环境的影响. Hess et al[14]发现上皮细胞激酶(epithelial cell kinase, EphA2)在体外培养中参与高度侵袭性黑色素瘤细胞血管样通道的形成. 用酪氨酸激酶抑制剂除莠霉素A抑制EphA2的磷酸化, 则血管样通道无法形成, 去除除莠霉素A则血管样通道又可形成. 免疫沉淀、Western blot、转染等方法进一步验证了EphA2在VM形成中的作用. 血管内皮细胞钙黏附素(vascular endothelial cadherin, VE-cadherin)是促进同种细胞相互作用的跨膜蛋白, 属于钙依赖黏附素家族. Hendrix et al[15]发现VE-cadherin仅表达于高度侵袭性黑色素瘤细胞, 而不见于低度侵袭性黑色素瘤细胞, 下调VE-cadherin的表达将延缓血管样通道的形成. Seftor et al[16]在三维细胞培养中发现层粘连蛋白5γ2链(laminin 5 gamma2 chain, Ln-5γ2 chain)、基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)、膜型基质金属蛋白酶1(membrane type 1-matrix metalloproteinase, MT1-MMP)存在交互作用, 是侵袭性黑色素瘤细胞形成血管样通道所必需的. Hendrix et al[17]在黑色素瘤裸鼠移植瘤模型中发现, 缺氧环境使高侵袭性黑色素瘤细胞恶性细胞基因型发生改变, 成为胚胎样多能干细胞, 塑形性明显提高, 选择性的表达某些血管内皮细胞基因, 使其能够作为血管内皮细胞样细胞参与VM. van der Schaft et al发现尤文氏肉瘤细胞在缺氧诱导下可形成VM. Yao et al[18]研究发现, 缺氧是卵巢上皮癌细胞形成VM的重要诱导因素, 西罗莫司通过抑制HIF-1 mRNA表达阻断VM形成. 本实验选取VE-cadherin、EphA2、Ln-5γ2及MMP-2等4种与血管生成拟态关系密切的基因, 分别检测其常氧、缺氧培养条件下在HIF-1α干扰前后的食管癌细胞中的蛋白表达. 结果显示干扰细胞常氧下EphA2、 LN5γ2表达比未干扰的Eca-109细胞明显减少, 缺氧处理24 h后亦无明显增加, 与HIF-1α表达变化一致; 而VE-cadherin、MMP-2表达较未干扰细胞略减少, 缺氧处理24 h后表达稍增强, 但差异无统计学意义.
总之, 在与血管生成拟态关系密切的4种基因中EphA2与Ln-5γ2表达与HIF-1α一致, 干扰HIF-1α后EphA2与Ln-5γ2蛋白表达几乎消失, 缺氧后亦无增强; 而VE-cadherin与MMP-2干扰后蛋白表达较未干扰细胞稍减弱, 缺氧后略有增强. 我们推测EphA2与Ln-5γ2与HIF-1α关系更为密切, 而VE-cadherin与MMP-2可能受其他影响因素的作用, RNA干扰沉默HIF-1α后可能通过抑制EphA2与Ln-5γ2的表达而抑制血管生成拟态的形成. 为进一步研究HIF-1α在血管生成拟态形成机制中的作用奠定了基础.
研究证实部分恶性肿瘤细胞在缺氧环境下高表达缺氧诱导因子1α, 亦有研究发现部分高度恶性的肿瘤可以形成血管生成拟态, 且在缺氧状态下更为明显.
姜春萌, 教授, 大连医科大学附属第二医院消化科
血管生成拟态是新近发现的一种恶性肿瘤的供血模式, 其确切的发生机制尚未完全明确, 有待进一步研究.
已有研究发现部分高度恶性的肿瘤中存在血管生成拟态现象, 其形成机制及信号传导途径主要涉及肿瘤细胞及细胞微环境2个方面, 其中发挥重要作用的基因包括: 血管上皮钙黏附素(VE-cadherin)、黏附斑激酶(FAK)、上皮细胞激酶(EphA2)、蛋白酪氨酸激酶(TrK)、基质金属蛋白酶(MMP-1、MMP-2、MMP- 9、MMP-14)及层粘连蛋白(LN)等.
由于缺氧条件下肿瘤细胞缺氧诱导因子1α表达明显增强, 且血管生成拟态明显增加, 提示缺氧诱导因子1α在血管生成拟态形成过程中可能发挥一定作用, 可能参与其信号传导通路. 本课题研究缺氧诱导因子1α与血管生成拟态相关基因之间的关系, 为解释缺氧状态下血管生成拟态现象增强提供一定的依据.
本研究揭示了常氧及缺氧状态下食管鳞癌细胞中缺氧诱导因子1α的表达及其与血管生成拟态相关基因之间的关系, 为进一步探索缺氧诱导因子1α在食管鳞癌Eca-109细胞血管生成拟态形成过程中对其信号传导通路调节的分子生物学机制奠定一定的基础.
血管生成拟态(VM): 即在部分恶性肿瘤中, 肿瘤细胞通过自身变形和基质重塑形成一种无内皮细胞被覆的、由细胞外基质界定的微循环管道, 血液可以在这种管腔中流动. 免疫组织化学可见肿瘤细胞围成的PAS染色阳性的管道, 其中可见红细胞, 周围无血管内皮细胞衬附. 是新近发现的一种肿瘤微循环供血模式.
本研究选题新颖, 设计合理, 方法先进, 结果可信, 结论可靠, 具有很好的学术价值.
编辑: 李军亮 电编: 何基才
| 1. | Mizukami Y, Li J, Zhang X, Zimmer MA, Iliopoulos O, Chung DC. Hypoxia-inducible factor-1-independent regulation of vascular endothelial growth factor by hypoxia in colon cancer. Cancer Res. 2004;64:1765-1772. [PubMed] [DOI] |
| 2. | Harris AL. Hypoxia--a key regulatory factor in tumour growth. Nat Rev Cancer. 2002;2:38-47. [PubMed] [DOI] |
| 3. | Ryan HE, Poloni M, McNulty W, Elson D, Gassmann M, Arbeit JM, Johnson RS. Hypoxia-inducible factor-1alpha is a positive factor in solid tumor growth. Cancer Res. 2000;60:4010-4015. [PubMed] |
| 4. | Zhong H, De Marzo AM, Laughner E, Lim M, Hilton DA, Zagzag D, Buechler P, Isaacs WB, Semenza GL, Simons JW. Overexpression of hypoxia-inducible factor 1alpha in common human cancers and their metastases. Cancer Res. 1999;59:5830-5835. [PubMed] |
| 5. | Lando D, Peet DJ, Whelan DA, Gorman JJ, Whitelaw ML. Asparagine hydroxylation of the HIF transactivation domain a hypoxic switch. Science. 2002;295:858-861. [PubMed] [DOI] |
| 6. | Wang GL, Jiang BH, Rue EA, Semenza GL. Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension. Proc Natl Acad Sci USA. 1995;92:5510-5514. [PubMed] [DOI] |
| 7. | Semenza GL. Targeting HIF-1 for cancer therapy. Nat Rev Cancer. 2003;3:721-732. [PubMed] [DOI] |
| 8. | Pisani DF, Dechesne CA. Skeletal muscle HIF-1alpha expression is dependent on muscle fiber type. J Gen Physiol. 2005;126:173-178. [PubMed] [DOI] |
| 9. | Hutvágner G, Zamore PD. RNAi: nature abhors a double-strand. Curr Opin Genet Dev. 2002;12:225-232. [PubMed] [DOI] |
| 11. | Maniotis AJ, Folberg R, Hess A, Seftor EA, Gardner LM, Pe'er J, Trent JM, Meltzer PS, Hendrix MJ. Vascular channel formation by human melanoma cells in vivo and in vitro: vasculogenic mimicry. Am J Pathol. 1999;155:739-752. [PubMed] |
| 12. | Hendrix MJ, Seftor EA, Hess AR, Seftor RE. Vasculogenic mimicry and tumour-cell plasticity: lessons from melanoma. Nat Rev Cancer. 2003;3:411-421. [PubMed] [DOI] |
| 13. | Yue WY, Chen ZP. Does vasculogenic mimicry exist in astrocytoma? J Histochem Cytochem. 2005;53:997-1002. [PubMed] [DOI] |
| 14. | Hess AR, Seftor EA, Gardner LM, Carles-Kinch K, Schneider GB, Seftor RE, Kinch MS, Hendrix MJ. Molecular regulation of tumor cell vasculogenic mimicry by tyrosine phosphorylation: role of epithelial cell kinase (Eck/EphA2). Cancer Res. 2001;61:3250-3255. [PubMed] |
| 15. | Hendrix MJ, Seftor EA, Meltzer PS, Gardner LM, Hess AR, Kirschmann DA, Schatteman GC, Seftor RE. Expression and functional significance of VE-cadherin in aggressive human melanoma cells: role in vasculogenic mimicry. Proc Natl Acad Sci USA. 2001;98:8018-8023. [PubMed] [DOI] |
| 16. | Seftor RE, Seftor EA, Koshikawa N, Meltzer PS, Gardner LM, Bilban M, Stetler-Stevenson WG, Quaranta V, Hendrix MJ. Cooperative interactions of laminin 5 gamma2 chain, matrix metalloproteinase-2, and membrane type-1-matrix/metalloproteinase are required for mimicry of embryonic vasculogenesis by aggressive melanoma. Cancer Res. 2001;61:6322-6327. [PubMed] |
| 17. | Hendrix MJ, Seftor RE, Seftor EA, Gruman LM, Lee LM, Nickoloff BJ, Miele L, Sheriff DD, Schatteman GC. Transendothelial function of human metastatic melanoma cells: role of the microenvironment in cell-fate determination. Cancer Res. 2002;62:665-668. [PubMed] |
| 18. | Yao LQ, Feng YJ, Ding JX, Xu CJ, Jin HY, Yin LH. [Primary study of vasculogenic mimicry induced by hypoxia in epithelial ovarian carcinoma]. Zhonghua Fuchanke Zazhi. 2005;40:662-665. [PubMed] |