修回日期: 2009-05-20
接受日期: 2009-05-25
在线出版日期: 2009-06-28
目的: 探讨大肠癌中表皮生长因子受体(EGFR)、人类表皮生长因子受体-2(HER-2)和血管内皮生长因子(VEGF)的表达特点及其对大肠癌分子靶向治疗的指导意义.
方法: 随机选取2005-05/2009-03中国人民解放军空军总医院普通外科行根治性手术的大肠癌患者78例. 应用免疫组织化学法检测大肠癌肿瘤组织中EGFR、HER-2、VEGF的表达, 并结合其临床病理特点进行回顾性分析.
结果: EGFR、HER-2、VEGF在大肠癌中的阳性表达率依次为38.5%(30/78)、53.8%(42/78)、41.0%(32/78). 三者的表达与性别、年龄、肿瘤部位、分化类型无关, 而与肿瘤的大小、侵袭深度和转移密切相关. EGFR与HER-2及VEGF, HER-2与VEGF在大肠癌肿瘤组织中表达呈正相关(r = 0.421, 0.484, 0.469, P = 0.019, 0.012, 0.016).
结论: EGFR、HER-2、VEGF的表达参与大肠癌的生长、侵袭和转移过程. 三者的联合检测可作为判断大肠癌预后、筛选高危转移患者的有效指标, 同时, 也可用于指导大肠癌的靶向药物治疗.
引文著录: 魏学明, 顾国利, 任力, 熊梅, 王石林, 李德昌. 大肠癌EGFR、HER-2、VEGF表达特点及其对分子靶向治疗的指导意义. 世界华人消化杂志 2009; 17(18): 1836-1841
Revised: May 20, 2009
Accepted: May 25, 2009
Published online: June 28, 2009
AIM: To detect the characteristics of epidermal growth factor receptor (EGFR), human epidermal receptor-2 (HER-2) and vascular endothelial growth factor (VEGF) expression in colorectal carcinoma (CRC) tumor tissues, and to analyze their directive significance for the molecular targeting therapy of colorectal carcinoma (CRC).
METHODS: Seventy eight patients with CRC were randomly selected, who underwent radical surgery in the department of general surgery at our hospital from May 2005 to March 2009. The SP Immunohistochemical staining was used to detect EGFR, HER-2 and VEGF protein expression in 78 CRC tumor tissue samples. And their corresponding clinical data were analysed retrospectively.
RESULTS: The expression rates of EGFR, HER-2 and VEGF protein in CRC tumour tissue were 38.5% (30/78), 53.8% (42/78) and 41.0% (32/78). Positive rates of EGFR, HER-2 and VEGF protein were closely relevant to the tumour size, knubbly invasive depth and lymph node metastasis; but not to the patient's sex, age, tumor site or histology grade. There was a stable positive relationship among EGFR, HER-2 and VEGF expression in CRC tumour tissue samples. The related coefficients were 0.421, 0.484 and 0.469 respectively (P = 0.019, 0.012 and 0.016).
CONCLUSION: The present study demonstrates that the EGFR, HER-2 and VEGF expression participate in the development, invasion and metastasis process of CRC. Their joint detection can be looked as an important symbol for judging the prognosis of CRC, screening the high-risk metastasis patients and guiding the molecular targeting therapy of colorectal carcinoma.
- Citation: Wei XM, Gu GL, Ren L, Xiong M, Wang SL, Li DC. Expression of EGFR, HER-2, VEGF in tumour tissues and their directive significance for the molecular targeting therapy of colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2009; 17(18): 1836-1841
- URL: https://www.wjgnet.com/1009-3079/full/v17/i18/1836.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i18.1836
大肠癌是最常见的消化系恶性肿瘤之一, 虽然临床上对其可采取综合性的治疗措施, 但其发病率和死亡率仍居恶性肿瘤的前列, 且呈逐年上升的趋势[1]. 肿瘤的侵袭、转移仍是大肠癌患者死亡的主要原因[2]. 目前临床上尚缺乏有效预测大肠癌转移和早期诊断的方法. 表皮生长因子受体(epidermal growth factor receptor, EGFR)和人表皮生长因子受体-2(human epidemeal receptor-2, HER-2)都属受体酪氨酸激酶家族HER/erbB家族成员. EGFR参与激活重要的细胞信号通路, 介导细胞分化、生存、迁移、侵袭、黏附和细胞损伤修复等[3]. HER-2和EGFR有近50%的同源性, 在结构和功能上均相似, 可接受表皮生长因子样物质的信息, 刺激细胞增殖, 具有酪氨酸激酶的活性[4]. 而血管内皮生长因子(vascular endothelial growth factor, VEGF)是迄今所发现的最重要的促血管生成因子[5]. 研究发现[6]: EGFR、HER-2、VEGF的过表达与多种实体瘤的侵袭和转移密切相关. 而且, 针对三者的分子靶向治疗药物已经研制并开始进行临床验证. 目前国内综合研究三者在大肠癌侵袭、转移中作用的报道较少, 本研究采用免疫组织化学方法检测大肠癌肿瘤组织中EGFR、HER-2、VEGF的表达, 旨在进一步探讨EGFR、HER-2、VEGF与大肠癌的临床病理特征的关系, 为大肠癌的诊断及预后判断提供客观的参考指标. 同时, 也有助于为分子靶向药物应用于大肠癌的临床治疗提供指导性的理论参考.
随机选取2005-05/2009-03中国人民解放军空军总医院普通外科行根治性手术的大肠癌患者78例; 肿瘤组织标本均经甲醛固定、石蜡包埋, 并经HE染色组织学确诊. 全部患者术前均未行放化疗. 即用型EGFR鼠抗人mAb(产品编号: MAB-0586, 克隆号: H11)、即用型HER-2鼠抗人mAb(产品编号: MAB-0198, 克隆号: CB11)、即用型VEGF鼠抗人mAb(产品编号: MAB-0243, 克隆号: VG1)、即用型SP试剂盒、DAB显色试剂盒均购自福州迈新生物技术开发公司. 试验由LAB Vision Autostainer360自动染色仪系统(福建迈新公司)程控完成、镜下图像以Olympus Dp70图像采集分析仪进行采集、分析.
实验按产品说明书操作. 切片常规脱蜡至水, EGFR经胃酶进行酶消化抗原修复, HER-2经10 mmol/L pH 6.0的EDTA缓冲液进行高压加热抗原修复, VEGF经pH 9.0的EDTA修复液进行水煮加热抗原修复. 30 mL/L H2O2孵育10 min, 蒸馏水冲洗, PBS浸泡5 min, 滴加正常山羊血清工作液孵育20 min; 滴加一抗37 ℃孵育1 h, PBS冲洗3 min×3次. 滴加二抗37 ℃孵育1 h, PBS冲洗3 min×3次. DAB显色, PBS冲洗, 苏木素复染, 脱水, 透明, 封片. PBS代替一抗作阴性对照, 正常大肠黏膜上皮表达情况作阳性对照. 在200倍的视野下随机选取10个视野, 记数每个视野中正常黏膜或肿瘤细胞的染色情况, 取平均值. EGFR定位于细胞质和细胞膜, HER-2定位于细胞膜, VEGF定位于细胞质. 依据染色强度和阳性细胞率来计算评分: 细胞膜或胞质呈淡棕色为1分, 棕黄色2分, 棕褐色3分; 阳性细胞数≤25%为1分, 26%-50%为2分, 51%-74%为3分, ≥75%为4分; 染色的评分与阳性细胞数评分相加: 0-1分(-), 2-3分(+), 4-5分(++), 6-7分(+++). 评分过程由2名高年资病理科医生独立完成.
统计学处理 应用SPSS15.0统计软件包进行统计分析. 计数资料采用2个(或多个)样本率比较的χ2检验, 积分相关性采用Spearman等级相关分析, P<0.05为差异有统计学意义.
本组共有78例, 男42例, 女36例; 年龄37-89(中位年龄67.35±13.32)岁; 肿瘤大小2.2-15.0(平均5.03±2.85) cm; 部位: 结肠30例, 直肠48例; 分化类型: 高、中分化51例, 低分化、黏液腺癌27例; Dukes分期: A期12例, B期39例, C期15例, D期12例.
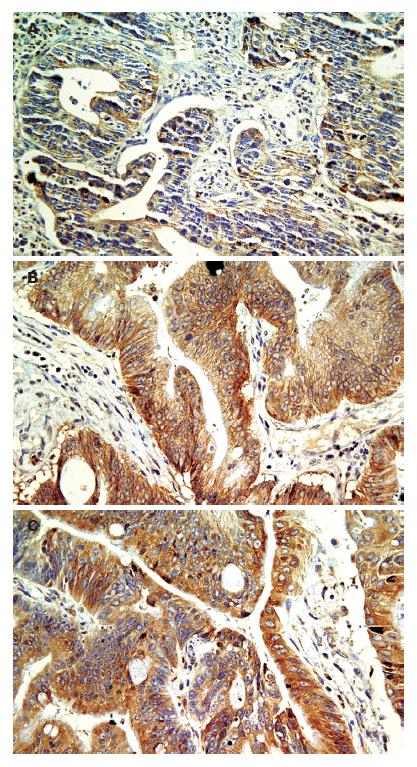
EGFR蛋白呈棕黄色细颗粒表达于胞膜和胞质(图1A); 肿瘤间质不染色. HER-2蛋白主要表达于肿瘤细胞间的胞膜, 呈棕褐色颗粒状; 部分胞质着色, 肿瘤间质不染色(图1B). VEGF蛋白主要表达在胞质, 呈棕褐色颗粒状, 肿瘤间质不染色(图1C). 本组EGFR的阳性表达率为38.5%(30/78), HER-2的阳性表达率为53.8%(42/78), VEGF的阳性表达率为41.0%(32/78).
三者的表达与性别、年龄、肿瘤部位、分化类型无关. 而与肿瘤的大小、侵袭深度和转移密切相关. 即: EGFR、HER-2、VEGF的表达与大肠癌的Dukes分期密切相关.随着肿瘤的增大、侵袭深度加深、出现淋巴结转移, EGFR、HER-2、VEGF的表达阳性率出现有统计学意义的升高(表1).
EGFR、HER-2、VEGF在大肠癌肿瘤组织中表达呈正相关. 其中EGFR和HER-2的相关系数为0.421(P = 0.019); EGFR和VEGF的相关系数为0.484(P = 0.012); HER-2和VEGF的相关系数为 0.469(P = 0.016).
EGFR是原癌基因HER-1的产物; 作为HER/erbB的重要成员, EGFR参与激活Ras/Raf/MEK/ERK/MAPK通路、PI3K/PDK1/Akt(PKB)通路、PLC-γ通路、JAK/STAT通路等重要的细胞信号通路[7], 从而介导细胞分化、生存、迁移、侵袭、黏附和细胞损伤修复等重要功能; 是生物体正常机制得以实现的基础. 研究发现[8-9], EGFR的过表达参与肿瘤的发生和肿瘤细胞的增殖, 且可通过对细胞骨架的重构、黏附、移动、表达及蛋白脂酶的活化等多种机制参与肿瘤细胞的转移. 本研究显示, EGFR在大肠癌肿瘤组织中的阳性表达率为38.5%, 且其表达随着肿瘤增大、侵袭深度加深、出现淋巴结转移而明显增高. 这说明EGFR参与了大肠癌肿瘤细胞的增殖、侵袭和转移等生物学行为. 因此, 抑制EGFR信号通路将可以抑制大肠癌的增殖、侵袭和转移. 目前, 针对EGFR的靶向治疗及其药物的研发是临床肿瘤学的热点; 依药物作用机制的不同, EGFR靶向药物可分为5类[10-12]: (1)针对EGFR胞外域部分的mAb, 如: 西妥昔单抗(Cetuximab, Erbitux)、Matuzumab(EMD72000)和ABX-EGF, 可封闭配体分子对EGFR的激活; (2)针对EGFR激酶区的小分子激酶活性抑制剂, 如: 吉非替尼(Gefitinib/Iressa/ZD1839)、Erlotinib/Tarceva/OSI-774和AG21478, 作为ATP的类似物竞争结合于EGFR的TK区, 抑制EGFR激酶活性; (3)利用RNAi作用机制, 特异性降解EGFR; (4)能识别EGFR的细胞毒素、细胞杀伤因子、放射性粒子等, 选择性杀死富含EGFR肿瘤细胞; (5)阻碍EGFR的二聚化/寡聚化进而抑制EGFR的激活. 目前, EGFR靶向药物多是用于晚期转移性大肠癌的解救治疗[13-15]. 排除药物价格昂贵、临床认知不一致等因素; 就像乳腺癌的内分泌治疗一样, 能否将其作为EGFR过表达的进展期大肠癌、乃至早期大肠癌的一种重要的治疗措施? 这还需要多中心、多学科的继续探索.
HER-2与EGFR同属HER/erbB的成员, 两者具有约50%的同源性, 在结构和功能上均相似, 主要参与细胞生长分化的调节. 正常情况下HER-2处于非激活状态, 当受到体内外某些因素作用后, 其结构或表达调控失常从而被激活, 具有肿瘤转化活性[16]. 研究显示[17-18], 鸟红细胞增多症病毒的HER-2原癌基因产物与EGFR的酶解肽段几乎完全一致. 即使在无配体存在的情况下, 他也可持续激活EGFR的蛋白激酶, 使细胞生长失控, 从而导致肿瘤的发生. 目前, HER-2及其靶向治疗在临床上用于乳腺癌领域的研究已经为学者熟知, 而其在大肠癌领域的研究鲜见报道. 本研究显示, HER-2在大肠癌肿瘤组织中的阳性表达率为53.8%, 且与大肠癌的生长、侵袭和转移相关. 这说明HER-2在大肠癌的生长、侵袭和转移中起着非常重要的作用. 因此, 从理论上讲, 针对HER-2的靶向药物也可以抑制HER-2过表达的大肠癌的侵袭和转移. 曲妥珠单抗(赫赛汀, Herceptin)应用于HER-2过表达的乳腺癌的靶向治疗已经被公认. 能否将其应用于HER-2过表达的晚期大肠癌、甚至进展期大肠癌的治疗? 从而为大肠癌患者提供一个新的治疗手段, 这值得国内外学者去努力探索.
血管生成是肿瘤细胞增殖、侵袭和转移等生物学行为的基础. VEGF是迄今所发现的最重要的促血管生成因子; 可诱导血管内皮细胞增殖, 促使新生血管的内皮细胞成活, 并且增加血管通透性. 新生血管使肿瘤继续生长, 而肿瘤生长又促使VEGF产量增加[19-20]. 研究显示[21-23], VEGF在大部分人类肿瘤中均有过表达, 并且VEGF及其受体的表达与肿瘤预后有着密切的关联. 本研究显示: VEGF在大肠癌肿瘤组织中的阳性表达率为41.0%, 且随着肿瘤增殖、侵袭加深和出现转移而表达明显增高. 这说明VEGF参与了大肠癌的增殖、侵袭和转移等发展过程. 这与文献报道一致[21-23]. 因此, 针对VEGF及其受体的靶向药物有助于抑制大肠癌的增殖、侵袭和转移. 目前已开始在临床应用的贝伐单抗(avastin)是作用于VEGF的人源化mAb, 通过与VEGF受体的特异性结合来阻断VEGF受体的活化, 从而抑制肿瘤区域血管的形成[24]. 针对VEGF受体的药物有SU11248、索拉非尼(BAY43-9006, Sorafenib)、PTK787/ZK222584(Vatalanib)等[25-27]. 这些药物在临床的广泛应用有助于为大肠癌患者的治疗增添新的选择.
总之, 我们认为: 联合检测EGFR、HER-2、VEGF在大肠癌肿瘤组织中的表达可作为判断大肠癌预后、筛选高危转移患者的有效指标. 因与传统化疗药物作用机制不同和不良反应方面不重叠; 所以, 针对EGFR、HER-2、VEGF的靶向治疗药物有利于为大肠癌患者提供另外一个有效的、综合的、个体化的治疗方案.
对于大肠癌的临床靶向治疗, 我们认为尚需解决以下一些问题: (1)分子生物学指标筛查问题. 目前在临床上和文献中对于EGFR、HER-2、VEGF表达的检测多是采用免疫组化方法; 虽简便易行, 但检测结果易受抗体试剂的质量、操作水平等因素的影响, 且无法定量检测. 这也是造成目前文献报道[28-30]中EGFR、HER-2、VEGF的阳性表达率差异非常大(22%-73.8%)的原因. 能否采用更稳定的筛查方法(如: FISH、定量PCR等)或统一试剂标准(如: 固定厂商、固定克隆系)来预防上述免疫组织化学检测方法的缺陷值得学者探讨. (2)进一步明确大肠癌靶向药物治疗与EGFR、HER-2、VEGF表达之间的关系. 如何依据EGFR、HER-2、VEGF的表达情况来制定统一的标准以作为大肠癌靶向治疗的适应证? 这需要多学科学者的通力协作. (3)确定靶向药物治疗大肠癌的最佳时机和剂量. (4)靶向药物与手术、化疗、放疗的联合应用, 以及多种分子靶向药物的联合应用问题. 随着我们对大肠癌生物学特性的了解不断加深, 靶向药物治疗研究的进一步深入将为大肠癌的治疗开辟崭新领域.
大肠癌是最常见的消化系恶性肿瘤之一, 虽然临床上对其可采取综合性的治疗措施, 但其发病率和死亡率仍居恶性肿瘤的前列, 且呈逐年上升的趋势. 肿瘤的侵袭、转移仍是大肠癌患者死亡的主要原因. 目前临床上尚缺乏有效预测大肠癌转移和早期诊断的方法.
李增山, 副教授, 中国人民解放军第四军医大学病理教研室
目前, 针对EGFR的靶向治疗及其药物的研发是临床肿瘤学的热点.
研究显示, 鸟红细胞增多症病毒的HER-2原癌基因产物与EGFR的酶解肽段几乎完全一致. 即使在无配体存在的情况下, 他也可持续激活EGFR的蛋白激酶, 使细胞生长失控, 从而导致肿瘤的发生.
本研究采用免疫组化方法检测大肠癌肿瘤组织中EGFR、HER-2、VEGF的表达, 探讨EGFR、HER-2、VEGF表达与大肠癌的临床病理特征的关系, 这有助于为大肠癌的诊断及预后判断提供客观的参考指标. 同时, 也为针对EGFR、HER-2、VEGF的分子靶向药物应用于大肠癌的临床治疗提供指导性的理论参考.
联合检测EGFR、HER-2、VEGF在大肠癌肿瘤组织中的表达可作为判断大肠癌预后、筛选高危转移患者的有效指标.
本研究设计合理, 方法得当, 论述有据, 有一定的临床指导意义.
编辑: 李军亮 电编: 何基才
| 1. | Kim JC, Kim SY, Roh SA, Cho DH, Kim DD, Kim JH, Kim YS. Gene expression profiling: canonical molecular changes and clinicopathological features in sporadic colorectal cancers. World J Gastroenterol. 2008;14:6662-6672. [PubMed] [DOI] |
| 3. | Ciardiello F, Tortora G. EGFR antagonists in cancer treatment. N Engl J Med. 2008;358:1160-1174. [PubMed] [DOI] |
| 4. | Kavanagh DO, Chambers G, O'Grady L, Barry KM, Waldron RP, Bennani F, Eustace PW, Tobbia I. Is overexpression of HER-2 a predictor of prognosis in colorectal cancer? BMC Cancer. 2009;9:1. [PubMed] [DOI] |
| 6. | Rocha-Lima CM, Soares HP, Raez LE, Singal R. EGFR targeting of solid tumors. Cancer Control. 2007;14:295-304. [PubMed] |
| 9. | Molinari F, Martin V, Saletti P, De Dosso S, Spitale A, Camponovo A, Bordoni A, Crippa S, Mazzucchelli L, Frattini M. Differing deregulation of EGFR and downstream proteins in primary colorectal cancer and related metastatic sites may be clinically relevant. Br J Cancer. 2009;100:1087-1094. [PubMed] [DOI] |
| 12. | Johnston JB, Navaratnam S, Pitz MW, Maniate JM, Wiechec E, Baust H, Gingerich J, Skliris GP, Murphy LC, Los M. Targeting the EGFR pathway for cancer therapy. Curr Med Chem. 2006;13:3483-3492. [PubMed] [DOI] |
| 13. | Buisine MP, Wacrenier A, Mariette C, Leteurtre E, Escande F, Aissi S, Ketele A, Leclercq A, Porchet N, Lesuffleur T. Frequent mutations of the CA simple sequence repeat in intron 1 of EGFR in mismatch repair-deficient colorectal cancers. World J Gastroenterol. 2008;14:1053-1059. [PubMed] [DOI] |
| 14. | Alekshun T, Garrett C. Targeted therapies in the treatment of colorectal cancers. Cancer Control. 2005;12:105-110. [PubMed] |
| 16. | Sirica AE. Role of ErbB family receptor tyrosine kinases in intrahepatic cholangiocarcinoma. World J Gastroenterol. 2008;14:7033-7058. [PubMed] [DOI] |
| 17. | Ochs AM, Wong L, Kakani V, Neerukonda S, Gorske J, Rao A, Riggs M, Ward H, Keville L. Expression of vascular endothelial growth factor and HER2/neu in stage II colon cancer and correlation with survival. Clin Colorectal Cancer. 2004;4:262-267. [PubMed] [DOI] |
| 18. | Ma WW, Adjei AA. Novel agents on the horizon for cancer therapy. CA Cancer J Clin. 2009;59:111-137. [PubMed] [DOI] |
| 20. | Al-Moundhri MS, Al-Shukaili A, Al-Nabhani M, Al-Bahrani B, Burney IA, Rizivi A, Ganguly SS. Measurement of circulating levels of VEGF-A, -C, and -D and their receptors, VEGFR-1 and -2 in gastric adenocarcinoma. World J Gastroenterol. 2008;14:3879-3883. [PubMed] [DOI] |
| 21. | Moehler M, Frings C, Mueller A, Gockel I, Schimanski CC, Biesterfeld S, Galle PR, Holtmann MH. VEGF-D expression correlates with colorectal cancer aggressiveness and is downregulated by cetuximab. World J Gastroenterol. 2008;14:4156-4167. [PubMed] [DOI] |
| 22. | Su JL, Yang PC, Shih JY, Yang CY, Wei LH, Hsieh CY, Chou CH, Jeng YM, Wang MY, Chang KJ. The VEGF-C/Flt-4 axis promotes invasion and metastasis of cancer cells. Cancer Cell. 2006;9:209-223. [PubMed] [DOI] |
| 24. | Goldberg RM, Carrato A. Accomplishments in 2007 in the treatment of advanced colorectal cancer. Gastrointest Cancer Res. 2008;2:S19-S24. [PubMed] |
| 25. | Saltz L. Colorectal Cancer Treatment: What's Next? (or: Is There Life After EGFR and VEGF?). Gastrointest Cancer Res. 2008;2:S20-S22. [PubMed] |
| 26. | Xu L, Jain RK. Down-regulation of placenta growth factor by promoter hypermethylation in human lung and colon carcinoma. Mol Cancer Res. 2007;5:873-880. [PubMed] [DOI] |
| 27. | Morabito A, De Maio E, Di Maio M, Normanno N, Perrone F. Tyrosine kinase inhibitors of vascular endothelial growth factor receptors in clinical trials: current status and future directions. Oncologist. 2006;11:753-764. [PubMed] [DOI] |