修回日期: 2009-06-01
接受日期: 2009-06-08
在线出版日期: 2009-06-28
目的: 探讨经介入途径中药白芨提取物作为基因递送载体的可行性.
方法: 从中药白芨中提取其有效成分-白芨多糖, 采用胺化还原法制备阳离子型白芨多糖, 体外实验检测该阳离子型多糖对质粒DNA的结合与保护作用, 以及阳离子白芨多糖载基因复合物对肝癌细胞系HepG2的转染, 进一步通过介入途径经肝动脉给予该复合物, 以GFP作为报告基因检测复合物在体内对活体兔肝细胞的转染.
结果: 所制备的阳离子型白芨多糖载基因复合物可以结合并保护质粒DNA免受DNA酶的降解; 体外实验证实该复合物可以转染入体外培养肝癌细胞, 以阳离子白芨多糖作为转染载体时转染效率要低于脂质体组, 差异具有统计学意义(28.87%±3.27% vs 36.64%±6.87%, P<0.05). 采用介入方法经肝动脉给药时复合物能靶向转染入活体兔肝细胞内并实现表达.
结论: 采用介入途径经肝动脉给药时阳离子白芨多糖载基因复合物可以实现活体肝细胞靶向转染, 有望作为一种新型的多聚阳离子型的基因载体在基因治疗中发挥作用.
引文著录: 夏向文, 李欣, 冯敢生, 郑传胜, 梁惠民, 柳曦, 熊斌. 介入途径下中药白芨提取物作为基因递送载体的可行性. 世界华人消化杂志 2009; 17(18): 1832-1835
Revised: June 1, 2009
Accepted: June 8, 2009
Published online: June 28, 2009
AIM: To research into the feasibility of a polysaccharide isolated from Bletilla striata as a gene vector administered through an interventional pathway.
METHODS: Bletilla striata polysaccharide (BSP) was isolated from a Chinese medicinal herb Bletilla striata, from which we prepared the cationic BSP (BSP+) by reductive amination. We further tested the ability of the BSP+ to incorporate and protect plasmid DNA, and the ability of the BSP+/pDNA complex to transfect into HepG2 cells. Then, we investigated the transfected effect of the BSP+/pDNA complex in vivo using green fluorescence protein (GFP) gene as a reporter gene administered through the hepatic artery.
RESULTS: The synthesized cationic Bletilla striata polysaccharide (BSP+) incorporated and protected plasmid DNA to avoid enzymolysis by DNase. The transfection ratio was lower in the liposome group than in BSP+ group (28.87% ± 3.27% vs 36.64% ± 6.87%, P < 0.05). The BSP+/pDNA complex was transfected into HepG2 cells in vitro and host cell in vivo.
CONCLUSION: The BSP+/pDNA complex could target transfect into liver cell in vivo when administered through the hepatic artery using the interventional method, which could produce a marked effect as a new-type polycation gene vector in gene therapy.
- Citation: Xia XW, Li X, Feng GS, Zheng CS, Liang HM, Liu X, Xiong B. Feasibility of a polysaccharide isolated from Bletilla striata used as a gene vector administered through an interventional pathway. Shijie Huaren Xiaohua Zazhi 2009; 17(18): 1832-1835
- URL: https://www.wjgnet.com/1009-3079/full/v17/i18/1832.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i18.1832
采用合适的递送载体及恰当的途径将基因安全高效地转入靶细胞内是基因治疗成败的关键[1-2]. 本课题组对我国传统中药白芨的系列研究证实白芨提取物可作为优良的基质材料和载体, 利用白芨提取物制备的白芨载药微球, 具有良好的缓释作用, 其悬浮性、分散性及生物相容性好[3-4]. 本研究在前期研究的基础上拟进一步发挥白芨多糖(Bletilla striata polysaccharide)的药物载体的作用, 开发一种新的适合于介入途径给药的基于白芨多糖的基因递送载体. 本文报道了可用于负载基因的阳离子型白芨多糖作为基因载体的可行性研究.
白芨茎块购于武汉市医药公司, 高碘酸钾、硼酸、硼砂、盐酸羟胺、溴酚蓝(天津科密欧公司, 分析纯), 精胺为Sigma公司产品. 增强型绿色荧光蛋白真核表达质粒pEGFP-C1由华中科技大学同济医院何文涛博士惠赠, 本实验室扩增. DMEM高糖培养基及胎牛血清购自Hyclone公司, 脂质体为Invitrogen公司产品; 肝癌细胞系HepG2由武汉协和医院普外科实验室保存. 余试剂均为国产分析纯. RE-5220型减压旋转蒸发仪(上海亚荣生化仪器厂), 85-1型恒温磁力搅拌器(上海国华仪器厂), 冷冻干燥机(美国Labconco公司). 荧光显微镜为日本Olympus公司产品, 冰冻切片机为德国Leico公司产品. 实验动物为新西兰大白兔, 华中科技大学同济医学院动物实验中心提供[批准文号: SCXK(鄂)2007-0006].
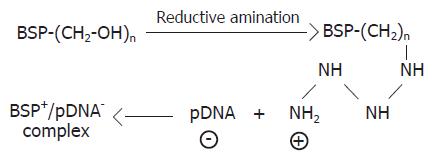
1.2.1 白芨多糖的分离、纯化及阳离子型白芨多糖的制备: 白芨多糖的分离纯化及阳离子型白芨多糖的制备按文献[5]方法进行. 白芨块茎干制品粉碎、过筛、烘干, 冷凝回流提取粗多糖, 经Sevag法脱蛋白后先后在阴离子交换纤维素DE-52柱和Sephadex G-100柱上层析, 收集多糖洗脱峰, 双蒸水透析后冷冻干燥得纯化白芨多糖. 进一步通过胺化还原法制备阳离子型白芨多糖并鉴定纯度.
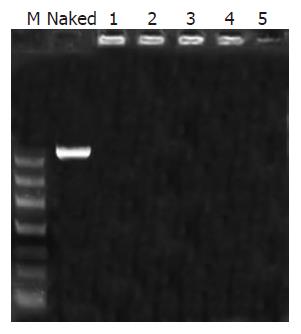
1.2.2 凝胶阻滞试验检测阳离子白芨多糖对基因的结合与保护作用: 将阳离子白芨多糖与绿色荧光蛋白真核表达质粒pEGFP-C1溶液以不同的比例混合, 使混合液的N/P比(即多糖中伯胺基与DNA的碱基之比)分别为1:1, 2:1, 4:1, 8:1, 16:1, 取裸质粒及不同N/P比的混合溶液各6 μL, 以含0.5 μg/L溴化乙啶的10 g/L琼脂糖进行电泳(100 V, 30 min), 于254 nm紫外灯下观察并拍照. 含阳离子型白芨多糖的复合物在电泳前分别加入130 kU/L DNaseⅠ 1 μL, 37 ℃反应15 min, 0 ℃冰浴中放置30 min中止反应, 以检测其对质粒DNA的保护作用.
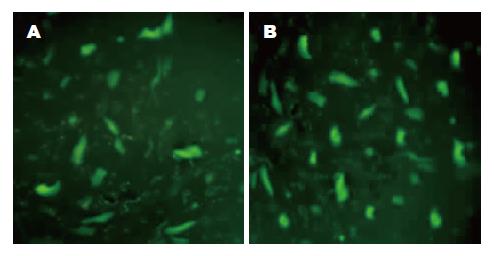
1.2.3 对体外培养肝癌细胞HepG2的转染: 以含100 mL/L FBS的DMEM高糖培养基常规培养人肝癌细胞HepG2, 每3 d传代1次. 转染前24 h以2.5×108/L接种到6孔板中, 待细胞生长到80%汇合度时, 按照脂质体操作说明书转染白芨多糖-质粒DNA复合物(使每孔中质粒pEGFP-C1的量为4 μg), 转染后48 h荧光显微镜下观察绿色荧光蛋白表达情况, 同时以脂质体作为阳性对照.
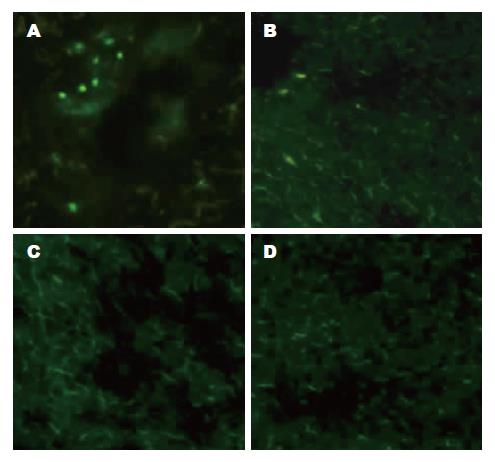
1.2.4 采用介入方法经肝动脉给药观察复合物对活体兔肝细胞的转染: 选取体质量约2.5 kg的新西兰大白兔, 雌雄不限, 常规消毒铺巾, 剑突下沿腹白线剪开约8 cm左右切口, 暴露肝门部结构, 以动脉夹暂时夹闭肝右动脉血流, 用自制30G穿刺针穿刺肝固有动脉, 经穿刺针向肝左动脉内缓慢注入阳离子型白芨多糖载质粒pEGFP-C1混合物(质粒量为100 μg), 术毕抗生素生理盐水冲洗后关腹. 3 d后取肝左叶不同部位组织做冰冻切片, 荧光显微镜下检测报告基因GFP的表达, 同时以裸质粒pEGFP-C1作阴性对照.
白芨多糖为一种中性的葡配甘露聚糖, 其中葡萄糖与甘露糖分子之比为1:3-1:1.6, 平均相对分子质量约为99-103 kDa[6-7], 其结构中不含阳离子型基团, 本身并不适合作为基因载体, 本研究采用胺化还原法成功在其糖链上引入了阳离子型的伯胺基团, 赋予了其结合质粒DNA的能力, 其机制如图1所示.
凝胶电泳检测原理: 若载体与pDNA结合, 则形成的复合物可阻碍DNA的泳动. 未与阳离子白芨多糖混合的质粒DNA可正常泳动, 当N/P比为1, 2, 4, 8, 16时, 1-5泳道质粒DNA未被DNA酶降解而全部滞留于加样孔中, 且荧光亮度依次变暗, 至第5泳道加样孔中基本未见荧光, 这是因为随着N/P比的增加pDNA被完全包裹于纳米粒内部, 阻碍了溴化乙啶插入其碱基对中. 实验结果表明, 所制备的这种阳离子型白芨多糖可以结合并保护DNA免受DNA酶的降解(图2).
借助于阳离子型白芨多糖和脂质体均可将质粒pEGFP-C1转染入体外培养肝癌细胞HepG2中, 图3示体外培养肝癌细胞内均可见绿色荧光蛋白表达. 以阳离子白芨多糖作为转染载体时转染效率约为28.87%±3.27%, 要低于脂质体组的转染率36.64%±6.87%, 差异具有统计学意义(t检验, n = 6, P<0.05).
分别取不同部位的新鲜肝组织行冰冻切片, 荧光显微镜下观察绿色荧光蛋白的表达, 实验组于各处肝组织中均可见绿色荧光蛋白表达, 裸质粒对照组各处肝组织中均未见绿色荧光表达(图4).
基因治疗的目的是将遗传物质通过不同的方法导入宿主细胞, 赋予或增强宿主某种功能[8]. 载体技术是研究较多的一种方法, 理想的基因载体应可以保护遗传物质免受核酸酶的降解, 在体内外环境下能将DNA导入靶细胞并实现表达, 生物相容性好, 不具有免疫原性及毒性. 目前用于基因递送的载体包括病毒载体和非病毒载体, 病毒载体虽然具有较高的体内外转染效率, 但其免疫原性引发的安全性问题限制了其临床应用. 与病毒载体不同, 天然的或人工合成的聚合物载体并不整合入宿主染色体, 能够将DNA引入非分裂细胞, 不存在感染的风险, 并且比病毒载体要便宜得多, 这些特点使得他受到了越来越多学者的关注[9]. 其中基于多糖的聚合物基因载体因其生物相容性好, 降解产物无不良反应等优点而更受青睐[10].
研究[11]表明, 所有用于基因递送的聚合物载体都含有伯胺基、仲胺基、叔胺基或者是季胺基, 他们在生理条件下可以形成阳离子聚积体因而能和DNA结合. 本实验中分离纯化得到的白芨多糖不含有阳离子型的基团, 其本身并不适合作为基因载体. 我们通过化学方法在其糖链上修饰上了阳离子型的伯胺基团, 从琼脂糖凝胶电泳结果看, 所合成的阳离子型白芨多糖可以有效地结合并保护质粒DNA, 具备了作为基因转染载体的首要条件.
阳离子聚合物作为基因递送载体的最大优点是无毒、生物相容性好, 然而体内转染效率低这一不足之处限制了他们的广泛应用. 转染效率较低的一个重要原因是宿主吞噬系统的清除及缺乏靶向性, 近来有研究者通过对聚合物进行修饰改性的方法来增加其疏水性或引入配基从而提高其进入靶细胞的能力, 这方面的研究已取得了一定的成效[12-13]. 本课题组另辟蹊径, 充分利用我们在介入治疗的临床和基础研究中的优势, 采用肝动脉插管方法注射白芨多糖载基因复合物, 这一方法的优点是可以有效避免循环系统对复合物的清除, 在肝脏内形成一过性的高浓度, 从而达到初级靶向(组织靶向)的目的. 从实验结果看, 采用介入方法经肝动脉给药时阳离子型白芨多糖携载的报告基因(GFP)在肝组织中成功表达, 而裸质粒组未见绿色荧光, 这表明经肝动脉注射白芨多糖载基因复合物从而实现肝细胞靶向是可行的. 可以预期, 当用适当的功能基因替换报告基因时, 应可取得一定的基因治疗效果, 关于这方面的研究及进一步的分子靶向方面的研究正在进行中.
采用合适的递送载体及恰当的途径将基因安全高效地转入靶细胞内是基因治疗成败的关键. 本课题组对我国传统中药白芨的系列研究证实白芨提取物可作为优良的基质材料和载体, 利用白芨提取物制备的白芨载药微球, 具有良好的缓释作用, 其悬浮性、分散性及生物相容性好. 本研究在前期研究的基础上拟进一步发挥白芨多糖的药物载体的作用, 开发一种新的适合于介入途径给药的基于白芨多糖的基因递送载体.
程英升, 教授, 同济大学附属第十人民医院影像临床医学中心
目前用于基因递送的载体包括病毒载体和非病毒载体, 病毒载体虽然具有较高的体内外转染效率, 但其免疫原性引发的安全性问题限制了其临床应用.
研究表明, 所有用于基因递送的聚合物载体都含有伯胺基、仲胺基、叔胺基或者是季胺基, 他们在生理条件下可以形成阳离子聚积体因而能和DNA结合.
采用介入途径经肝动脉给药时阳离子白芨多糖载基因复合物可以实现活体肝细胞靶向转染, 有望作为一种新型的多聚阳离子型的基因载体在基因治疗中发挥作用.
本研究选题新颖, 设计合理, 结果可靠, 具有很好的参考价值.
编辑: 李军亮 电编: 何基才
| 1. | 陈 漉, 金 宁一, 李 霄, 刘 立明, 贾 鹏, 刘 妍, 高 鹏, 陆 蕴松, 迟 宝荣. 含Apoptin基因重组腺病毒的构建及鉴定. 世界华人消化杂志. 2008;16:3505-3509. [DOI] |
| 2. | Saleh M, Wiegmans A, Malone Q, Stylli SS, Kaye AH. Effect of in situ retroviral interleukin-4 transfer on established intracranial tumors. J Natl Cancer Inst. 1999;91:438-445. [PubMed] [DOI] |
| 6. | Wang C, Sun J, Luo Y, Xue W, Diao H, Dong L, Chen J, Zhang J. A polysaccharide isolated from the medicinal herb Bletilla striata induces endothelial cells proliferation and vascular endothelial growth factor expression in vitro. Biotechnol Lett. 2006;28:539-543. [PubMed] [DOI] |
| 9. | 李 剑平, 窦 科峰, 陈 勇, 鱼 军, 杨 雁灵, 赵 青川, 乔 庆, 毛 海泉. 半乳糖基化壳聚糖肝靶向性基因转导的体内实验. 世界华人消化杂志. 2005;13:845-851. [DOI] |
| 10. | Eliyahu H, Joseph A, Azzam T, Barenholz Y, Domb AJ. Dextran-spermine-based polyplexes--evaluation of transgene expression and of local and systemic toxicity in mice. Biomaterials. 2006;27:1636-1645. [PubMed] [DOI] |
| 11. | De Smedt SC, Demeester J, Hennink WE. Cationic polymer based gene delivery systems. Pharm Res. 2000;17:113-126. [PubMed] [DOI] |
| 12. | Kim YH, Gihm SH, Park CR, Lee KY, Kim TW, Kwon IC, Chung H, Jeong SY. Structural characteristics of size-controlled self-aggregates of deoxycholic acid-modified chitosan and their application as a DNA delivery carrier. Bioconjug Chem. 2001;12:932-938. [PubMed] [DOI] |
| 13. | Mao HQ, Roy K, Troung-Le VL, Janes KA, Lin KY, Wang Y, August JT, Leong KW. Chitosan-DNA nanoparticles as gene carriers: synthesis, characterization and transfection efficiency. J Control Release. 2001;70:399-421. [PubMed] [DOI] |