修回日期: 2009-05-28
接受日期: 2009-06-08
在线出版日期: 2009-06-28
目的: 建立仓鼠胰腺癌细胞株(pGHAM-1)移植性肝癌模型, 并研究其生物学特性.
方法: 将pGHAM-1培养后配成4×1010/L, 取0.5 mL接种于仓鼠皮下, 成瘤后, 接种于仓鼠肝脏. 分别于第20、30、40天用B超仪检测肝脏肿瘤大小. 于接种后第40天处死动物, 观察肿瘤的生长、转移及腹水量. 解剖取出肝脏, 用游标卡尺测量肿瘤大小, 切开肝脏直接观察肿瘤, 再进行HE染色的组织病理学检查, 免疫组织化学检测血管内皮细胞生长因子(VEGF)及肿瘤转移相关蛋白(nm23-H1)的表达.
结果: pGHAM-1种植性肝癌模型成功率达100%. B超仪检测仓鼠肝脏, 第20、30、40天肿瘤体积分别为84.1±21.9 mm3, 413.7±208.4 mm3, 2187.3±1882.8 mm3, 与10 d前者相比, 有非常显著性差异(P<0.01); 接种后第40天处死动物, 解剖观察肿瘤, 直接测量肿瘤体积为2948.0±2188 mm3, 其大小与第40天B超仪测量结果无显著性差异(P>0.05). 部分仓鼠可见血性腹水; 肝内未见肿瘤卫星结节; HE染色组织病理学检查为低分化胰腺癌; 免疫组织化学检测结果显示VEGF及nm23-H1蛋白低表达.
结论: pGHAM-1种植性肝癌模型建立方法简便, 易复制, 是理想的肝癌研究模型.
引文著录: 毛庭枝, 周巧灵, 梁荣感, 戴支凯, 罗伟生, 肖胜军, 徐庆. 仓鼠胰腺癌细胞株移植性肝癌模型的建立及其生物学特性. 世界华人消化杂志 2009; 17(18): 1827-1831
Revised: May 28, 2009
Accepted: June 8, 2009
Published online: June 28, 2009
AIM: To establish a liver cancer model with an implanted pancreatic cancer cell line pGHAM-l on hamster and to analyze its biologic characteristics.
METHODS: Cell suspension of the cultured pancreatic cancer cell line pGHAM-1 of hamster in 4 × 1010 cells/L was prepared and, each hamster was subcutaneously inoculated with 0.5 mL of the cell suspension. After the tumor was formed, hamster was then inoculated with the tumor cell. The size of the liver tumor was examined by B-ultrasound for each the hamster at the 20th, 30th, and 40th day after inoculation, respectively. At the 40th day after inoculation, the animals were sacrificed, and the growth of tumor, metastasis, ascites volume were observed, then the liver of the hamster was removed out and the tumor was measured with a venire caliper. The tumor was observed directly with dissection of the hamster liver. It was made that the histopathology examination of the slices was stained by HE and the immunohistochemical assay of vascular endothelial cell growth factor (VEGF) and tumor metastasis associated protein (nm23-H1).
RESULTS: Hamster liver cancer model induce by implanting pancreatic cancer cell pGHAM-1 was 100% successful. B-ultrasound examinations showed that the tumor volume was 84.1 ± 21.9 mm3, 413.7 ± 208.4 mm3, 2187.3 ± 1882.8 mm3 at the 20th, 30th, and 40th day after inoculation respectively. There were very significant differences (P < 0.01) when compared later tumor volume with ten days before. Tumor volume measured directly was 2948.0 ± 2188 mm3 when the animals were anatomized at the 40th day after inoculation, and there was no significant difference (P > 0.05) when compared it with that examined by B-ultrasound examinations at the 40th day. Bloody ascites was observed in some hamsters. The satellite nodules of the pancreatic cancer were not observed. The histopathological examination of the slices stained by HE indicated a poorly differentiated pancreatic cancer. The results of the immunohistochemistry assay showed a low expression of VEGF and nm23-H1 protein.
CONCLUSION: The method for creating a liver cancer model of hamster induced by implanting pGHAM-1 pancreatic cancer cell is simple, easy to replication, and is an ideal model for liver cancer study.
- Citation: Mao TZ, Zhou QL, Liang RG, Dai ZK, Luo WS, Xiao SJ, Xu Q. Establishment of an implanted liver tumor model of hamster with the pancreatic cancer cell line pGHAM-l of hamster and its biologic characteristics. Shijie Huaren Xiaohua Zazhi 2009; 17(18): 1827-1831
- URL: https://www.wjgnet.com/1009-3079/full/v17/i18/1827.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i18.1827
肝癌是发病率较高的恶性肿瘤之一, 有关肝癌的研究也是许多研究人员关注的课题. 理想的肝癌动物模型是抗肝癌药物开发、肝癌发生发展机制研究、肝癌介入治疗及诊断研究的必备工具. 现有的鼠移植性肝癌动物模型包括裸鼠人肝癌组织移植模型[1]、大鼠walker-256肝癌模型[2]、小鼠移植性肝癌模型[3]等. 目前尚未见到仓鼠移植性肝癌模型的报道, 我们建立了仓鼠胰腺癌细胞株(pGHAM-1)移植性肝癌模型, 现将结果报道如下.
SPF级叙利亚仓鼠(Syrian Hamster) ♂12只, 3 wk, 纯近交系, 体质量60-80 g, 由上海斯莱克实验动物有限公司提供(合格证号: 2003-0003); 仓鼠胰腺癌细胞株(pGHAM-1)由西安交通大学第一附属医院提供; DMEM培养液, 胎牛血清为美国Gibco公司产品; 青霉素、链霉素为Sigma公司产品; 抗大鼠血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)多克隆抗体(即用型), 批号: 090100, 抗大鼠nm23-H1多克隆抗体(即用型), 批号: 090100, 均为武汉博士德生物技术有限公司产品; 二抗为快捷型酶标羊抗鼠/兔IgG聚合物, 批号: 807283335020, 福州迈新生物技术有限公司产品; 凝血酶, 批号: 105035, 上海太阳生物有限公司产品; MEDISON SA-8000CSE B型超声诊断仪, 中国上海麦迪逊医疗器械有限公司; KD-TS I生物组织自动脱水机, KD-BM Ⅱ电脑生物组织包埋机, 浙江省金华市科迪仪器设备有限公司; Shandon Finesse® 325石蜡切片机, 英国Shandon(珊顿)公司.
1.2.1 仓鼠胰腺癌细胞株(pGHAM-1)移植性肝癌模型制作: 将仓鼠胰腺癌细胞株(pGHAM-1)培养后配成4×1010/L, 取0.5 mL接种于仓鼠皮下4 wk后成瘤; 分离、取出鱼肉状瘤组织, 切成1.0 mm3大小备用; 仓鼠适应性饲养3 d, 10 g/L戊巴比妥钠100 mg/kg腹腔注射麻醉, 腹部祛毛、消毒, 在剑突下沿腹正中线做1.5 cm切口; 用手指挤压仓鼠腹腔, 挤出一叶肝脏, 用手术刀片于肝脏接种部位以30度做一切斜口: 0.5 cm(宽)×0.5 cm(深); 消毒棉签蘸10 g/L凝血酶止血; 用镊子将1.0 mm3大小的瘤组织植入切口, 消毒棉签轻压切口止血固定, 常规缝合关腹. 全程均为无菌操作.
1.2.2 B超仪检测与大体解剖观察: 分别于接种手术后第20、30、40天, 将仓鼠以10 g/L戊巴比妥钠100 mg/kg经腹腔注射麻醉后, 用B型超声诊断仪(简称: B超仪, HL5-9ED探头, 7 MHz检测频率)检测肝脏肿瘤生长情况[4]; 于接种后第40天处死动物, 解剖取出肝脏, 用游标卡尺测量肿瘤大小. 根据公式V = ab2/2计算肿瘤体积[V = 肿瘤体积, a = 瘤体最长径, b = 瘤体最短径][3]. 肉眼观察肿瘤的转移与腹水产生情况.
1.2.3 病理学观察: 将处死动物解剖取出肝脏, 取材用100 g/L中性甲醛固定, 病理解剖检查肿瘤外观及内部切面; 用石蜡包埋切片, HE染色, 进行组织病理学观察.
1.2.4 VEGF及肿瘤转移相关蛋白nm23-H1的免疫组织化学检测: 免疫组化测定采用迈新Maxvision快捷型检测法. 切片常规脱蜡、水化, 高温柠檬酸盐修复, 去除内源性过氧化物酶, 以山羊血清封闭10 min, 加入稀释的一抗, 4 ℃过夜; 依次滴加快捷型酶标羊抗鼠/兔IgG聚合物, DAB显色、苏木精轻度复染, 脱水、透明、封片; 在高倍镜(×400)下计数阳性细胞数目及染色强度比较. 蛋白表达阳性判断标准参照文献进行[5].
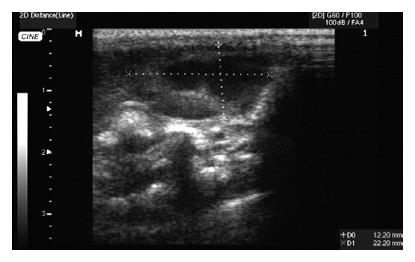
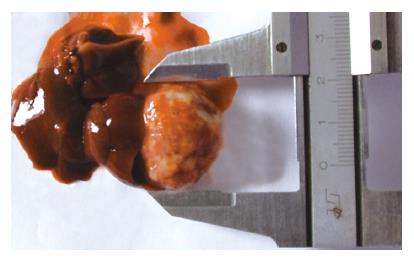
B超检查: 12只荷瘤仓鼠肝内均为1个肝肿瘤病灶. 病灶表现为实质性低回声, 与正常肝实质边界清楚, 形态不规则, 回声不均匀, 光点增粗. 病灶区随时间推移明显增大. 接种后第20、30、40天, B超检测肝脏肿瘤体积分别为84.1±21.9 mm3, 413.7±208.4 mm3, 2187.3±1882.8 mm3. 测量所得肿瘤体积, 后者与10 d前相比, 有非常显著性差异(P<0.01). 第30天, 有2只荷瘤仓鼠的肿瘤内出现小液化灶, 第40天有3只荷瘤仓鼠的肿瘤内出现液化灶且面积增大(图1). 大体解剖观察发现: B超检查显示肿瘤内出现液化灶的3只荷瘤仓鼠伴有血性腹水; 直接测量肿瘤(图2)体积为2948.0±2188 mm3, 其大小与第40天B超测量结果无显著性差异(P>0.05).
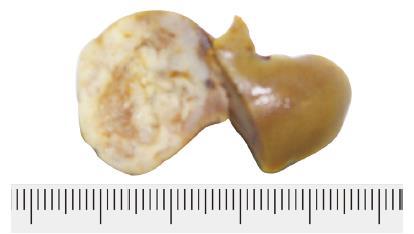
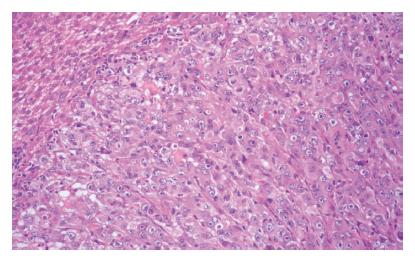
病理解剖检查: 肿瘤外观呈扁卵圆形或近似圆形, 境界清楚; 切开肿瘤, 3只仓鼠肝肿瘤中可见液化坏死灶, 肿瘤周围肝组织未见卫星结节(图3). HE染色的组织切片镜下所见: 为低分化胰腺癌, 肿瘤组织呈条索状或小梁状排列, 肿瘤组织与正常组织交界处有少量淋巴细胞浸润, 肿瘤组织中血管生成罕见(图4).
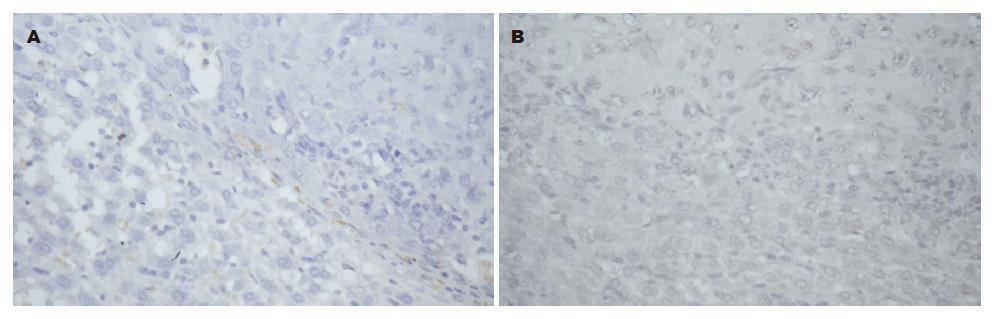
免疫组织化学检测VEGF和nm23, 肿瘤及瘤旁组织均呈阴性表达(图5).
仓鼠(叙利亚金色仓鼠)在形态学、生物学以及免疫学等方面与人有相似之处[6,7], 可用于制作人类心血管疾病[8]、病毒感染[9]、原虫感染[10]、肿瘤[11]等多种疾病的整体动物模型. 金色仓鼠对移植瘤接受性强, 对可以诱发肿瘤的病毒很易感也很敏感, 还可以成功移植某些同源正常组织细胞或肿瘤组织细胞等[12]. 国内学者白纪刚 et al[7]应用仓鼠pGHAM-1细胞株建立了仓鼠移植性胰腺癌模型, 我们在此基础上建立仓鼠移植性肝癌模型, 并研究了该模型的生长规律与VEGF、肿瘤转移相关蛋白表达等生物学特性. 通过B超仪定期检测所得数据分析, 可见肿瘤从第20天开始, 每10 d分别以4.9和5.3倍的速度生长. B超检查还发现, 在第30天只有2只荷瘤仓鼠的肿瘤内出现较小液化灶, 而到第40天有3只荷瘤仓鼠的肿瘤内出现液化灶且面积增大. 高爱社 et al[13]对VEGF在肝癌中的表达进行了研究, 发现其在转移组中的表达明显高于未转移组, 在癌组织中的表达明显高于正常肝组织, 从而证实VEGF在肝癌生长和转移复发中起着重要作用. 鲁林源 et al[14]的研究, 发现VEGF的表达与胰腺癌生长浸润有关. 本实验的VEGF免疫组织化学结果呈阴性表达, 提示该肝癌模型肿瘤转移性可能较小. nm23-H1的免疫组织化学结果呈阴性表达, 可能是因为nm23-H1基因并非在所有肿瘤中都发挥转移抑制作用[15]. 陈峰 et al[16]在研究胰腺癌nm23-H1的实验发现nm23-H1基因蛋白的阳性表达与淋巴结转移及浆膜受侵具有明显相关性(P<0.05). 潘小季 et al[17]的研究结果, 表明nm23-H1的表达与胰腺癌的分化程度有关, 分化愈好, 阳性率愈低. 李淑德 et al[18]究结果显示, 胰腺癌组织nm23-H1蛋白表达与肿瘤组织学分级及淋巴结或肝脏转移呈正相关, 即肿瘤分化程度越差, nm23-H1蛋白表达越强; 伴淋巴结或肝脏转移的胰腺癌, 其nm23-H1蛋白表达较不伴转移者为强, 他们认为nm23-H1基因在胰腺癌可能不显示肿瘤转移抑制基因功能. 建立该模型成功的关键与下列几个因素有关: (1)动物的选择. 根据我们预实验结果提示, 应选择3-4 wk, 体质量60-80 g的仓鼠. 动物太小, 不利于手术操作; 动物太大, 由于免疫功能与排异反应较强, 成瘤率偏低. (2)瘤源组织的选择. 胰腺癌细胞株(pGHAM1)培养后用不含血清的培养基配成4×1010/L, 取0.5 mL接种于仓鼠皮下4 wk成瘤; 无菌操作, 分离、取出鱼肉状瘤组织, 避免选择坏死组织. 在鱼肉状瘤组织中, 肿瘤干细胞较多易成瘤[19]. 该模型原位成瘤率高, 简便, 为肝癌的治疗研究提供了一个新的平台.
理想的肝癌动物模型是抗肝癌药物开发、肝癌发生发展机制研究、肝癌介入治疗及诊断研究的必备工具. 现已有裸鼠人肝癌组织移植模型、大鼠walker-256肝癌模型、小鼠移植性肝癌模型等, 但尚未见到仓鼠移植性肝癌模型的报道.
高润平, 教授, 吉林大学第一医院肝病科
2005年, 有学者利用胰腺癌细胞株(pGHAM-1)在仓鼠胰腺成功地建立了仓鼠胰腺癌原位模型, 但不是移植性肝癌模型.
本研究首次采用仓鼠胰腺癌细胞株(pGHAM-1)接种于仓鼠皮下, 成瘤后将其部分接种于同种异体仓鼠幼鼠的肝脏形成移植性肝肿瘤模型.
建立仓鼠胰腺癌细胞株移植性肝癌模型成功的关键是: (1)动物的选择. 应选择3-4 wk, 体质量60-80 g的仓鼠. (2)瘤源组织的选择. 选择鱼肉状瘤组织, 其肿瘤干细胞较多易成瘤, 应避免坏死组织.
nm23蛋白: 由nm23基因控制产生的蛋白. 1988 年美国Steeg应用差别筛选技术首先分离鉴定了nm23基因并证明与肿瘤的转移抑制相关. 目前临床研究最多的是nm23H1基因和nm23H2基因.
本研究设计合理, 实验结果可靠, 对转移性肝癌的发生学和诊断学研究及抗癌药物研制具有实际意义.
编辑: 李军亮 电编: 吴鹏朕
| 6. | van der Weyden L, Bradley A. Mouse chromosome engineering for modeling human disease. Annu Rev Genomics Hum Genet. 2006;7:247-276. [PubMed] [DOI] |
| 8. | Escobales N, Crespo MJ. Early pathophysiological alterations in experimental cardiomyopathy: the Syrian cardiomyopathic hamster. P R Health Sci J. 2008;27:307-314. [PubMed] |
| 9. | Schaecher SR, Stabenow J, Oberle C, Schriewer J, Buller RM, Sagartz JE, Pekosz A. An immunosuppressed Syrian golden hamster model for SARS-CoV infection. Virology. 2008;380:312-321. [PubMed] [DOI] |
| 10. | Dolabella SS, Coelho PM, Borçari IT, Mello NA, Andrade Zde A, Silva EF. Morbidity due to Schistosoma mansoni--Entamoeba histolytica coinfection in hamsters (Mesocricetus auratus). Rev Soc Bras Med Trop. 2007;40:170-174. [PubMed] [DOI] |