修回日期: 2009-05-05
接受日期: 2009-05-11
在线出版日期: 2009-06-18
目的: 探讨Wnt信号通路的靶基因GS mRNA及蛋白在胃癌中的表达及其临床意义.
方法: 荧光实时定量PCR(FQ-PCR)检测52例胃癌组织及癌旁正常组织GS mRNA表达; 免疫组织化学技术(SP法)检测97例胃癌组织、30例癌旁正常组织及10例肠化生组织中GS蛋白表达水平差异.
结果: 癌组织和癌旁正常组织GS mRNA表达有显著差异(25.508±5.090 vs 13.001±2.040, P<0.05). 癌组织GS蛋白表达与组织学类型、Lauren分型及淋巴结转移密切相关(χ2 = 26.994, 54.929, 5.173, 均P<0.05), 与肿瘤大小、TNM分期、远处转移及患者的性别和年龄等无明显相关.
结论: GS mRNA和蛋白高表达同胃癌生物学行为密切相关, 可能与胃癌的发生、发展及预后有关.
引文著录: 彭春伟, 燕敏, 于颖彦, 李建芳, 计骏, 蔡劬, 刘炳亚, 朱正纲. Wnt信号通路靶基因GS mRNA及蛋白在胃癌中的表达. 世界华人消化杂志 2009; 17(17): 1777-1781
Revised: May 5, 2009
Accepted: May 11, 2009
Published online: June 18, 2009
AIM: To investigate the new target of Wnt signaling pathway GS mRNA and protein expression in cancerous tissue from patients with gastric carcinoma and to evaluate its clinic significance.
METHODS: Fluorescent quantitative PCR (FQ-PCR) was used to detect the GS mRNA expression in cancerous tissue and paracancerous normal mucosa from 52 patients with gastric carcinoma. Immunohistochemistry (SP method) was used to detect GS expressions in paraffin-embedded gastric carcinoma tissues of 97 cases, paracancerous normal mucosa of 30 cases and 10 intestinal metaplasia tissues.
RESULTS: The expression of GS mRNA was significantly higher in cancerous tissue from patients with gastric carcinoma than in normal tissue (25.508 ± 5.090 vs 13.001 ± 2.040, P < 0.05). GS protein expression was closely related to the pathologic parameters, such as histological type, Lauren classification and distant metastasis (χ2 = 26.994, 54.929, 5.173, all P < 0.05). However, there was no significant correlation between GS expression and lymph node metastasis, tumor size, TNM staging, age and gender of patients.
CONCLUSION: GS mRNA and protein expression is significantly correlated with the biological behavior of gastric carcinoma. The high expression of GS may be related with the occurrence and progress of gastric cancer.
- Citation: Peng CW, Yan M, Yu YY, Li JF, Ji J, Cai Q, Liu BY, Zhu ZG. Expression of the new target GS mRNA and protein of Wnt signaling pathway in gastric cancerous tissue. Shijie Huaren Xiaohua Zazhi 2009; 17(17): 1777-1781
- URL: https://www.wjgnet.com/1009-3079/full/v17/i17/1777.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i17.1777
Wnt信号途径由Wnt蛋白及其受体、调节蛋白等一起组成了复杂的信号通路, 调节细胞的分化、增殖等许多重要过程. 近年来研究表明, Wnt信号转导途径不恰当地激活参与多种人类癌症的发病[1]. GS基因作为新近发现Wnt信号的靶基因[2], 在癌症中研究较少, 尤其在胃癌中, 国内外未见报道. 因此, 我们应用实时荧光定量PCR法及免疫组织化学技术检测胃癌患者癌组织GS mRNA及其蛋白的表达, 并分析其与临床病理因素之间的关系.
收集我院普外科2007-09/2008-11行胃癌根治术或姑息性切除术的97例胃癌原发病灶. 胃癌和癌旁正常组织均在手术切除后迅速取材, 置于液氮中, -80 ℃保存. 患者中男64例, 女33例, 年龄20-87(中位61)岁. 所有标本均经过病理证实. 全部病例均为首发, 术前均未接受放化疗. 其中52例胃癌组织及癌旁正常组织用于抽提GS mRNA抽提并逆转做定量PCR; 取收集的97例胃癌及30例癌旁正常组织及本实验室前期收集储存的10例肠化生的组织用于做免疫组织化学; 总RNA抽提试剂盒和M.MuLV逆转录酶购自Promega公司. 逆转录实时荧光定量PCR试剂购自Roche公司. 鼠抗人GS mAb(BD Transduction Laboratories, 美国), SP试剂盒(福州迈新公司), DAB显色液(DAKO公司)及PBS(上海博光科技有限公司).
1.2.1 引物设计与合成: 引物和探针在GenBank查到基因序列, 使用软件Primer.ExPress 2.0进行设计. GS基因上游引物: 5'-GCTGGTGTTATGTGAAGTTTTCAAG-3', 下游引物: 5'-CCGTTTACAGGTGTGCCTCAA-3', 扩增片段长73 bp; GAPDH上游引5'-GAAGATGGTGATGGGATTT-3',下游引物为5'-CAAGCTTCCCGTTCTCAGCC-3', 扩增片段长226 bp. 上述引物均由上海生工工程技术服务有限公司合成.
1.2.2 RNA抽提及cDNA合成: 52例胃癌及癌旁正常组织使用TRIzol RNA提取液, 按照其说明书对胃癌组织和癌旁正常组织提取总RNA, 通过甲醛变性凝胶电泳定性和紫外分光光度仪定量. 取总RNA 1 μg进行逆转录, 按照说明书进行cDNA合成, 所得cDNA置于-20 ℃保存. GAPDH和GS mRNA的PCR反应: 反应体系为20 μL, 5×PCR Buffer 4 μL, 25 mmol/L MgCl2 1.2 μL, 10 mmol/L dNTP 0.4 μL, 10 nmol/L Primer上下游各0.5 μL, 5 μL/L Taq 0.1 μL, cDNA 1 μL, 无菌双蒸水12.3 μL, 反应条件: 95 ℃变性5 min, 95 ℃ 40 s, 58 ℃ 40 s, 72 ℃ 30 s, 共35个循环, 循环结束后72 ℃延伸10 min, 每个标准品和标本均作复管PCR反应.
1.2.3 PCR产物定量的校正和判定分析: 采用GAPDH内参照. GS mRNA和GAPDH mRNA根据标准曲线得出mRNA的分子拷贝数. 用GAPDH的拷贝数作为校正基数, 即目的基因mRNA确含量 = 目的基因CT值/内参照GAPDH CT值, 以此比值作统计处理. 根据FQ-PCR原理, 被激发的荧光信号达到一定阈值后被荧光探头采集, 最后将其转换成CT值, 该数值与扩增片段的实际拷贝数呈反比, 即CT值越低, 实际拷贝数含量越高.
1.2.4 免疫组织化学染色: 97例胃癌组织、30例癌旁正常组织及10例肠化生组织标本经100 g/L的中性甲醛固定, 经石蜡包埋的肿瘤组织切至4 μm厚切片, 经二甲苯和梯度乙醇脱蜡至水, 然后在室温中30 mL/L过氧化氢甲醇溶液中浸泡30 min, 以抑制内源性过氧化物酶活性. 切片在EDTA(0.01 mol/L, pH 8.0)中煮20 min以修复抗原. PBS漂洗3次后, 切片用正常山羊血清孵育10 min以阻断非特异性反应. 一抗GS mAb(1:500), 在湿盒中4 ℃过夜, PBS漂洗3次, 滴加二抗试剂, 室温下孵育10 min后PBS漂洗3次, 滴加链霉素抗生物素-过氧化物酶溶液, 室温下孵育10 min后再PBS漂洗3次, 最后DAB显色, 苏木素复染、透明、脱水、封片. 以PBS替代一抗行阴性对照.
1.2.5 免疫组织化学染色结果判定: 二级计分法, 首先按染色强度评分: 无色为0分, 淡黄色为1分, 棕黄色为2分, 棕褐色为3分; 然后按阳性细胞率评分: 肿瘤细胞内无阳性染色者为0分, 阳性细胞率<10%为0分, 10%-25%为1分, >25%-50%为2分, >50%-75%为2分, >75%为4分. 将二者相加得综合免疫组化评分: ≤3分为阴性(-), >3阳性(+)[3].
统计学处理 应用SPSS11.0软件进行数据处理. 计量资料用mean±SD表示, 采用配对t检验. 采用χ2检验分析GS蛋白表达水平与临床病理因素间的关系. P<0.05表示有统计学意义.
胃癌癌旁正常组织和胃癌组织均表达GS mRNA, 其表达水平分别为13.001±2.040和25.508±5.090, 胃癌组织GS mRNA表达明显高于癌旁正常组织(P<0.05).
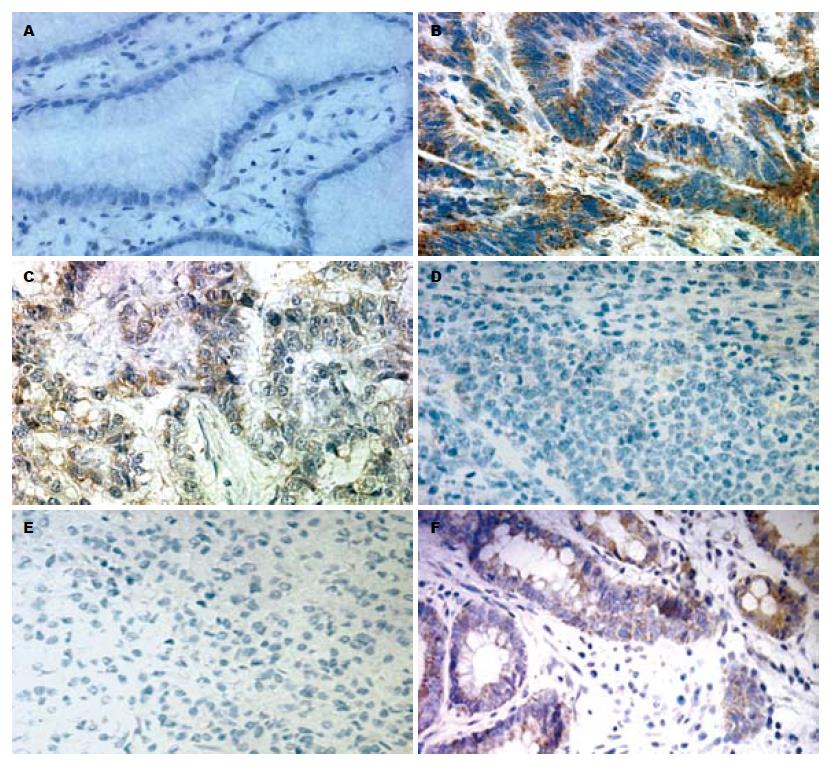
GS蛋白在高中分化胃癌及肠化生组织中呈阳性或强阳性, 而在低分化、未分化胃癌及正常胃黏膜组织呈阴性或弱阳性(图1).
97例胃癌中GS蛋白呈阳性表达69例, 阳性率为71.1%, GS蛋白表达与年龄、性别、肿瘤大小、TNM分期及远处转移均无明显相关(表1). 而与组织学类型、Lauren分型及淋巴结转移密切相关(P<0.05).
| 临床病理特征 | n | + | - | χ2 | P |
| 年龄(岁) | |||||
| <55 | 27 | 18 | 9 | 0.364 | >0.05 |
| ≥55 | 70 | 51 | 19 | ||
| 性别 | |||||
| 男 | 64 | 47 | 17 | 0.486 | >0.05 |
| 女 | 33 | 22 | 11 | ||
| 肿瘤大小(cm) | |||||
| ≤5 | 44 | 28 | 16 | 2.205 | >0.05 |
| ≥5 | 53 | 41 | 12 | ||
| 分化程度 | |||||
| 高分化 | 9 | 9 | 0 | 26.994 | <0.05 |
| 中分化 | 38 | 36 | 2 | ||
| 低分化 | 50 | 24 | 26 | ||
| Lauren分型 | |||||
| 肠型 | 56 | 53 | 3 | 54.929 | <0.05 |
| 弥漫型 | 28 | 5 | 23 | ||
| 混合型 | 13 | 11 | 2 | ||
| 淋巴结转移 | |||||
| 无 | 15 | 7 | 8 | 5.173 | <0.05 |
| 有 | 82 | 62 | 20 | ||
| TNM分期 | |||||
| Ⅰ+Ⅱ | 35 | 28 | 7 | 2.096 | >0.05 |
| Ⅲ+Ⅳ | 62 | 41 | 21 | ||
| 远处转移 | |||||
| 无 | 91 | 64 | 27 | 0.416 | >0.05 |
| 有 | 6 | 5 | 1 |
Wnt信号途径由Wnt蛋白及其受体、调节蛋白等一起组成了复杂的信号通路, 调节细胞的分化、增殖、迁移以及哺乳动物生殖系统发育的多个重要过程[4]. 近年来发现很多肿瘤发生与Wnt信号异常相关. 在胃癌的发生发展中也不乏Wnt信号通路异常的报道[4-6]. GS即谷氨酰胺合成酶, 近年来许多研究发现其为Wnt信号通路的靶基因[2,7]. 其催化谷氨酸与氨生成谷氨酰胺并在调节氮的代谢、维持pH稳态已经细胞信号转导中发挥重要的作用. 除此之外, 研究发现GS参与细胞增殖以及大脑的发育中都起着重要的作用[8-9]. 同时研究报道人原发性肝癌中发现GS过度表达, 其表达增高可能会增加肝细胞癌的转移潜力, 并且可以作为预测肝细胞癌复发的重要的指标[10-11]. 而到目前为止, 国内外尚无GS表达与胃癌临床病理因素关系的报道.
本研究应用方法检测荧光实时定量PCR (FQ-PCR)检测52例胃癌组织及癌旁正常组织GS mRNA表达, 结果显示胃癌组织GS mRNA表达水平明显高于癌旁正常组织. 免疫组织化学技术检测97例胃癌组织及30例正常组织及10例肠化生组织中GS蛋白表达, 结果显示胃癌组织中GS蛋白表达水平总体高于正常组织, 与胃癌的组织学类型、Lauren分型及淋巴结转移明显相关, 而与年龄、性别、肿瘤大小、TNM分期及远处转移无明显相关. 胃癌组织中GS高表达, 推测其高表达, 有利于谷氨酰胺合成, 为合成核苷酸提高原料. 而肿瘤细胞增殖旺盛, 需要大量的原料来合成核苷酸, GS高表达可以为肿瘤细胞提供大量核苷酸合成原料, 有利于肿瘤细胞克服不利的环境而不断增殖. 此外, GS高表达也可能会增加胃癌的转移潜力, 但此推断需要进一步加以验证.
试验中同时发现, GS在肠型胃癌中呈高表达, 而在弥漫型胃癌中呈低表达或者不表达. 我们分析原因可能为, 研究报道GS染色阳性可以作为Wnt信号通路中关键点β-catenin突变的标记[12-14], β-catenin突变后不被降解从激活Wnt信号通路的靶基因, 结合研究报道中发现β-catenin在肠型胃癌中突变多见, 而弥漫型罕见[15], 从而可能会出现在肠型胃癌中表达增高, 而弥漫型不表达或者低表达, 但此推测还待以验证, 以及Wnt信号通路中其他分子是否对GS表达有影响,这都是我们下一步研究的重点.
Wnt信号途径由Wnt蛋白及其受体、调节蛋白等一起组成了复杂的信号通路, 调节细胞的分化、增殖等许多重要过程. 近年来研究表明, Wnt信号转导途径不恰当地激活参与多种人类癌症的发病. GS基因作为新近发现Wnt信号的靶基因, 在癌症中研究较少, 尤其在胃癌中, 国内外未见报道.
郑鹏远, 教授, 郑州大学第二附属医院消化科
GS基因作为新近发现的Wnt信号通路的靶基因, 有文献报道GS基因及蛋白过表达有利于肝癌的转移及复发, 而胃癌中尚无报道.
GS即谷氨酰胺合成酶, 近年来许多研究发现其为Wnt信号通路的靶基因. 其催化谷氨酸与氨生成谷氨酰胺并在调节氮的代谢、维持pH稳态已经细胞信号转导中发挥重要的作用. 除此之外, 研究发现GS参与细胞增殖以及大脑的发育中都起着重要的作用.
同时研究报道人原发性肝癌中发现GS过度表达, 其表达增高可能会增加肝细胞癌的转移潜力, 并且可以作为预测肝细胞癌复发的重要的指标.
本研究选题新颖, 论据充分, 具有一定的理论意义.
编辑: 李军亮 电编: 何基才
| 1. | Clevers H. Wnt/beta-catenin signaling in development and disease. Cell. 2006;127:469-480. [PubMed] [DOI] |
| 2. | Cadoret A, Ovejero C, Terris B, Souil E, Lévy L, Lamers WH, Kitajewski J, Kahn A, Perret C. New targets of beta-catenin signaling in the liver are involved in the glutamine metabolism. Oncogene. 2002;21:8293-8301. [PubMed] [DOI] |
| 3. | Jiang Y, Wang L, Gong W, Wei D, Le X, Yao J, Ajani J, Abbruzzese JL, Huang S, Xie K. A high expression level of insulin-like growth factor I receptor is associated with increased expression of transcription factor Sp1 and regional lymph node metastasis of human gastric cancer. Clin Exp Metastasis. 2004;21:755-764. [PubMed] [DOI] |
| 4. | Yu J, Tao Q, Cheng YY, Lee KY, Ng SS, Cheung KF, Tian L, Rha SY, Neumann U, Röcken C. Promoter methylation of the Wnt/beta-catenin signaling antagonist Dkk-3 is associated with poor survival in gastric cancer. Cancer. 2009;115:49-60. [PubMed] [DOI] |
| 5. | Pan KF, Liu WG, Zhang L, You WC, Lu YY. Mutations in components of the Wnt signaling pathway in gastric cancer. World J Gastroenterol. 2008;14:1570-1574. [PubMed] [DOI] |
| 6. | Zhang H, Xue Y. Wnt pathway is involved in advanced gastric carcinoma. Hepatogastroenterology. 2008;55:1126-1130. [PubMed] |
| 7. | Olkku A, Mahonen A. Wnt and steroid pathways control glutamate signalling by regulating glutamine synthetase activity in osteoblastic cells. Bone. 2008;43:483-493. [PubMed] [DOI] |
| 8. | Vermeulen T, Görg B, Vogl T, Wolf M, Varga G, Toutain A, Paul R, Schliess F, Häussinger D, Häberle J. Glutamine synthetase is essential for proliferation of fetal skin fibroblasts. Arch Biochem Biophys. 2008;478:96-102. [PubMed] [DOI] |
| 9. | Häberle J, Görg B, Rutsch F, Schmidt E, Toutain A, Benoist JF, Gelot A, Suc AL, Höhne W, Schliess F. Congenital glutamine deficiency with glutamine synthetase mutations. N Engl J Med. 2005;353:1926-1933. [PubMed] [DOI] |
| 10. | Christa L, Simon MT, Flinois JP, Gebhardt R, Brechot C, Lasserre C. Overexpression of glutamine synthetase in human primary liver cancer. Gastroenterology. 1994;106:1312-1320. [PubMed] |
| 11. | Osada T, Nagashima I, Tsuno NH, Kitayama J, Nagawa H. Prognostic significance of glutamine synthetase expression in unifocal advanced hepatocellular carcinoma. J Hepatol. 2000;33:247-253. [PubMed] [DOI] |
| 12. | Audard V, Cavard C, Richa H, Infante M, Couvelard A, Sauvanet A, Terris B, Paye F, Flejou JF. Impaired E-cadherin expression and glutamine synthetase overexpression in solid pseudopapillary neoplasm of the pancreas. Pancreas. 2008;36:80-83. [PubMed] [DOI] |
| 13. | Audard V, Grimber G, Elie C, Radenen B, Audebourg A, Letourneur F, Soubrane O, Vacher-Lavenu MC, Perret C, Cavard C. Cholestasis is a marker for hepatocellular carcinomas displaying beta-catenin mutations. J Pathol. 2007;212:345-352. [PubMed] [DOI] |
| 14. | Zucman-Rossi J, Jeannot E, Nhieu JT, Scoazec JY, Guettier C, Rebouissou S, Bacq Y, Leteurtre E, Paradis V, Michalak S. Genotype-phenotype correlation in hepatocellular adenoma: new classification and relationship with HCC. Hepatology. 2006;43:515-524. [PubMed] [DOI] |
| 15. | Park WS, Oh RR, Park JY, Lee SH, Shin MS, Kim YS, Kim SY, Lee HK, Kim PJ, Oh ST. Frequent somatic mutations of the beta-catenin gene in intestinal-type gastric cancer. Cancer Res. 1999;59:4257-4260. [PubMed] |