修回日期: 2009-03-30
接受日期: 2009-04-08
在线出版日期: 2009-06-18
目的: 观察结肠癌前病变序列的增殖凋亡演变过程及其与PPAR-γ、β-catenin异常表达的关系.
方法: 选用SPF级SD大鼠, 经改良的DMH结肠肿瘤诱导方法诱导结肠ACF和腺瘤, 然后对"正常-ACF-腺瘤"序列各阶段的组织进行免疫组织化学分析其PPAR-γ和β-catenin的表达, 同时选择Ki-67表示增殖水平, Bcl-2表示凋亡水平.
结果: 在DMH诱导的"正常-ACF-腺瘤"序列中, Ki-67在"正常-ACF"转变阶段即出现异常高表达, 呈整个隐窝广泛分布, 显著高于正常隐窝, 而接近腺瘤组织. Bcl-2则在"ACF-腺瘤"转变阶段才出现异常高表达, 呈广泛的胞质阳性颗粒. PPAR-γ在"正常-ACF"转化阶段发生广泛的高表达, 呈广泛的核阳性. β-catenin则是在"ACF-腺瘤"转化阶段出现异常表达, 呈广泛的核阳性.
结论: 在"正常-ACF"转化阶段主要是增殖水平的升高, 而且可能与PPAR-γ的异常表达有关. 在"ACF-腺瘤"转化阶段主要是凋亡抑制增加, β-catenin与Bcl-2同期出现异常表达对腺瘤的形成可能有一定的协同作用.
引文著录: 张耀朋, 吕愈敏, 李军, 韩亚京, 李传凤. ACF在结肠癌早期病变中的变化及其与PPAR-γ和β-catenin的关系. 世界华人消化杂志 2009; 17(17): 1732-1737
Revised: March 30, 2009
Accepted: April 8, 2009
Published online: June 18, 2009
AIM: To observe the progression of proliferation and apoptosis of colorectal preneoplastic sequence, and to explore the potential role of abnormal expression pattern of PPAR-γ and β-catenin in the preneoplastic sequence.
METHODS: Colorectal ACFs and adenomas were induced using a modified DMH-induced carcinogenesis method in SD rats. The expression patterns of PPAR-γ and β-catenin in colorectal preneoplastic sequence were detected using immumohistochemisty. Proliferation and apoptosis of preneoplastic sequence were analyzed using Ki-67 and Bcl-2.
RESULTS: In the "Normal-ACF-Adenoma" sequence induced by DMH, abnormal expression of Ki-67 occurred at the transformation stage of "Normal-ACF". Positive nucleuses of Ki-67 distributed extensively within the aberrant crypt, differing from normal crypt significantly and similar to adenoma. Abnormally high expression of Bcl-2 appeared until ACF transformed to adenoma, presenting broad positive granules in the cytoplasm. PPAR-γ, as Ki-67 did, abnormally expressed during the "Normal-ACF" shift with extensive distribution of positive nucleuses. β-catenin, as Bcl-2 did, presented with different positive location and density until the transformation of "ACF-Adenoma" with evident positive nucleuses.
CONCLUSION: In the stage of "Normal-ACF", the main abnormality is higher proliferation rate found in aberrant crypt than normal crypt, and this change might be correlated to abnormal expression of PPAR-γ. Depression of apoptosis became obvious in the stage of "ACF-Adenoma", and the elevated expression of β-catenin and Bcl-2 might have a synergic role in the formation of adenoma.
- Citation: Zhang YP, Lv YM, Li J, Han YJ, Li CF. Changes of aberrant crypt foci in early colon cancer and its relationship with PPAR-γ and β-catenin. Shijie Huaren Xiaohua Zazhi 2009; 17(17): 1732-1737
- URL: https://www.wjgnet.com/1009-3079/full/v17/i17/1732.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i17.1732
大肠癌是导致死亡的主要肿瘤之一, 在我国的发病率呈逐渐上升的趋势. 美国2007年癌症统计报告中指出, 在肿瘤的预期发病率和死亡率方面结直肠癌目前已经成为第3位, 占所有肿瘤预期发病率和死亡率的10.5%和9.5%, 仅次于前列腺癌、乳腺癌、肺癌[1].
公认的结直肠癌发生、发展序列是在致癌因素的作用下肠道正常腺上皮出现异型增生, 形成异型隐窝, 并逐步发展为腺瘤、腺癌. 最近的研究发现畸变隐窝灶(aberrant crypt foci, ACF)是比微小腺瘤更早的腺瘤前病变, 其可以替代传统的结肠癌模型, 用于肿瘤机制和抗肿瘤药物的研究, 尤其是应用于筛选具有化学预防作用的药物和非药物化学品[2-3]. 前期研究发现ACF的量要远远超过腺瘤的量, 只有很少的ACF(约1/137)都能进展为腺瘤. 作为腺瘤前病变, 在增殖、凋亡水平上ACF可能还是具有与腺瘤不同的生物学行为.
越来越多的研究发现过氧化物酶增殖物激活受体-γ(peroxisome proliferators-activated receptor-γ, PPAR-γ)与肿瘤的关系非常密切, 在很多肿瘤组织中呈异常的高表达状态. 其作为核激素受体广泛参与了细胞内多种信号通路, 其中很多与肿瘤的发生、发展有关, 如Wnt通路及通路等[4,5]. PPAR-γ在肿瘤的形成和发展中可能发挥着重要作用[6].
β-catenin最早是被发现是细胞膜黏附蛋白复合物的成员, 后来发现其还是一个重要的细胞信号分子, 参与肿瘤的发展过程, 并同时伴随蛋白从胞质向胞核的转移. 其机制可能是结肠腺瘤样息肉病(adenomatous polyposis coli, APC)基因发生突变后, 其蛋白与胞质β-catenin结合, 并引起β-catenin在细胞核的聚集. 因为在肿瘤的发生过程中, APC基因突变被认为是最早、最关键的环节, 所以β-catenin的这一变化并被认为是腺瘤-腺癌序列进展的重要标志[7-9].
本研究旨在通过免疫组织化学方法观察ACF的增殖、凋亡变化情况及PPAR-γ和β-catenin在正常"黏膜-ACF-腺瘤"序列中的演变及意义.
SPF级♂Sprague-Dawley大鼠, 20只, 大小为5-6 wk龄, 体质量约200 g, 饲养环境为北京大学医学部动物中心SPF实验室, 恒温、恒湿条件下喂养, 每日光照时间为12 h, 饲料、水均不受限制. 动物购自北京维通利华实验动物技术有限公司, SPF级饲料由北京科澳协力饲料有限公司提供.
1.2.1 ACF及腺瘤诱导: 实验分2组: 阴性对照组和DMH组. 肿瘤诱导药物为1, 2-二甲肼(DMH), 购自Sigma(中国)公司, DMH的给药方法为实验开始第1天单次腹腔注射, 120 mg/kg ip, 2 wk后20 mg/kg sc, 颈部皮下注射加强1次. 12 wk后过量麻醉处死大鼠, 将结肠沿纵轴切开. 息肉切取后于甲醛溶液固定. 余结肠经美蓝染色后解剖显微镜下观察ACF, 并选取较大ACF切取后甲醛溶液固定. 对固定组织经脱水、透明等流程制成蜡块保存备用.
1.2.2 免疫组织化学: 标本按照北京大学第三医院消化疾病研究中心免疫组织化学常规流程处理, 采用两步法检测, DAB显色, 苏木素复染, 观察目标蛋白的表达强度和分布. PPAR-γ一抗为小鼠源单克隆抗体(sc-7273, Santa Cruz), 工作浓度为1:20; β-catenin一抗为小鼠源单克隆抗体(中杉金桥生物技术公司), 工作浓度为1:50, 二抗为辣根过氧化物酶标记的山羊抗小鼠IgG抗体(中杉金桥生物技术公司), 工作浓度为1:500. Ki-67和Bcl-2为羊源单克隆抗体, 二抗为辣根过氧化物酶标记的兔抗羊IgG抗体, 二者均按照中杉金桥生物技术公司提供的工作浓度和流程操作.
阴性对照组未见异型隐窝. DMH组可见大量ACF, 平均每只大鼠为137.8±59.4个, 另可见散发腺瘤性息肉1个. 其中ACF在大体形态上表现为隐窝开口扩大, 隐窝间脊增宽, 与周围正常隐窝界限分明. 组织病理表现为异型隐窝上皮细胞胞核增大、胞质浓染.
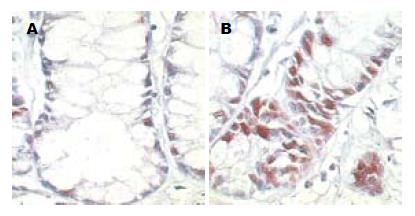
正常隐窝上皮Ki-67的表达仅局限于隐窝下部和底部, 平均每个隐窝阳性细胞的个数为2-4个(图1A). 在ACF中Ki-67的表达显著增加, 呈广泛的强阳性, 分布于整个隐窝, 或隐窝中下部, 呈一个由下向上的发展趋势(图1B). 说明经致癌剂DMH诱导出的ACF不仅表现为大体形态异常和组织病理上的异常, 而且处于增殖状态的细胞比例也显著升高, 反应细胞增殖水平的分子标志已经出现了显著异常高表达.
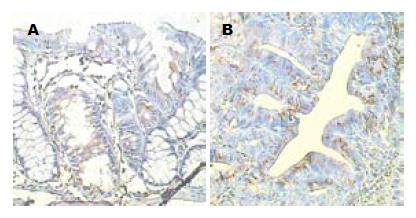
正常隐窝上皮Bcl-2的表达为阴性. ACF中异型隐窝上皮的Bcl-2表达亦为阴性, 偶可见很弱的胞质弥漫性阳性(图2A). 腺瘤中Bcl-2表达则显著升高, 呈广泛的强阳性胞质颗粒(图2B). 说明经致癌剂DMH诱导出的ACF虽然表现出了大体形态异常、组织病理学异常、增殖水平异常, 但其凋亡水平还是处于正常水平.
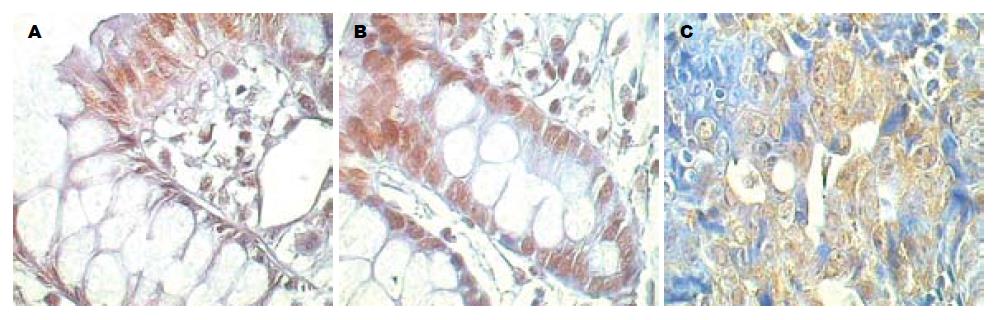
PPAR-γ主要表达在细胞核中, 在正常表面上皮中即有普遍而显著的阳性表达, 在正常隐窝上皮中则表现为阴性, PPAR-γ的表达在隐窝上皮和表面上皮交界处界限亦很分明(图3A). ACF的异型隐窝上皮中可见显著的PPAR-γ核阳性表达, 主要为整个异型隐窝广泛的细胞核阳性, 部分隐窝的PPAR-γ核阳性局限在隐窝上部或中上部, 与表面上皮阳性细胞相连续, 未见单纯累及隐窝中部或下部而与表面阳性上皮间断的异型隐窝(图3B). 腺瘤中表现为不均一的表达, 阳性部位胞核阳性明显(图3C), 阴性部位表达很弱.
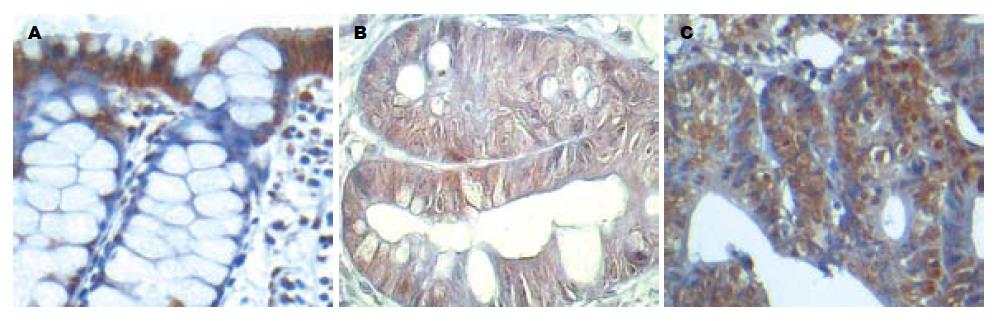
β-catenin在表面上皮呈阳性表达, 表达部位局限在细胞膜, 而正常的隐窝上皮细胞膜、胞质、胞核均为阴性表达(图4A). 异型隐窝上皮细胞亦为阴性表达, 偶可见弱阳性的核表达, 但未见胞膜及胞质阳性表达(图4B). 腺瘤则表现为广泛、均一而显著的胞核阳性, 部分可见胞质弱阳性(图4C).
本研究成功诱导出了大鼠结肠ACF和腺瘤性息肉, 而且经组织病理学证实其具有一定的组织异型性, 与周围正常隐窝相比表现出胞核大、胞质深染.
Ki-67是常用的反应细胞增殖水平的指标, 其阳性表达部位在胞核. 在正常组织向肿瘤组织的演变过程中其表达逐渐增加, 处于增殖状态的细胞比例显著升高, Ki-67阳性表达的细胞比例也随之升高. 而Bcl-2则是反映细胞凋亡水平的常用指标[10,11], 表现为胞质的阳性颗粒. 由于Bcl-2是凋亡抑制因子, 正常组织向肿瘤组织的演变过程中表达逐渐增加, 细胞凋亡显著减少, Bcl-2阳性表达的细胞比例也随之升高. 在通过检测ACF增殖、凋亡水平, 与正常组织和腺瘤对比发现ACF具有一些明显的特点: (1)ACF的增殖水平明显升高, 即反应细胞增殖的指标Ki-67阳性表达比例及强度显著增高, 显著高于正常组织, 而腺瘤组织接近; (2)ACF的凋亡水平没有明显变化, 即抑制细胞凋亡的指标Bcl-2表达与正常组织一样为阴性, 或呈胞质很弱的阳性, 与腺瘤组织广泛、均一的胞质强阳性形成鲜明对比. 因而ACF模型虽然可以替代结肠癌模型用于结肠肿瘤发生机制和化学预防的研究, 但是还是具有自己独特的生物学性质, 其异型隐窝不同于腺瘤的异型实质.
过氧化物酶增殖物激活受体-γ(peroxisome proliferators-activated receptor-γ, PPAR-γ)作为核激素受体, 在糖脂代谢和脂肪细胞的分化中发挥重要作用, 后来又发现其与胰岛素敏感型相关. 而且越来越多的研究发现PPAR-γ与肿瘤的关系非常密切, 在人类多种肿瘤细胞的增殖、分化和凋亡中具有重要的调节作用, 在很多肿瘤组织中呈异常的高表达状态, 如结肠癌、肺癌、乳腺癌等. 本课题组的前期研究同样发现, PPAR-γ在腺瘤组织中的分布出现异常, 而在腺癌中, PPAR-γ的表达水平明显增高. 而且很多研究研究发现, PPAR-γ激动剂吡格列酮能够显著抑制ACF的形成[12]. Kohno et al均也是利用ACF模型验证了3种常用的噻唑烷二酮(TZDs)类药物的肿瘤抑制作用[13-15].
本研究发现PPAR-γ早在ACF阶段即有显著的异常表达, 与正常隐窝形成鲜明对比, 整个异型隐窝上皮表现为广泛的胞核阳性, 部分异型隐窝仅为上部或中上部阳性, 均与阳性表达的表面上皮细胞相连续, 而正常隐窝整体阴性, 在隐窝开口处与阳性的表面上皮分界清楚. 由此推测PPAR-γ似乎是一个由上向下的表达过程, 但是这种表达的变化过程意义有待进一步研究. 腺瘤中PPAR-γ的表达又不同于单纯异型隐窝, 表现一定的不均一性, 即部分呈强阳性反应, 部分又为阴性, 阳性部位有的呈显著的单个核阳性, 有的因为肿瘤细胞核大胞质很少, 无法区分阳性表达的部位.
PPAR-γ和Ki-67的异常高表达均出现在"正常-ACF"转变阶段, 而早于Bcl-2出现异常, 说明PPAR-γ的异常与异型隐窝上皮细胞的增殖活性可能密切相关. 在正常结肠组织中二者均有表达, PPAR-γ表达在表面上皮, 即分化较好的细胞中, 而Ki-67表达在隐窝基底部增殖活跃的细胞中, 即相对原始的细胞中. 在之后"正常-ACF"转变阶段, PPAR-γ有一个从上向下的发展、延伸趋势, 而Ki-67则与之相反, 呈从下向上的趋势. 最近3个以动物活体肠组织、原代培养肠上皮细胞和结肠肿瘤细胞系为对象的功能基因组学研究显示, PPAR-γ调节的下游基因包括很多方面, 其中最主要的则是细胞代谢相关基因和细胞增殖、凋亡相关基因[6,16-17]. 但是异型隐窝的凋亡水平未见明显异常(Bcl-2正常), 增殖水平变化趋势(Ki-67分布)又与PPAR-γ相反而行, 同时结合正常表面上皮中有PPAR-γ的大量表达, 推测异型隐窝上皮内PPAR-γ的异常高表达可能反映其代谢水平的变化, 但是为什么代谢的变化在异型隐窝中是从上到下的过程, 这一问题有待进一步研究.
相对于PPAR-γ, β-catenin的异常表达出现要晚一个阶段, 发生在"ACF-腺瘤"转变阶段. 在正常隐窝和异型隐窝中β-catenin均为阴性表达, 仅仅表达在表面上皮的细胞膜上, 在腺瘤中在出现明显的胞核阳性. 根据已有的研究, 与β-catenin异常表达关系最密切的是APC的基因突变, APC蛋白功能异常使得胞质中游离的β-catenin降解过程受阻, 从而在胞质和胞核累积, 进而异常累积的β-catenin在其他因子的协同作用下激活c-Myc, 从而诱发肿瘤的发生[18-19]. APC基因的突变被认为是结肠癌发生的最原始、最关键的一个始动因素, 因而推测APC基因突变可能也是发生在"ACF-腺瘤"转化阶段. 更危险的是激活后的c-Myc进一步与同期出现异常高表达的具有抑制细胞凋亡作用的Bcl-2相互作用, 使细胞数量按照50-100倍的增长, 而且呈细胞因子非依赖性的生长. 因而β-catenin和Bcl-2异常表达的同期出现对"ACF-腺瘤"转化意义可能很重要, 但是还不具有恶性转化的能力[20].
结肠癌的发生是一个多阶段、逐渐变化的过程, 是目前形态学和分子机制两个层面研究都比较深入的肿瘤. ACF的发现为结直肠肿瘤发生序列又添加了一分子, 作为介于正常黏膜和腺瘤性息肉之间的一种癌前病变, 对其分子生物学变化的研究可以为肿瘤的发生、发展提供重要的参考价值.
总之, 在"正常-ACF"的转变过程中隐窝上皮的增殖水平显著升高, 而凋亡水平尚未出现显著降低, 一直到"ACF-腺瘤"发生转变后才出现凋亡的显著降低. 同期, 在"正常-ACF"转变过程中即出现隐窝上皮PPAR-γ的异常高表达, 而β-catenin表达尚处于正常水平, 直至"ACF-腺瘤"发生转变后才出现异常高表达. 由此可见肿瘤的发生、发展不仅要摆脱各种能够控制增殖的因素, 还要设法逃避死亡之路[20], 而且在结肠癌的发生过程中可能前者的发生要早于后者. PPAR-γ可能与细胞增殖水平的升高相关, 而β-catenin与Bcl-2同期出现异常表达对腺瘤的形成可能有一定的协同作用.
结肠癌的发生是一个由正常腺体经过异型隐窝灶、腺瘤进而发展为腺癌的阶段性演变过程, 目前已经可以在动物模型中复制这一过程. 但在这一演变过程中结肠腺上皮的增生、凋亡水平的变化趋势, 以及与此变化可能相关的关键蛋白尚未见报道.
刘宝瑞, 教授, 南京大学医学院附属鼓楼医院肿瘤中心; 张凤春, 教授, 上海交通大学医学院附属仁济医院肿瘤中心
PPAR-γ作为一种核受体在物质代谢中起着重要作用, 其新型激动剂已在临床上广泛应用于抗糖尿病治疗, 但是其在肿瘤中的作用更是引人注目.
有很多研究显示PPAR-γ的活性降低是肿瘤发生过程中的重要环节, 而且其激动剂似乎具有一定的抗肿瘤作用.
本研究通过成功诱导大鼠结肠癌前病变异型隐窝灶及腺瘤, 进而分析了"正常-异型隐窝灶-腺瘤"癌前病变序列中不同演变阶段的增殖、凋亡模式, 并初步探讨了这种变化模式与PPAR-γ和β-catenin的潜在关系.
异型隐窝灶模型作为一种新的成熟的结肠癌前病变模型已经广泛应用于肿瘤机制及治疗的研究.
本研究旨在探讨结肠癌前病变演变过程及其与PPAR-γ及β-catenin异常表达的关系, 设计合理, 具有一定的科研价值.
编辑: 李军亮 电编: 何基才
| 1. | Jemal A, Siegel R, Ward E, Murray T, Xu J, Thun MJ. Cancer statistics, 2007. CA Cancer J Clin. 2007;57:43-66. [PubMed] [DOI] |
| 3. | Wargovich MJ, Jimenez A, McKee K, Steele VE, Velasco M, Woods J, Price R, Gray K, Kelloff GJ. Efficacy of potential chemopreventive agents on rat colon aberrant crypt formation and progression. Carcinogenesis. 2000;21:1149-1155. [PubMed] [DOI] |
| 4. | Jawhari AU, Farthing MJ, Pignatelli M. The E-cadherin/epidermal growth factor receptor interaction: a hypothesis of reciprocal and reversible control of intercellular adhesion and cell proliferation. J Pathol. 1999;187:155-157. [PubMed] [DOI] |
| 5. | Wong NA, Pignatelli M. Beta-catenin--a linchpin in colorectal carcinogenesis? Am J Pathol. 2002;160:389-401. [PubMed] |
| 6. | Bush CR, Havens JM, Necela BM, Su W, Chen L, Yanagisawa M, Anastasiadis PZ, Guerra R, Luxon BA, Thompson EA. Functional genomic analysis reveals cross-talk between peroxisome proliferator-activated receptor gamma and calcium signaling in human colorectal cancer cells. J Biol Chem. 2007;282:23387-23401. [PubMed] [DOI] |
| 8. | Kikuchi A. Regulation of beta-catenin signaling in the Wnt pathway. Biochem Biophys Res Commun. 2000;268:243-248. [PubMed] [DOI] |
| 9. | Ilyas M, Tomlinson IP. The interactions of APC, E-cadherin and beta-catenin in tumour development and progression. J Pathol. 1997;182:128-137. [PubMed] [DOI] |
| 10. | Sheng H, Shao J, Morrow JD, Beauchamp RD, DuBois RN. Modulation of apoptosis and Bcl-2 expression by prostaglandin E2 in human colon cancer cells. Cancer Res. 1998;58:362-366. [PubMed] |
| 11. | McEntee MF, Chiu CH, Whelan J. Relationship of beta-catenin and Bcl-2 expression to sulindac-induced regression of intestinal tumors in Min mice. Carcinogenesis. 1999;20:635-640. [PubMed] [DOI] |
| 12. | 李 军, 吕 愈敏, 董 秀云, 金 珠. 吡格列酮对二甲基肼诱导的大鼠畸变隐窝灶的抑制作用. 北京大学学报(医学版). 2003;35:537-539. |
| 13. | Kohno H, Yoshitani S, Takashima S, Okumura A, Hosokawa M, Yamaguchi N, Tanaka T. Troglitazone, a ligand for peroxisome proliferator-activated receptor gamma, inhibits chemically-induced aberrant crypt foci in rats. Jpn J Cancer Res. 2001;92:396-403. [PubMed] |
| 14. | Tanaka T, Kohno H, Yoshitani S, Takashima S, Okumura A, Murakami A, Hosokawa M. Ligands for peroxisome proliferator-activated receptors alpha and gamma inhibit chemically induced colitis and formation of aberrant crypt foci in rats. Cancer Res. 2001;61:2424-2428. [PubMed] |
| 15. | Osawa E, Nakajima A, Wada K, Ishimine S, Fujisawa N, Kawamori T, Matsuhashi N, Kadowaki T, Ochiai M, Sekihara H. Peroxisome proliferator-activated receptor gamma ligands suppress colon carcinogenesis induced by azoxymethane in mice. Gastroenterology. 2003;124:361-367. [PubMed] [DOI] |
| 16. | Chen L, Bush CR, Necela BM, Su W, Yanagisawa M, Anastasiadis PZ, Fields AP, Thompson EA. RS5444, a novel PPARgamma agonist, regulates aspects of the differentiated phenotype in nontransformed intestinal epithelial cells. Mol Cell Endocrinol. 2006;251:17-32. [PubMed] [DOI] |
| 17. | Su W, Bush CR, Necela BM, Calcagno SR, Murray NR, Fields AP, Thompson EA. Differential expression, distribution, and function of PPAR-gamma in the proximal and distal colon. Physiol Genomics. 2007;30:342-353. [PubMed] [DOI] |
| 18. | Morin PJ, Vogelstein B, Kinzler KW. Apoptosis and APC in colorectal tumorigenesis. Proc Natl Acad Sci USA. 1996;93:7950-7954. [PubMed] [DOI] |
| 19. | Morin PJ, Sparks AB, Korinek V, Barker N, Clevers H, Vogelstein B, Kinzler KW. Activation of beta-catenin-Tcf signaling in colon cancer by mutations in beta-catenin or APC. Science. 1997;275:1787-1790. [PubMed] [DOI] |
| 20. | Cory S, Vaux DL, Strasser A, Harris AW, Adams JM. Insights from Bcl-2 and Myc: malignancy involves abrogation of apoptosis as well as sustained proliferation. Cancer Res. 1999;59:1685s-1692s. [PubMed] |