修回日期: 2009-04-08
接受日期: 2009-04-13
在线出版日期: 2009-06-08
目的: 探讨结肠黏膜低度炎症(low grade mucosal inflammation, LGMI)对大鼠内脏感觉的影响.
方法: 健康♂SD大鼠40只, 随机分为LGMI组和对照组(n = 20). LGMI组大鼠给予15 g/L葡聚糖硫酸钠(DSS)饮用7 d, 然后饮用蒸馏水7 d, 对照组大鼠饮用蒸馏水. 第14天进行气囊扩张大鼠腹部回缩反射(AWR)评分和腹壁肌电测定; 实验结束后取结肠组织作常规病理学检查; 免疫组织化学染色观察腰膨大部脊髓c-Fos、P物质(SP)和降钙素基因相关肽(CGRP)表达变化.
结果: LGMI组大鼠结肠黏膜炎症评分为1.56±0.78分, 对照组为0.46±0.54分, 2组比较差异有显著性意义(P = 0.003). 当结肠气囊压力为20 mmHg时, 2组大鼠的AWR评分和腹壁肌电幅值差异均无统计学意义; 当气囊压力为40、60、80 mmHg时, LGMI组的AWR评分和腹壁肌电幅值明显高于对照组(均P<0.05). LGMI组大鼠腰骶段脊髓c-Fos、SP、CGRP的平均吸光度值均高于对照组(165.26±10.12 vs 126.52±11.48, 134.28±10.62 vs 120.82±8.92, 157.66±6.25 vs 118.67±5.68, 均P<0.01).
结论: LGMI触发了内脏感觉过敏, 可能在IBS的发病中起重要作用.
引文著录: 王承党, 郑雪雁, 郑玮玮. 结肠黏膜低度炎症对大鼠内脏感觉的影响. 世界华人消化杂志 2009; 17(16): 1621-1625
Revised: April 8, 2009
Accepted: April 13, 2009
Published online: June 8, 2009
AIM: To investigate the role of low grade mucosal inflammation (LGMI) induced by dextran sulfate sodium (DSS) in visceral sensitivity of the rats.
METHODS: Forty healthy male Sprague-Dawley (SD) rats were randomly divided into LGMI group and control group (n = 20). LGMI was induced by addition of 15 g/L DSS to drinking water for 7 d, and then distilled water for another 7 d. The control group rats were given distilled water alone. At the 14th day, abdominal withdrawal reflex (AWR) and myoelectric amplitude (MA) of the oblique externus abdominis muscle were recorded respectively after colonic distention by balloon with ascending internal pressure from 20 mmHg to 80 mmHg. The colonic tissue samples were taken for histopathologic examinations (HE staining), and the expressions of c-fos, substance P (SP) and calcitonin gene-related peptide (CGRP) in the intumescentia lumbalis were detected using immunohistochemistry.
RESULTS: The colonic mucosal inflammation score in LGMI rats was 1.56 ± 0.78, significantly higher than that in control rats (0.46 ± 0.54, P = 0.003). Neither the AWR score nor the MA had significant difference between the two groups when the internal balloon pressure was 20 mmHg. When the pressure was up to 40, 60, 80 mmHg, the AWR score and the MA in LGMI rats were significantly higher than those in the control group (all P < 0.05). The expression of c-fos, SP and CGRP in LGMI were respectively higher than those in controls (165.26 ± 10.12 vs 126.52 ± 11.48, 134.28 ± 10.62 vs 120.82 ± 8.92, 157.66 ± 6.25 vs 118.67 ± 5.68, all P < 0.01).
CONCLUSION: Low grade inflammation of colonic mucous induced by DSS in rats may promote expression of the c-Fos, SP, and CGRP in the intumescentia lumbalis, and activate the visceral hypersensitivity, which underlies IBS.
- Citation: Wang CD, Zheng XY, Zheng WW. Dextran sulfate sodium-induced low grade mucosal inflammation activates visceral hypersensitivity in rats. Shijie Huaren Xiaohua Zazhi 2009; 17(16): 1621-1625
- URL: https://www.wjgnet.com/1009-3079/full/v17/i16/1621.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i16.1621
肠易激综合征(irritable bowel syndrome, IBS)的发病机制尚未完全明确, 肠道运动功能紊乱和内脏感觉过敏被认为是重要病理生理学改变. 近年来研究发现IBS患者的结肠和回肠存在黏膜低度炎症(low grade mucosal inflammation, LGMI), 这种炎症可能会激活内脏感觉系统. 本研究通过葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导大鼠结肠LGMI, 探讨LGMI对大鼠内脏感觉的影响.
健康♂Sprague-Dawley大鼠, 清洁级, 体质量180±31 g, 购于上海斯莱克实验动物中心. 正常饲养2 wk, 混合配方饲料喂养, 自由进食、饮水. DSS(MW = 36000-44000, 硫磺含量为18%-20%)购自美国MP Biomedicals Inc., CA; 浓缩型兔抗大鼠c-fos多克隆抗体(工作浓度1:200)、浓缩型兔抗大鼠P物质多克隆抗体(工作浓度1:400)、浓缩型兔抗大鼠CGRP多克隆抗体(工作浓度1:200)均购自武汉博士德生物工程有限公司; 二步法免疫组化检测试剂盒购自北京中杉金桥生物技术有限公司.
1.2.1 分组及处理: 将40只SD大鼠随机分为对照组(Control组)和低度炎症组(LGMI组), 每组20只. 参考张艳丽 et al[1]和Kim et al[2]的方法, LGMI组大鼠给予15 g/L DSS水溶液自由饮用7 d, 然后再自由饮用蒸馏水7 d. 对照组给予蒸馏水自由饮用14 d. 第14天时进行相关实验研究.
1.2.2 结肠扩张AWR评分: 禁食24 h、不禁水. 20 g/L戊巴比妥钠腹腔内注射麻醉, 将带气囊的导管由肛门逆行插入, 至距肛口约6 cm处, 用缝线固定. 大鼠苏醒并适应后开始测定. 气囊内压由20 mmHg起, 每隔5 min压力递升20 mmHg, 直至80 mmHg, 根据大鼠腹部回缩反射(abdominal withdrawal reflex, AWR)进行评分[3]: 0分, 结肠扩张时无反应; 1分, 结肠扩张时身体静止不动, 头部运动减少; 2分, 结肠扩张时腹部肌肉收缩, 但腹肌未抬离桌面; 3分, 结肠扩张时腹肌收缩并抬离桌面; 4分, 结肠扩张时骨盆抬起, 身体呈弓形.
1.2.3 结肠扩张时腹壁肌电测定: 按照文献[4]方法并略作改进. 电极置于大鼠腹股沟韧带上方、距中线1.5 cm的腹外斜肌上, 2电极间距3-4 cm, 电极另一端连接电生理记录仪. 结肠内置管和气囊压力改变与AWR相同, 气囊内压由20 mmHg起, 每隔5 min压力递升20 mmHg, 直至80 mmHg, 每种压力维持20 s, 记录不同压力下腹外斜肌放电幅值, 间期休息至少5 min. 电生理记录仪参数设置: 采集频率: 2 kHz, 扫描速度: 200 ms/div, 灵敏度: 200 μV, 时间常数: 0.001 s, 滤波频率: 3 kHz.
1.2.4 结肠标本病理学检查: 实验结束后, 20 g/L戊巴比妥腹腔内注射麻醉大鼠, 打开胸腔, 经心脏灌入40 g/L多聚甲醛的0.1 mol/L磷酸盐缓冲液(pH 7.4), 然后迅速剖取结肠, 距肛门约0.5 cm取结肠组织1 cm×0.5 cm, 以40 g/L甲醛溶液固定,常规石蜡包埋, 连续冠状切片, 片厚4 μm, 做HE染色, 根据Kruschewski法[5]进行病理学评分: 隐窝结构改变(3-6分)、固有层炎症细胞数量(0-3分)、杯状细胞死亡(1分)、黏膜下纤维组织增生(1分), 各项的总分: 0分为无炎症、1-4分为低度炎症、5-8分为中度炎症、9-11分为重度炎症.
1.2.5 腰膨大部脊髓免疫组化染色: 取腰膨大部(L6-S1)脊髓, 浸入40 g/L多聚甲醛固定液4 ℃过夜, 清水冲洗6 h, 再用乙醇脱水、石蜡包埋、连续冠状切片, 片厚4 μm. SP法对c-fos、P物质(SP)和降钙素基因相关肽(CGRP)进行免疫组织化学染色. 染色后将切片置于400倍光学显微镜下观察阳性神经元染色情况, 随机选取脊髓灰质背角处10个高倍视野, 利用数字显微摄像系统和图像分析系统对其平均吸光度值(IA)进行计算.
统计学处理 数据以mean±SD表示, 以Student t检验进行分析, 设α = 0.05. 采用SPSS12.0作统计学处理.
实验过程中无大鼠死亡. LGMI组大鼠结肠黏膜层及黏膜下层淋巴细胞等炎症细胞数量增多、组织充血, 但腺体排列整齐, 无上皮坏死、糜烂、隐窝脓肿、肉芽组织形成等. 对照组黏膜上皮完整, 腺体排列整齐, 无明显炎症和组织充血. LGMI组病理学评分为1.56±0.78, 对照组评分为0.46±0.54, 差异有显著性意义(P = 0.003, n = 20), 因此, LGMI组大鼠属于结肠LGMI.
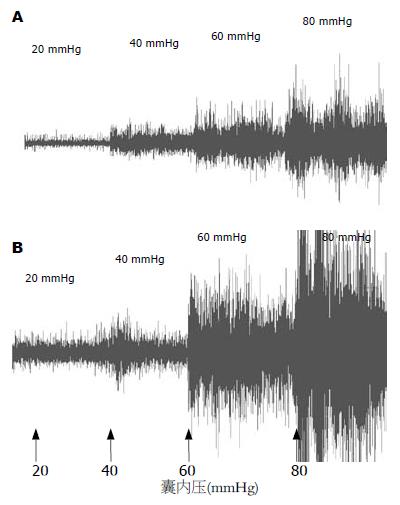
气囊压力为20 mmHg时, 2组大鼠均无明显行为学改变. 从40-80 mmHg, 2组大鼠出现不同程度的行为学改变, LGMI组大鼠的AWR评分均高于对照组(P<0.05, 表1).
| 结肠扩张压力(mmHg, n = 12) | 结肠扩张压力(mmHg, n = 8) | |||||||
| 20 | 40 | 60 | 80 | 20 | 40 | 60 | 80 | |
| AWR评分(分) | 腹壁肌电幅值 | |||||||
| 对照组 | 1.12±0.52 | 1.17±0.72 | 2.42±1.00 | 3.33±0.49 | 16.79±4.69 | 22.98±6.15 | 28.89±7.36 | 33.80±8.42 |
| LGMI组 | 1.27±0.65 | 2.42±0.52 | 3.26±0.52 | 3.75±0.45 | 20.06±10.70 | 36.27±7.20 | 47.74±14.95 | 59.14±13.16 |
| P值 | 0.605 | 0.002 | 0.037 | 0.020 | 0.502 | 0.003 | 0.003 | 0.000 |
气囊压力为20 mmHg时, 2组大鼠的腹壁肌电幅值差异无统计学意义(P = 0.502). 从40-80 mmHg, LGMI组的腹壁肌电幅值均高于对照组(P<0.01, 表1, 图1).
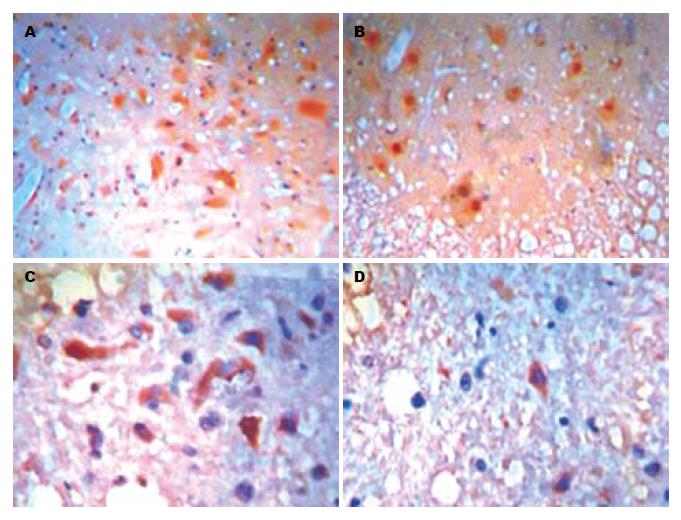
c-fos阳性表达呈棕褐色颗粒状, 位于神经细胞核内. 结肠扩张后, 2组大鼠腰骶段脊髓均有c-fos表达, 以脊髓背角处最为密集. LGMI组大鼠腰骶段脊髓c-fos IA为165.26±10.12, 对照组为126.52±11.48, 差异有显著性意义(P = 0.002).
SP阳性神经纤维集中分布于脊髓的背角浅层, 呈对称分布, 两侧无明显差别, 呈棕黄色颗粒或细丝状. LGMI组IA为134.28±10.62, 对照组为120.82±8.92, 差异有显著性意义(P = 0.002).
CGRP表达于脊髓背角浅层, 呈深褐色, 为胞质内致密均匀分布, 体积较大的神经元细胞(Φ>50 μm)染色较深, 体积较小的神经元细胞染色浅或不染色. LGMI组IA为157.66±6.25, 对照组为118.67±5.68, 差异有显著性意义(P = 0.007, 表2, 图2).
| c-fos | SP | CGRP | |
| 对照组 | 126.52±11.48 | 120.82±8.92 | 118.67±5.68 |
| LGMI组 | 165.26±10.12 | 134.28±10.62 | 157.66±6.25 |
| P值 | 0.002 | 0.002 | 0.007 |
本研究利用15 g/L DSS诱导SD大鼠结肠炎, 经病理学检测符合"低度炎症"的表现, 这种低度炎症可以使大鼠对结肠扩张刺激的内脏感觉过敏, 同时使腰骶段脊髓c-fos、SP、CGRP表达上调.
IBS的发病机制尚未完全清楚, 但已经明确内脏感觉过敏、肠动力紊乱在IBS症状的发生中起重要作用. 近年来研究发现IBS患者虽然没有肉眼可见的肠道结构改变, 但是与健康志愿者相比, IBS患者回肠和结肠黏膜中免疫细胞数量明显增加, 如肠嗜铬细胞、肥大细胞、T细胞、巨噬细胞等[6-10], 尽管其细胞数量远少于UC患者, 但已经说明这部分IBS患者存在肠黏膜炎症和免疫细胞功能活化[11], 这种炎症常常被称为低度炎症. 在本研究中, 大鼠先饮用15 g/L DSS水溶液7 d, 停止给药7 d以后结肠黏膜中仍然有低度炎症存在, 这种情况类似于感染后IBS患者的表现. Chadwick et al[12]研究发现: 40% IBS患者结肠活检组织标本在显微镜下可见非特异性炎症表现, 如中性粒细胞、肥大细胞和T细胞的浸润; 50% IBS患者肠道黏膜活检组织的常规病理学检测虽然是正常的, 但经过免疫组织化学染色就会发现其上皮内淋巴细胞和固有层CD25+/CD3+ T细胞数量增加.
这种结肠LGMI是否对内脏感觉过敏有影响呢? 本研究发现, 在大鼠对结肠扩张的感受压力范围内, 不论是AWR评分、腹壁肌电幅值、还是脊髓与痛觉有关的神经递质或介质的表达水平, LGMI组大鼠均明显高于对照组. 这说明炎症因素参与了内脏感觉的产生和传导, 即LGMI导致SD大鼠对结肠机械扩张的内脏敏感性增高, 与国外研究结果相一致[13-15], 这些表现与IBS的特征吻合.
IBS患者结肠活检组织释放的介质可以使培养的鼠类感觉神经元致敏, 将这些活检组织标本的培养上清液灌入小鼠结肠中可以导致小鼠躯体感觉过敏和内脏感觉过敏, 这种促伤害感受效应可以被丝氨酸蛋白酶抑制剂和PAR2拮抗剂所阻断, 提示IBS患者结肠黏膜释放的各种介质和蛋白酶可通过PAR2介导直接刺激感觉神经元、导致内脏感觉过敏[16].
内脏感觉过敏的机制中除了中枢性因素之外, 肠黏膜传入系统的外周致敏和"静息的"伤害感受器的复苏可能是内脏感觉过敏的关键性因素. 免疫细胞及炎症介质可以使黏膜传入神经末梢致敏[17]、脊髓背角神经元上SP表达增高[18], 即内脏感觉系统的敏化. LGMI及其释放的各种介质作用于外周感受器, 经三级神经元传递至中枢: 初级神经元(Ⅰ级神经元)位于背根神经节, 其一轴突投射至外周组织, 接受感受器传来的信号, 另一轴突投射至脊髓背角的灰质, 将信号传至脊髓背角神经元(Ⅱ级神经元), Ⅱ级神经元的轴突交叉至对侧脊索、上行至丘脑、网状结构和中脑, 丘脑和网状结构中的Ⅲ级神经元再投射至大脑皮质、前扣带回(ACC)和岛叶等, 编码内脏感觉的性质、定位、强度等. 同时, 大脑又通过延髓下行抑制系统作用于脊髓背角, 影响内脏感觉信号的传入. 这一完整的感觉传导通路即脑-肠轴[19], 其中脊髓背角起着承上启下的关键作用.
脊髓背角c-fos蛋白是神经元被内脏伤害性刺激所激活的标志物, 其表达水平与刺激强度相关[20]. SP是脊髓水平传递伤害性信息的兴奋性神经递质, SP及其受体分布在脊髓的Ⅰ、Ⅱ及Ⅳ层, 参与疼痛信息的传递, SP升高的水平与炎症引起的腹痛程度密切相关[21]. CGRP是外周感觉传入神经中与SP共存的一种神经肽, 是痛觉及痛觉过敏所必需的物质[22]. 本研究发现: 与对照组相比, LGMI组大鼠脊髓背角的c-fos、SP、CGRP表达都明显增高, 而且LGMI组大鼠的SP阳性表达扩展到Ⅰ-Ⅳ层(正常大鼠脊髓SP主要表达在Ⅰ层), 即LGMI大鼠的脊髓水平上与痛觉有关的多种兴奋性神经递质表达增强, 提示结肠LGMI已经造成脊髓背角的兴奋性增高, 使大鼠内脏感觉过敏.
此外, LGMI还可以引起非炎症部位感觉过敏[18]. 三硝基苯磺酸诱发豚鼠回肠炎症之后, 尽管结肠黏膜没有炎症, 但远端结肠黏膜下神经元特性发生改变、含5-HT的肠嗜铬细胞数量增加, 同时结肠黏膜上皮细胞生理功能(如膜电流和离子通道)也发生改变. 因此, 肠道一个部位的炎症, 可以改变非炎症部位的肠神经反射回路和上皮细胞功能, 成为肠道炎症后非炎症部位功能改变的基础[23].
总之, DSS诱导的大鼠结肠黏膜低度炎症可以使脊髓背角c-fos、SP、CGRP等与痛觉有关的神经递质表达上调, 增强对结肠机械扩张的敏感性, 即结肠黏膜低度炎症触发了内脏感觉过敏, 可能在IBS的发病中起重要作用.
已经明确内脏感觉过敏、肠动力紊乱在IBS的发生中起重要作用. 近年来研究发现IBS患者的结肠和回肠存在黏膜低度炎症(LGMI), 但是这种炎症是否会激活内脏感觉系统尚未引起重视.
李定国, 教授, 上海交通大学医学院(原上海第二医科大学)附属新华医院消化内科; 刘占举, 教授, 同济大学附属第十人民医院胃肠内科
本文已经提示结肠黏膜低度炎症可以诱发内脏感觉过敏, 但是, 哪些因子起作用、如何发挥作用、相应的抑制剂是否能够纠正这种作用, 都值得研究; 在临床方面, IBS(特别是感染后IBS)患者中有多少比例存在低度炎症、如何消除这种炎症的影响也都缺乏研究.
本研究应用低浓度的葡聚糖硫酸钠溶液成功诱导出结肠黏膜低度炎症大鼠模型, 这种模型稳定、制作简单、重复性好, 并且证实这种低度炎症可以诱发内脏感觉过敏.
结肠黏膜低度炎症诱发内脏感觉过敏, 如果能够消除这种炎症, 就可能降低内脏感觉的敏感性.
本文分析了在结肠黏膜低度炎症状态下, 内脏神经的感觉变化, 对IBS治疗提供了重要的理论依据.
编辑: 李军亮 电编: 何基才
| 2. | Kim TW, Seo JN, Suh YH, Park HJ, Kim JH, Kim JY, Oh KI. Involvement of lymphocytes in dextran sulfate sodium-induced experimental colitis. World J Gastroenterol. 2006;12:302-305. [PubMed] |
| 3. | La JH, Sung TS, Kim HJ, Kim TW, Kang TM, Yang IS. Peripheral corticotropin releasing hormone mediates post-inflammatory visceral hypersensitivity in rats. World J Gastroenterol. 2008;14:731-736. [PubMed] [DOI] |
| 4. | Benmansour S, Cecchi M, Morilak DA, Gerhardt GA, Javors MA, Gould GG, Frazer A. Effects of chronic antidepressant treatments on serotonin transporter function, density, and mRNA level. J Neurosci. 1999;19:10494-10501. [PubMed] |
| 5. | Kruschewski M, Foitzik T, Perez-Cantó A, Hübotter A, Buhr HJ. Changes of colonic mucosal microcirculation and histology in two colitis models: an experimental study using intravital microscopy and a new histological scoring system. Dig Dis Sci. 2001;46:2336-2343. [PubMed] [DOI] |
| 6. | Bradesi S, McRoberts JA, Anton PA, Mayer EA. Inflammatory bowel disease and irritable bowel syndrome: separate or unified? Curr Opin Gastroenterol. 2003;19:336-342. [PubMed] [DOI] |
| 7. | O'Sullivan M, Clayton N, Breslin NP, Harman I, Bountra C, McLaren A, O'Morain CA. Increased mast cells in the irritable bowel syndrome. Neurogastroenterol Motil. 2000;12:449-457. [PubMed] [DOI] |
| 8. | Spiller RC, Jenkins D, Thornley JP, Hebden JM, Wright T, Skinner M, Neal KR. Increased rectal mucosal enteroendocrine cells, T lymphocytes, and increased gut permeability following acute Campylobacter enteritis and in post-dysenteric irritable bowel syndrome. Gut. 2000;47:804-811. [PubMed] [DOI] |
| 9. | Dupont AW. Post-infectious irritable bowel syndrome. Curr Gastroenterol Rep. 2007;9:378-384. [PubMed] [DOI] |
| 10. | Spiller RC. Role of infection in irritable bowel syndrome. J Gastroenterol. 2007;42 Suppl 17:41-47. [PubMed] [DOI] |
| 11. | Ohman L, Isaksson S, Lundgren A, Simrén M, Sjövall H. A controlled study of colonic immune activity and beta7+ blood T lymphocytes in patients with irritable bowel syndrome. Clin Gastroenterol Hepatol. 2005;3:980-986. [PubMed] [DOI] |
| 12. | Chadwick VS, Chen W, Shu D, Paulus B, Bethwaite P, Tie A, Wilson I. Activation of the mucosal immune system in irritable bowel syndrome. Gastroenterology. 2002;122:1778-1783. [PubMed] [DOI] |
| 13. | Collins SM, McHugh K, Jacobson K, Khan I, Riddell R, Murase K, Weingarten HP. Previous inflammation alters the response of the rat colon to stress. Gastroenterology. 1996;111:1509-1515. [PubMed] [DOI] |
| 14. | La JH, Kim TW, Sung TS, Kang JW, Kim HJ, Yang IS. Visceral hypersensitivity and altered colonic motility after subsidence of inflammation in a rat model of colitis. World J Gastroenterol. 2003;9:2791-2795. [PubMed] |
| 15. | Coates MD, Johnson AC, Greenwood-Van Meerveld B, Mawe GM. Effects of serotonin transporter inhibition on gastrointestinal motility and colonic sensitivity in the mouse. Neurogastroenterol Motil. 2006;18:464-471. [PubMed] [DOI] |
| 16. | Cenac N, Andrews CN, Holzhausen M, Chapman K, Cottrell G, Andrade-Gordon P, Steinhoff M, Barbara G, Beck P, Bunnett NW. Role for protease activity in visceral pain in irritable bowel syndrome. J Clin Invest. 2007;117:636-647. [PubMed] [DOI] |
| 17. | Bueno L, Fioramonti J, Delvaux M, Frexinos J. Mediators and pharmacology of visceral sensitivity: from basic to clinical investigations. Gastroenterology. 1997;112:1714-1743. [PubMed] [DOI] |
| 18. | De Giorgio R, Barbara G, Blennerhassett P, Wang L, Stanghellini V, Corinaldesi R, Collins SM, Tougas G. Intestinal inflammation and activation of sensory nerve pathways: a functional and morphological study in the nematode infected rat. Gut. 2001;49:822-827. [PubMed] [DOI] |
| 19. | 周 吕, 柯 美云. 神经胃肠病学与动力-基础与临床. 北京: 科学出版社 2005; 143-170. |
| 20. | Ghanima A, Bennis M, Rampin O. c-Fos expression as endogenous marker of lumbosacral spinal neuron activity in response to vaginocervical-stimulation. Brain Res Brain Res Protoc. 2002;9:1-8. [PubMed] [DOI] |
| 21. | Bueno L, Fioramonti J. Effects of inflammatory mediators on gut sensitivity. Can J Gastroenterol. 1999;13 Suppl A:42A-46A. [PubMed] |
| 22. | Friese N, Diop L, Chevalier E, Angel F, Rivière PJ, Dahl SG. Involvement of prostaglandins and CGRP-dependent sensory afferents in peritoneal irritation-induced visceral pain. Regul Pept. 1997;70:1-7. [PubMed] [DOI] |