修回日期: 2009-03-25
接受日期: 2009-03-30
在线出版日期: 2009-05-28
目的: 探讨腹泻型肠易激综合征(D-IBS)动物模型的建立方法.
方法: ♂Wistar大鼠40只, 随机分为IBS1组、IBS2组、灌肠对照组及正常对照组, 每组10只, 采用乙酸灌肠加束缚应激和Williams方法制造IBS动物模型, 用腹壁撤退反射(AWR)评分和腹外斜肌放电活动检测对其内脏敏感性, 同时行组织学检查对肠黏膜的组织学改变进行评价.
结果: 两模型组大鼠AWR评分和腹外斜肌收缩次数在不同扩张容量(1.0、1.5、2.0 mL)下均较对照组明显增加(F = 6.318, 3.978, 7.810, 均P<0.05; F = 6.318, 3.978, 7.810, 均P<0.05). 组织学分析显示各组大鼠均无明显的炎症性表现.
结论: 乙酸灌肠加束缚应激和Williams方法制成的IBS动物模型均符合IBS的内脏敏感性机制, 可用于IBS的实验研究.
引文著录: 安钰, 白殿卿, 付健, 孙晓宁. 乙酸灌肠加束缚应激致大鼠肠易激综合征模型的建立及其评价. 世界华人消化杂志 2009; 17(15): 1548-1551
Revised: March 25, 2009
Accepted: March 30, 2009
Published online: May 28, 2009
AIM: To explore the method to establish a rat model of diarrhea-predominant irritable bowel syndrome and to provide experimental evidence for future research.
METHODS: Forty male Wistar rats were divided into four groups: IBS1 group, IBS2 group, positive group and normal control group. A rat model of IBS was established by intracolonic instillation of acetic acid and restraint stress and using Williams method. Visceral hypersensitivity was evaluated by abdominal with-drawal reflex and abdominal electrical activity, while histological diversification was evaluated by histological examination.
RESULTS: Visceral hypersensitivity (abdominal with-drawal reflex and abdominal electrical activity) was significantly enhanced in two model groups than two control groups (F = 6.318, 3.978, 7.810, all P < 0.05; F = 6.318, 3.978, 7.810, all P < 0.05). There were no signs of obvious inflammation in the rats of each group.
CONCLUSION: A rat model of IBS induced by intracolonic instillation of acetic acid and restraint stress and Williams method is in accord with visceral hypersensitivity of IBS, feasible for experimental study.
- Citation: An Y, Bai DQ, Fu J, Sun XN. Establishment and evaluation of a rat IBS model induced by intracolonic instillation of acetic acid and restraint stress. Shijie Huaren Xiaohua Zazhi 2009; 17(15): 1548-1551
- URL: https://www.wjgnet.com/1009-3079/full/v17/i15/1548.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i15.1548
肠易激综合征(irritable bowel syndrome, IBS)以腹痛或腹部不适、大便习惯(腹泻、便秘或腹泻与便秘交替)和(或)大便性状的改变等为主要临床表现, 多为慢性、间歇性发作, 经检查无特异的生物化学或形态组织学异常[1]. 可以说IBS是生理-心理-社会疾病的典型代表, 不是一种能够通过确切的病理生理或均一的临床表现而确定的疾病. 其病因涉及精神因素、遗传、感染、食物过敏、神经内分泌等因素, 其发病的机制主要与内脏感觉过敏、胃肠动力学异常、肠道感染和心理等因素有关[2-5]. 目前较成熟或研究中常用的IBS动物模型多是根据以上的一个因素或一种机制建立的. 本文将采用乙酸灌肠加束缚应激制造D-IBS动物模型并对其进行评价, 有望为炎症后IBS发病机制的实验研究提供新的依据.
成年♂Wistar大鼠40只, 体质量200±5 g, 购自湖南疾病预防控制中心, 实验动物生产许可证号: SYXK(湘)2003-0002. RM6280C型多道生理信号采集处理系统和针型插入型电极均由成都仪器厂提供. 8F导尿管(直径2 mm, 球囊最大容量3 mL, 最大直径2 cm)用作结直肠内球囊扩张导管(浙江康康医疗器械有限公司生产).
1.2.1 分组: 整个实验操作过程均饲养于标准的Ⅱ级动物房. 适应性饲养1wk后随机分为4组: IBS1组: 乙酸灌肠+束缚应激组; IBS2组: 束缚应激组; 灌肠对照组: 生理盐水+束缚应激组; 正常对照组, 每组10只.
1.2.2 大鼠模型制备: IBS1组: 实验前24 h禁食不禁水, 乙醚麻醉后经肛门插入连接注射器的硅胶管(距肛门8 cm), 结肠内灌入40 mL/L的乙酸1 mL, 缓慢拔出硅胶管, 用手压迫肛门并将大鼠尾巴抬高30 s, 后用0.01 mol/L PBS 1 mL冲洗结肠. 放回笼中自由活动进食水, 于第7天行束缚应激, 将大鼠置于一限制起肢体但不影响其呼吸的特制透明圆柱形筒内, 3 h后将大鼠放入饲养笼中[6]; 灌肠对照组: 用生理盐水1 mL代替乙酸灌肠, 其余方法相同; IBS2组: 按照Williams方法[7]略作修改, 束缚前禁食24 h不禁水, 乙醚麻醉后, 用宽胶带束缚前肩、前上肢及胸部, 限制前上肢搔抓头面部, 但不限制其活动, 束缚时间为1 h; 正常对照组: 不做任何处理.
1.2.3 腹壁撤退反射评分: 大鼠实验前24 h禁食不禁水, 在30 g/L戊巴比妥钠腹腔注射(1 mL/kg)麻醉下, 将涂石蜡油的带气囊的8F导尿管经肛门插入(使气囊末端插入肛门内7.0 cm/1.0 cm, 在肛门外1.0 cm处将其固定在大鼠尾根部)后, 将大鼠放入特制的透明塑料桶笼内(18 cm×5 cm×7 cm)中, 只能前后运动不能转身, 待大鼠适应环境30 min后开始实验. 每只大鼠给予球囊扩张3次, 容量分别为1.0、1.5、2.0 mL, 每次扩张持续5 min, 间隔30 s(以防肠道缺血).
腹壁撤退反射(abdominal with-drawal reflex, AWR)评分标准[8]: 0分, 给予结直肠扩张刺激时大鼠情绪基本稳定; 1分, 给予刺激时变得不稳定, 偶尔扭动头部; 2分, 腹背部肌肉轻微收缩但腹部未抬离地面; 3分, 腹背部肌肉较强烈收缩并把腹部抬离地面; 4分, 腹部肌肉强烈收缩, 腹部呈弓形并把腹部﹑会阴部抬离地面.
1.2.4 腹壁肌电活动: 记录腹壁肌电活动评估肠道敏感性[9]: 大鼠实验前24 h禁食不禁水, 大鼠在30 g/L戊巴比妥钠腹腔注射(1 mL/kg)麻醉下, 将涂石蜡油的带气囊的8F导尿管经肛门插入(使气囊末端插入肛门内7.0 cm/1.0 cm, 在肛门外1.0 cm处将其固定在大鼠尾根部)后, 大鼠固定在手术台上, 将银丝双极电极插入腹股沟韧带上方、剧中线1.5 cm一侧腹外斜肌上, 待大鼠适应30 min后, 每只大鼠给予球囊扩张3次, 容量分别为1.0、1.5、2.0 mL, 每次扩张持续5 min, 间隔30 s(以防肠道缺血), 记录5 min内腹外斜肌的收缩次数. 肌电活动增高超过基线水平100 μV以上为一次有意义的腹部收缩活动.
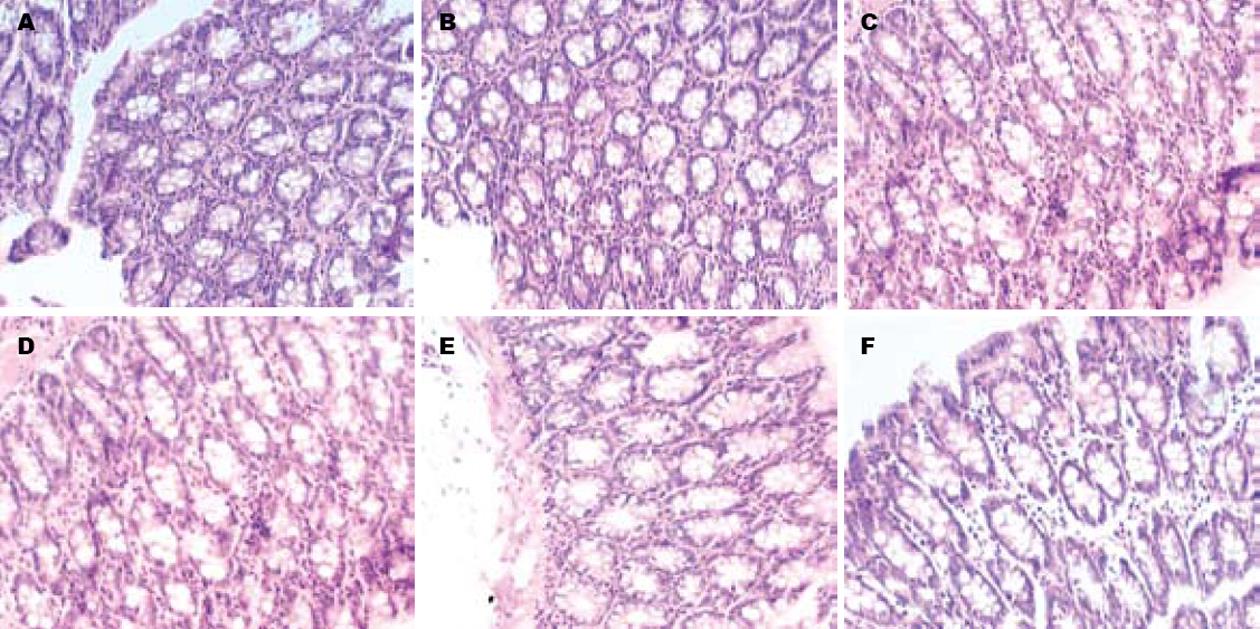
1.2.5 组织形态学检查: 肌电活动测定结束后, 给予过量的麻醉药将大鼠处死, 分别取横结肠、降结肠及直肠组织各1块, 40 g/L甲醛溶液固定, 苏木素-伊红染色, 显微镜下观察肠黏膜病理组织学改变.
统计学处理 用SPSS13.0统计学软件进行统计学分析. 计量数据以mean±SD表示. P<0.05被认为具有显著性统计学差异.
在不同扩张容量下, 模型组大鼠AWR评分较对照组明显增加, 提示其内脏敏感性增加(F1.0、F1.5和F2.0分别为6.318、3.978和7.810, P<0.05), 而两模型组之间无显著性差异(表1).
与AWR评分结果相似, 模型组大鼠腹外斜肌收缩次数较对照组明显增加, 进一步提示其内脏敏感性增加(F1.0、F1.5和F2.0分别为29.744、7.816、26.499, P<0.05), 即所谓的痛觉过敏, 而两模型组之间无显著性差异(表1).
各组大鼠肠黏膜组织结构完整, 均无充血﹑水肿、溃疡, 显微镜下观察无炎症细胞浸润等组织学改变(图1).
IBS动物模型可归纳为3种类型: 致中枢兴奋性增高IBS动物模型(束缚-制动应激、游泳致疲劳等), 外周致敏IBS动物模型(感染后肠功能紊乱), 两者联合作用IBS动物模型. 传统的第1类IBS动物模型的理论依据是应激可产生IBS样症状, 但研究多为急性应激与胃肠道功能的关系, 而IBS患者具有多次反复受躯体心理因素刺激而发病或复发的特点. Williams et al[7]早在1988年即在大鼠轻度乙醚麻醉状态下, 给予前肩﹑上肢和胸部等束缚以限制其活动后研究动力改变, 并证明了此应激可以改变大鼠小肠和直肠传输时间﹑增加排便次数, 并且是一种较轻微的﹑非溃疡形成的刺激, 因此作为较典型动物模型被后人广泛用于IBS的实验研究. 后在2005年, 吕红 et al[10]对传统的束缚应激(即Williams方法)动物模型进行了新的评价, 发现束缚应激后大鼠在不同容量级别下的腹壁肌肉收缩次数均较对照组明显增多, 同时无论对照组还是束缚应激组大鼠的腹壁肌肉收缩次数均随气囊容量增加而增加, 出现了类似人类IBS的内脏高敏现象, 说明束缚应激模型除可用于动力研究外, 还可进行内脏敏感性的研究. 本文的研究结果与吕红 et al[10]的研究相似, 也发现束缚应激后大鼠的内脏敏感性较对照组增高, 且肠黏膜组织学检查无水肿﹑充血及炎症细胞浸润等组织学改变, 符合IBS的内脏高敏感性和无生化及病理组织学改变特征.
外周为靶点制造的模型研究较多的是病原体感染[2]和化学刺激物诱导制成的IBS动物模型[11]. 新近的研究发现[6], 乙酸灌肠7 d后肠黏膜组织学和髓过氧化物酶活性恢复正常, 但大鼠对直肠扩张刺激的敏感性持续增高, 并且束缚应激可以引起大鼠排便的明显增多, 这些表现与IBS的特征吻合. 鉴于IBS病因的复杂性、病机的多重性, 因此, 建立多成分综合性动物模型更符合IBS的实际情况.
由此, 本文采用了乙酸灌肠加束缚应激制造了IBS的动物模型[6]: 研究发现, 实验发现乙酸灌肠7 d后结肠组织学检查正常, 但大鼠对结直肠球囊扩张刺激的敏感性增高(模型组的AWR评分及腹壁肌电活动均较对照组明显增加), 而灌肠对照组大鼠对结直肠球囊扩张刺激的敏感性与正常对照组无差异, 故排除了损伤因素所导致的内脏敏感性增高, 与徐俊荣 et al[12]研究结果相同. 且常规组织学检查与单纯束缚应激(即Williams法)组大鼠的肠黏膜组织学改变无差异, 均未发现水肿﹑充血及炎症细胞浸润等病理学改变, 故也排出了化学性刺激引起的内脏敏感性增高, 也更好的模拟了IBS的多因素发病机制, 反映了炎症和心理应激在IBS发病中的作用. 进一步证实了这种方法造成的IBS动物模型是可靠的. 但需注意乙酸灌肠加束缚应激制成的IBS动物模型的致敏部位为结肠, 而Williams法制成的IBS动物模型的致敏部位为直肠.
目前有关IBS模型甚多, 但都是基于IBS发病的一种因素而制成的模型. 本文将采用乙酸灌肠加束缚应激制造D-IBS动物模型并对其进行评价, 有望为炎症后IBS发病机制的实验研究提供新的依据.
王小众, 教授, 福建医科大学附属协和医院消化内科; 潘秀珍, 教授, 福建省立医院消化内科.
IBS是常见的功能性胃肠疾病, 目前发病机制尚未明确, 正确而合理的动物模型仍是目前的重点和热点.
国外学者Kim et al对乙酸灌肠方法制造IBS大鼠模型进行了动态观察, 初步证实乙酸灌肠方法可用于IBS实验研究.
乙酸灌肠加束缚应激方法制成的IBS模型大鼠内脏敏感性较对照组显著增高, 且组织学检查与对照组无差异, 说明该方法制成的大鼠模型符合IBS的特征, 且他也避免了传统束缚应激方法的不足, 可用于IBS的实验研究.
本研究对IBS模型的建立进行探索, 具有较好的参考和借鉴价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | 莫 剑忠, 袁 耀宗, 邹 多武. 消化系功能性和动力障碍性疾病. 第1版. 上海: 上海科学技术出版社 2005; 280-298. |
| 2. | Mayer EA. Emerging disease model for functional gastrointestinal disorders. Am J Med. 1999;107:12S-19S. [PubMed] [DOI] |
| 6. | La JH, Kim TW, Sung TS, Kang JW, Kim HJ, Yang IS. Visceral hypersensitivity and altered colonic motility after subsidence of inflammation in a rat model of colitis. World J Gastroenterol. 2003;9:2791-2795. [PubMed] |
| 7. | Williams CL, Villar RG, Peterson JM, Burks TF. Stress-induced changes in intestinal transit in the rat: a model for irritable bowel syndrome. Gastroenterology. 1988;94:611-621. [PubMed] |
| 8. | Ness TJ, Gebhart GF. Colorectal distension as a noxious visceral stimulus: physiologic and pharmacologic characterization of pseudaffective reflexes in the rat. Brain Res. 1988;450:153-169. [PubMed] [DOI] |
| 10. | 吕 红, 王 伟岸, 钱 家鸣. 传统束缚应激动物模型内脏感觉的新评价. 胃肠病学和肝病学杂志. 2005;14:111-113. |
| 11. | Collins SM, McHugh K, Jacobson K, Khan I, Riddell R, Murase K, Weingarten HP. Previous inflammation alters the response of the rat colon to stress. Gastroenterology. 1996;111:1509-1515. [PubMed] [DOI] |