修回日期: 2009-04-17
接受日期: 2009-04-20
在线出版日期: 2009-05-28
目的: 探讨TMEM16A在食管鳞状细胞癌发生发展中的意义.
方法: 2007-01/2008-04南京医科大学附属江宁医院手术切除的食管鳞癌标本60例, 均为癌组织及距癌至少5 cm远的配对癌旁组织. 应用免疫组织化学SP法及Western blot法检测食管鳞癌组织及相应癌旁组织的TMEM16A蛋白表达.
结果: 免疫组织化学结果: 食管鳞癌组织、癌旁组织中TMEM16A蛋白的表达差异具有统计学意义(52.50% vs 20.00%, P<0.05), TMEM16A在淋巴结转移组中的阳性表达率显著高于无淋巴结转移组(65.38% vs 21.43%, P<0.05), 不同分化程度高分化、中分化、低分化的食管鳞状细胞癌中, TMEM16A的阳性表达率分别为27.27%、43.75%和84.62%, 3者比较差异有显著性(P<0.05). TMEM16A表达与食管鳞癌的TNM分期无明显相关性; Western blot法检测发现TMEM16A在食管癌组织的表达较癌旁组织强(t = 42.16, P<0.05).
结论: TMEM16A可能在食管癌的发生中有一定的作用, 有望为食管癌的分子诊断、基因治疗和预后评估提供新的分子靶点.
引文著录: 柏文霞, 施瑞华, 王建宁, 郝波, 刘伟. TMEM16A在食管鳞癌中的表达及意义. 世界华人消化杂志 2009; 17(15): 1513-1516
Revised: April 17, 2009
Accepted: April 20, 2009
Published online: May 28, 2009
AIM: To identify the expression of TMEM16A in esophageal squamous cell cancer (ESCC) and to explore its potential role in carcinogenesis and progression of esophageal cancer.
METHODS: A total of 60 cases with esophageal squamous cell carcinoma, which were cancerous tissues and their adjacent tissues, were collected at Jiangning hospital affiliated Nanjing medical university from 2007-01 to 2008-04. All tumor tissues were matched with distant tissues at least 5 cm away from cancer. Immunohistochemistry staining (SP method) and Western blot were performed to detect protein TMEM16A expression in ESCC and its corresponding para-cancerous tissues.
RESULTS: Immunohistochemistry revealed that the positive rate of TMEM16A protein was 52.50% in carcinoma of esophagus, significantly higher than that in cancer-adjacent tissues (20%, P < 0.05). There was significant difference in TMEM16A expression between the lymph node positive group and the lymph node negative group (65.38% vs 21.43%, P < 0.05). The positive rates of TMEM16A protein in tumor of high, middle and low differentiation groups were 27.27%, 43.75% and 84.62% , respectively, with a statistically significant difference (P < 0.05). No significant association was observed between the positive expression of TMEM16A and TNM stages; we also found a higher expression of TMEM16A in ESCC than in para-cancer tissues by Western blot (t = 42.16, P < 0.05).
CONCLUSION: TMEM16A may play an important role in carcinogenesis of ESCC. TMEM16A is expected to be a new significant biomarker in molecular diagnosis, gene therapy, and prognosis evaluation for ESCC.
- Citation: Bai WX, Shi RH, Wang JN, Hao B, Liu W. Expression and significance of TMEM16A in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2009; 17(15): 1513-1516
- URL: https://www.wjgnet.com/1009-3079/full/v17/i15/1513.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i15.1513
食管癌是世界上最常见的恶性肿瘤之一, 我国是食管癌高发地区, 每年因食管癌死亡患者约15万, 占癌症患者死亡率近四分之一, 居第2位[1]. 在食管癌发生的早期, 有许多基因在其结构、表达及生物学功能方面发生了改变, 因此导致了细胞周期及细胞凋亡过程的异常, 如Survivin、Fas、FasL、MMP-7等[2]. 目前, TMEM16A基因在食管鳞癌研究中的报道较少. 前期工作中, 我们已应用Agilent寡核苷酸芯片对食管鳞癌发生过程中基因表达谱变化进行初步分析, 比较了食管鳞癌组织与癌旁组织、癌旁组织与正常食管组织中的基因表达差异, 结果发现: 两组的差异表达基因, 出现同向变化的上调基因38个, 下调基因61个. 其中, TMEM16A有显著上调表达. Real time RT-PCR结果证实芯片检测结果准确. 与Carneiro et al[3]研究一致. 以上研究的基础上, 我们选取TMEM16A作为目标基因, 应用免疫组织化学及Western blot的方法在组织水平进一步研究, 检测其与食管癌发生、发展、分化、转移等的相关性, 以便寻找与食管鳞癌相关的新的分子标志物.
本组免疫组织化学病例为2007-01/2008-02南京医科大学附属江宁医院手术切除的食管鳞癌标本40例, 均为癌组织及距癌至少5 cm远的配对癌旁组织. 病例中男28例, 女12例, 年龄40-70(平均58.12)岁; 高、中、低分化者分别为11例、16例、13例; 有淋巴结转移者26例, 无淋巴结转移者14例. 经南京医科大学附属江宁医院病理科术后病检证实食管鳞癌诊断; 肿瘤的原发灶大小、深度、淋巴结转移、分化等亦由病理确定; 患者术前均未行化疗或放疗. 20例Western blot病例为2008-03/2008-04南京医科大学附属江宁医院手术切除的食管鳞癌, 均为癌组织及距癌至少5 cm远的配对癌旁组织. 根据组织学特征, 分别分离出癌组织, 癌旁组织, 编号、标记后置-70℃保存.
1.2.1 免疫组织化学检测: 应用SP免疫组织化学检测法, 40例食管癌组织及癌旁组织均经甲醛固定, 石蜡包埋, 4 μm厚连续切片. 兔抗人TMEM16A多克隆抗体购自Abcam公司. SP免疫组织化学试剂盒购自福州迈新生物技术开发公司, TMEM16A多抗稀释倍数为1∶150. DAB显色, 苏木素复染. 染色步骤严格按说明书进行, 以PBS液代替一抗作阴性对照.
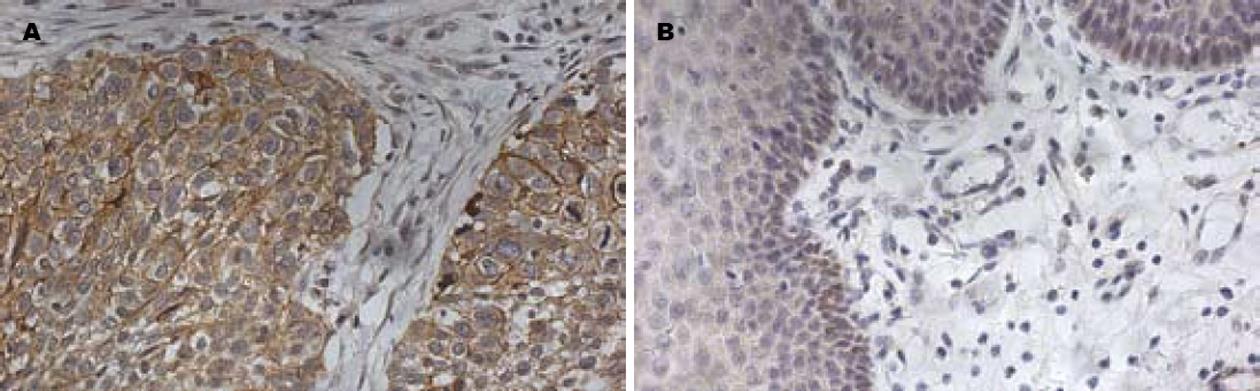
1.2.2 免疫组织化学结果判断标准: (1)阳性结果判断: 经DAB染色后胞膜和/或细胞质呈棕黄色颗粒沉着. 每例标本选5个高倍视野, 根据染色程度和染色细胞百分比进行评分. (2)染色程度: 基本不着色为0级; 着色呈淡黄色为1级; 着色呈黄色为2级; 着色呈棕褐色为3级. (3)染色阳性细胞百分比: 着色阳性细胞占计数细胞<5%为0级; 6%-25%为1级; 26%-50%为2级; 超过51%为3级. 将胞质染色程度分级与染色细胞百分比相乘, 乘积大于4者为阳性表达, 0-3者为阴性表达.
1.2.3 Western blot法检测: 提取组织蛋白, 蛋白定量, 绘制标准蛋白曲线, SDS-PAGE电泳, 每个孔中加入总蛋白量40 μg, 恒流, 电流30 mA, 待示踪剂通过浓缩胶后, 改用40 mA, 电泳结束后, 转膜, 恒压100 V, 根据目的蛋白的分子质量大小设定转膜时间. 封闭, 转移后的PVDF膜置于含50 g/L脱脂奶粉的TBST封闭液中, 室温作用1 h. 将膜置于用封闭液稀释的一抗: 鸡抗人TMEM16A多克隆抗体(购自Abcam公司, 稀释浓度1∶500)中, 4℃过夜. 第二天用TBST洗涤3次, 每次5 min. 将膜置于用含50 g/L脱脂奶粉的TBST封闭液稀释的DSE-0310辣根过氧化物酶标记兔抗鸡IgG(购自北京博尔森, 稀释浓度1∶5000)二抗中, 37℃轻摇1 h. TBST洗涤3次, 每次5 min. 显色, 化学法发光法显色, 以Tublin-a(稀释浓度为1∶5000)为内参照, 观察结果.
统计学处理 率的比较用χ2检验, 相关性检验用非参数Spearman相关处理, 以P<0.05为差异有统计学意义. 数据应用SPSS10.0进行统计, 结果以mean±SD表示, 两均数比较采用t检验.
TMEM16A蛋白阳性表达呈棕黄色颗粒样物质, 在细胞膜和或细胞质中见表达(图1A). 蛋白在食管鳞癌组织和癌旁组织中的阳性表达率分别为52.50%(21/40), 20.00%(8/40). 食管鳞癌癌旁组织的阴性表达见图1B.
从表1可以看出, 不同分化程度高分化、中分化、低分化的食管鳞状细胞癌中, TMEM16A的阳性表达率分别为27.27%、43.75%和84.62%, 三者比较差异有显著性(P<0.05), 随着分化程度的降低, TMEM16A的阳性表达率升高; 有无淋巴结转移食管鳞状细胞癌中, TMEM16A的阳性表达率分别为65.38%和21.43%, 两者比较差异有显著性(P<0.05), 有淋巴结转移的食管鳞状细胞癌组织中TMEM16A的阳性表达率高; 不同TNM分期Ⅱ期、Ⅲ期与Ⅳ期的食管鳞状细胞癌中, TMEM16A的阳性表达率分别为46.15%、54.17%和66.67%, 3者比较差异无统计学意义(P>0.05).
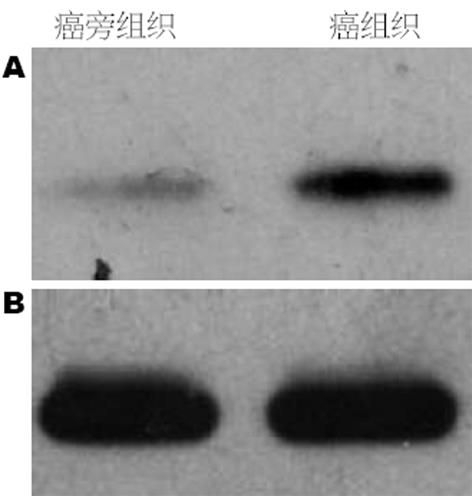
Western blot检测结果显示: 在20例食管癌蛋白及相应癌旁组织蛋白中, 均见TMEM16A蛋白的表达, 其相对分子质量为114 kDa, 但TMEM16A在癌组织的表达明显高于癌旁组织, 如图2A(前个条带为癌旁组织的表达, 后个条带为癌组织的表达). 而作为内参照的Tublin的表达如图2B, 相对分子质量为: 55 kDa. 经吸光度测定, 癌旁组织组吸光度值显著低于癌组织组(0.57±0.17 vs 0.96±0.15, t = 42.16, P<0.05).
TMEM16A基因,又名TAOS2[4], DOG1[5], FLJ10261或ORAOV2[6], 是TMEM家族的一员[7], 位于人11号染色体长臂1区3带的CCND1-EMS1基因座内, 编码与C12orf3、C11orf25及FLJ34272基因产物同源的8-跨膜蛋白[8], 所编码的蛋白功能尚未可知, 在食管癌、膀胱癌和乳腺癌中均有表达. TMEM16A与鼠TMEM16A基因有89.8%的同源性[9], 11号染色体长臂1区3带的基因是人类基因组中最常被扩增的基因之一. Zheng et al[10]报道TMEM16A基因可能是离子转运蛋白家族的成员. West et al[11]研究发现TMEM16A在胃肠间质瘤的细胞表面有特异性高表达, 而在其他的软组织瘤中较少表达, 推测TMEM16A可作为诊断和治疗胃肠间质瘤的指标[12].
自TMEM16A基因发现以来, 引起了人们的广泛重视, 取得了一些进展, 但TMEM16A基因的表达调控机制、生物学功能和在肿瘤发生发展中的机制等仍不明确, 这些都有待于进一步研究和探讨. 随着对TMEM16A基因研究的不断深入, TMEM16A基因有望为食管癌的分子诊断、基因治疗和预后评估提供新的分子靶点.
本研究也表明, TMEM16A在食管鳞癌组织中的表达明显高于癌旁组织, TMEM16A在低分化患者的表达明显高于中分化及高分化者, 推测TMEM16A蛋白可能是促进食管鳞癌发生的一个重要因素; 同时还发现, TMEM16A的表达与食管癌患者淋巴结转移有密切相关, 伴有淋巴结转移的食管鳞癌患者的癌组织中表达明显高于无淋巴结转移者, 提示TMEM16A可能参与食管癌的淋巴结转移, 为临床过程中判断患者病情预后提供一个重要的参考; 但是, 在我们的研究中发现, TMEM16A在食管鳞癌组织中的表达和患者的临床TNM分期无明显相关性, 分析原因可能是病例选择数较少有关, 或者是TMEM16A蛋白表达对食管癌血管侵袭无明显影响, 还有待于进一步的临床、基础研究. 由此研究可以推测TMEM16A可能对食管癌的诊断、治疗以及预后有一定的意义.
食管鳞状细胞癌的发生与发展是一个多基因变异累计的复杂过程[13], 涉及多种肿瘤抑制基因失活、癌基因激活和凋亡相关基因变化, 并且其转移的出现对肿瘤的治疗是最棘手的问题之一. 肿瘤的侵袭转移是一个极其复杂的多基因调控和多步骤发展过程, 涉及一系列肿瘤侵袭转移相关基因的结构或功能的异常, 一些基因被激活, 一些基因受抑制, 而另一些基因则表现为缺失或功能失活或者相互拮抗, 从而影响抗侵袭转移功能的正常发挥. 我们的研究为临床取材研究, 是食管癌术后标本的基因蛋白水平检测, 无法完成与正常食管上皮细胞中表达的比较研究, 进一步研究我们会在动物实验中完成.
在食管癌发生的早期, 有许多基因在其结构、表达及生物学功能方面发生了改变, 因此导致了细胞周期及细胞凋亡过程的异常, 如Survivin、Fas、FasL、MMP-7等. 目前, TMEM16A基因在食管鳞癌研究中的报道较少. 本研究选取TMEM16A作为目标基因, 应用免疫组织化学及Western blot的方法在组织水平进一步研究, 检测其与食管癌发生、发展、分化、转移等的相关性, 以便寻找与食管鳞癌相关的新的分子标志物.
吕宾, 教授, 浙江中医学院附属医院(浙江省中医院、浙江省东方医院)消化科.
食管鳞状细胞癌的发生与发展是一个多基因变异累计的复杂过程, 涉及多种肿瘤抑制基因失活、癌基因激活和凋亡相关基因变化, 并且其转移的出现对肿瘤的治疗是最棘手的问题之一.
Zheng et al报道TMEM16A基因可能是离子转运蛋白家族的成员. West et al研究发现TMEM16A在胃肠间质瘤的细胞表面有特异性高表达, 而在其他的软组织瘤中较少表达, 推测TMEM16A可作为诊断和治疗胃肠间质瘤的指标.
随着对TMEM16A基因研究的不断深入, TMEM16A基因有望为食管癌的分子诊断、基因治疗和预后评估提供新的分子靶点.
本研究设计基本合理, 方法得当, 具有一定的学术价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Zhang H, Chen SH, Li YM. Epidemiological investigation of esophageal carcinoma. World J Gastroenterol. 2004;10:1834-1835. [PubMed] |
| 2. | Kim YT, Zhao M. Aberrant cell cycle regulation in cervical carcinoma. Yonsei Med J. 2005;46:597-613. [PubMed] |
| 3. | Carneiro A, Isinger A, Karlsson A, Johansson J, Jönsson G, Bendahl PO, Falkenback D, Halvarsson B, Nilbert M. Prognostic impact of array-based genomic profiles in esophageal squamous cell cancer. BMC Cancer. 2008;8:98. [PubMed] [DOI] |
| 4. | Huang X, Godfrey TE, Gooding WE, McCarty KS Jr, Gollin SM. Comprehensive genome and transcriptome analysis of the 11q13 amplicon in human oral cancer and synteny to the 7F5 amplicon in murine oral carcinoma. Genes Chromosomes Cancer. 2006;45:1058-1069. [PubMed] [DOI] |
| 5. | Espinosa I, Lee CH, Kim MK, Rouse BT, Subramanian S, Montgomery K, Varma S, Corless CL, Heinrich MC, Smith KS. A novel monoclonal antibody against DOG1 is a sensitive and specific marker for gastrointestinal stromal tumors. Am J Surg Pathol. 2008;32:210-218. [PubMed] [DOI] |
| 6. | Katoh M, Katoh M. Identification and characterization of TMEM16E and TMEM16F genes in silico. Int J Oncol. 2004;24:1345-1349. [PubMed] |
| 7. | Katoh M, Katoh M. GDD1 is identical to TMEM16E, a member of the TMEM16 family. Am J Hum Genet. 2004;75:927-928; author reply 928-929. [PubMed] [DOI] |
| 8. | Katoh M, Katoh M. FLJ10261 gene, located within the CCND1-EMS1 locus on human chromosome 11q13, encodes the eight-transmembrane protein homologous to C12orf3, C11orf25 and FLJ34272 gene products. Int J Oncol. 2003;22:1375-1381. [PubMed] |
| 9. | Rock JR, Futtner CR, Harfe BD. The transmembrane protein TMEM16A is required for normal development of the murine trachea. Dev Biol. 2008;321:141-149. [PubMed] [DOI] |
| 10. | Zheng HC, Wang MC, Li JY, Yang XF, Sun JM, Xin Y. Expression of maspin and kai1 and their clinicopathological significance in carcinogenesis and progression of gastric cancer. Chin Med Sci J. 2004;19:193-198. [PubMed] [DOI] |
| 11. | West RB, Corless CL, Chen X, Rubin BP, Subramanian S, Montgomery K, Zhu S, Ball CA, Nielsen TO, Patel R. The novel marker, DOG1, is expressed ubiquitously in gastrointestinal stromal tumors irrespective of KIT or PDGFRA mutation status. Am J Pathol. 2004;165:107-113. [PubMed] |
| 12. | Sartor M, Steingrimsdottir H, Elamin F, Gäken J, Warnakulasuriya S, Partridge M, Thakker N, Johnson NW, Tavassoli M. Role of p16/MTS1, cyclin D1 and RB in primary oral cancer and oral cancer cell lines. Br J Cancer. 1999;80:79-86. [PubMed] [DOI] |
| 13. | Liggett WH Jr, Sidransky D. Role of the p16 tumor suppressor gene in cancer. J Clin Oncol. 1998;16:1197-1206. [PubMed] |