修回日期: 2009-04-12
接受日期: 2009-04-20
在线出版日期: 2009-05-28
目的: 研究端粒酶逆转录酶(telomerase reverse transcriptase, TERT)和P53在大鼠肝癌发生过程的动态变化.
方法: 二乙基亚硝胺诱导大鼠肝细胞癌(hepatocellular carcinoma, HCC)的发生; 免疫荧光方法检测TERT的表达变化; Western blot方法检测P53的表达; TRAP(telomeric repeat amplication protocol)方法检测端粒酶活性.
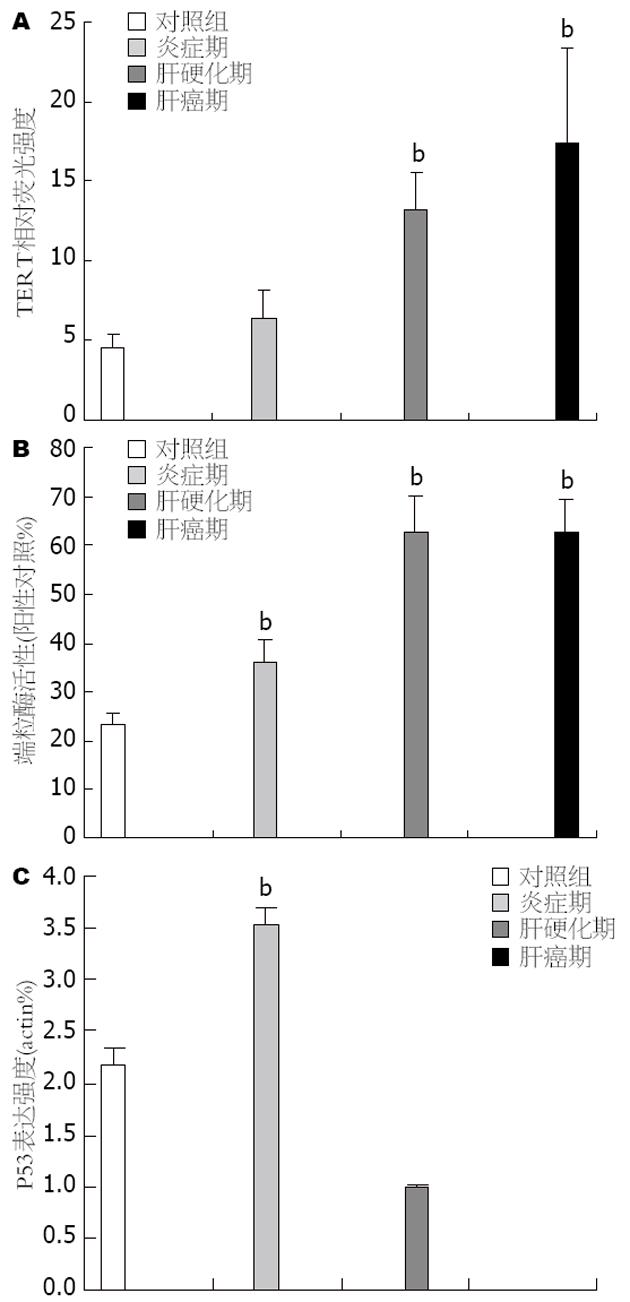
结果: 端粒酶与TERT在诱癌过程中呈逐渐升高的趋势, 而P53在诱癌早期表达迅速升高后在诱癌后期表达急剧下降. 定量分析表明炎症期P53的表达显著高于正常组织(3.53%±0.17% vs 2.19%±0.15%, P = 0.00), 而在肝硬化期P53的表达量仅为0.98%±0.05%, 至肝癌病变中几乎检测不到. 与P53的表达变化趋势不同, 端粒酶与TERT在炎症期有小幅升高, 分别为34.47%±6.21%和6.43%±1.14%. 肝硬化阶段端粒酶与TERT的表达迅速升高, 至肝癌阶段达到高峰. 统计学分析显示端粒酶与TERT的表达呈正相关(r = 0.954, P = 0.046), 与P53的表达无相关性.
结论: 诱癌过程中逐渐升高的端粒酶活性和TERT的表达与P53的失活共同促进了肿瘤的发生, 且三者均与肝癌的发生发展相一致可作为肝癌诊治的指标.
引文著录: 陈颖, 孔庆忠. 端粒酶逆转录酶和P53在大鼠肝癌发生中的动态变化. 世界华人消化杂志 2009; 17(15): 1493-1497
Revised: April 12, 2009
Accepted: April 20, 2009
Published online: May 28, 2009
AIM: To explore the expression of telomerase reverse transcriptase (TERT) and P53 in the development of rat hepatocellular carcinoma (HCC).
METHODS: A HCC model was induced by diethyl nitrosoamine (DENA); telomerase activity was assayed using telomeric repeat amplication protocol (TRAP) method, whereas the expression of TERT and P53 was determined using immunofluorescence and Western blot, respectively.
RESULTS: Compared with low expression level of TERT and telomerase activity, which were detected and maintained at a relative stable level in normal tissue and inflammatory lesion, the over-expression of telomerase and TERT were detected in hepatocirrhosis and HCC stage. However, the expression of P53 was significantly increased in inflammatory stage, and dramatically decreased in hepatocirrhosis stage, even undetectable in HCC stage. When quantified, in inflammation stage, the P53 expression level showed significant difference compared with control group (3.53% ± 0.17% vs 2.19% ± 0.15%, P = 0.00), whereas in hepatocirrhosis stage, the expression level of P53 was only 0.98% ± 0.05%. Contrary to the trend of P53 expression, the expression of telomerase, and TERT were very low in inflammation stage, which were 34.47% ± 6.21% and 6.43% ± 1.14%, respectively. But in hepatocirrhosis, telomerase activity, and TERT protein expression levels showed significant difference compared with control group and tended to culminate in HCC. Statistically analysis showed that telomerase was correlated with TERT (r = 0.954, P = 0.046). As for P53, no relationship was found between P53 and telomerase and TERT.
CONCLUSION: Accelerated telomerase, and TERT expression with P53 inactivation might synergistically contribute to carcinogenesis and be consistent with the progression of HCC, therefore the three factors may be useful tools in diagnosis and prognosis of HCC.
- Citation: Chen Y, Kong QZ. Dynamic changes of telomerase reverse transcriptase and P53 in the development of rat hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2009; 17(15): 1493-1497
- URL: https://www.wjgnet.com/1009-3079/full/v17/i15/1493.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i15.1493
癌细胞通过端粒酶活性的升高来维持端粒长度的相对稳定, 借此为其生长提供选择优势. 大量的研究证实肿瘤细胞中端粒酶逆转录酶(telomerase reverse transcriptase, TERT)的过表达可引起细胞的永生化[1-2]. 因而TERT通常被作为调控端粒酶活性的限速步骤而参与肿瘤的发生. P53是一种肿瘤抑制蛋白, 在监测DNA损伤或基因组异常的过程中起关键作用. 其激活可以导致细胞周期阻滞, DNA修复或细胞凋亡, 同时P53还是TERT的负调控子[3-5]. 为验证TERT与P53在肿瘤发生中的作用, 本研究对二者在肝细胞癌发生过程中的动态表达变化进行了初步探索.
♂SD大鼠, 月龄3 mo, 平均体质量为120±5 g, 购于河南郑州大学实验动物中心, 在温度22±3℃, 湿度40%-70%, 间隔12 h光照的条件下饲养. 二乙基亚硝胺、PI购于Sigma公司; TERT、p53、actin抗体及化学发光试剂盒购于Santa Cruz; FITC-IgM、碱磷酶-IgM购于北京中杉金桥.
1.2.1 分组及取材: 大鼠适应环境1 wk后, 随机分为对照组(n = 42)和造模组(n = 42). 根据Solt-Farber方法, 以2 g/L的二乙基亚硝胺(diethyl nitrosoamine, DENA)制备肝癌模型, 15 wk后停药. 根据大鼠肝癌的诊断标准由两位病理医生进行病理分型[6]. 造模组的病变可大致分为3阶段: 炎症期(12 wk之前)、肝硬化期(15 wk)和肝癌期(18-21 wk). 分别在给药后3、6、9、12、15、18、21 wk随机处死对照组及造模组中的6只大鼠. 取少量新鲜肝组织置于40 g/L的多聚甲醛, 4℃固定过夜后行石蜡包埋和HE染色. 其余组织迅速放入液氮中冷冻, 随后置-80℃保存.
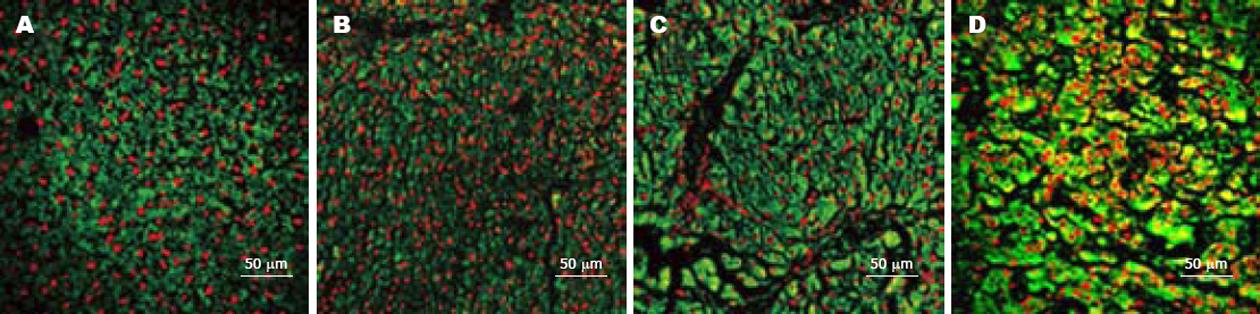
1.2.2 免疫荧光方法检测TERT蛋白表达: 组织切片置柠檬酸抗原修复液修复, 200 g/L山羊血清封闭后, 加抗TERT抗体(sc-7212, Santa Cruz)(1∶600)4℃孵育过夜. FITC标记的二抗(ZF-0311, 北京中杉)(1∶400)25℃孵育40 min, 20 mg/L PI(Sigma Aldrich Chemical Co., St. Louis, MO)室温标记细胞核后封片, 激光共聚焦显微镜检测并对TERT蛋白的表达强度进行相对荧光强度分析[7-8]. 相对荧光强度 = 荧光强度×面积/细胞总数. 每组实验重复3次.
1.2.3 P53蛋白表达的检测: 细胞总蛋白75 µg在60 g/L SDS-PAGE中恒压电泳后转移至硝酸纤维素膜上并用50 g/L的脱脂奶粉封闭. 加入P53(sc-6243)(1∶50)和actin(sc-1616)(1∶1000)一抗4℃孵育过夜. ECL(sc-2048)化学发光检测试剂盒进行显色. Labworks 4.0软件(UVP, Inc. USA)定量分析表达强度. Actin作为内对照. 每组实验重复3次.
1.2.4 端粒酶活性的检测: 用Telo TAGGG Telomerase PCR ELISA试剂盒以端粒重复序列扩增法(telomeric repeat amplification protocol, TRAP)方法检测端粒酶活性. 操作步骤按说明书. 端粒酶相对活性 = (样本A450nm-A690nm/阳性对照A450nm-A690nm)×100. 每组实验重复3次.
统计学处理 实验数据均用mean±SD表示, SPSS11.0软件对实验数据进行方差分析(ANOVA), P<0.05有显著性差异, P<0.01有极显著差异.
免疫荧光结果显示TERT在整个诱癌时期的表达呈逐渐升高的趋势(图1). 对照组有少量TERT表达. 造模组在炎症期即表达升高, 在随后的肝硬化及肝癌期表达量激增. 定量分析显示炎症期TERT蛋白表达强度为6.43±1.14, 与对照组(4.48±0.09)相比未有显著性差异. 而至肝硬变和肝癌期其表达量分别为13.47±0.66和18.36±4.36, 是对照组的3.00-4.10倍, 有极显著性差异(P = 0.000, 图2A).
对照组端粒酶活性较低为22.90%±2.33%. 造模组的炎症期端粒酶活性为34.47%±6.21%(P = 0.007). 随着病变的进展, 端粒酶相对活性在肝硬化期急增至62.90%±2.65%(P = 0.000), 并在其后的癌症发生过程中持续保持这一高水平(64.27%±3.30%)(P = 0.000, 图2B).
Western blot检测结果显示P53在肝癌发生过程中呈先上升后下降的趋势(图3). 对照组有少量表达的P53. 造模组在炎症早期P53表达骤增, 随后在炎症后期和肝硬化期表达量将至正常以下. 至肝癌阶段几乎检测不出. 定量分析表明正常组织P53的表达量为2.19%±0.15%. 而在炎症期为3.53%±0.17%, 是正常表达量的1.61倍, 有显著性差异(P = 0.00). 随诱癌时间的延长, 肝硬化期P53的表达量进一步减少至0.98%±0.05%, 是正常组织的0.45倍. 而在肝癌期几乎检测不到P53的表达(图2C).
统计学分析显示TERT与端粒酶呈正相关(r = 0.954, P = 0.046), 而二者与P53均无相关性.
肿瘤的发生是一多因素相互作用的极其复杂的过程. 端粒酶在肿瘤发生中具有双重作用, 其不仅可促进肿瘤的发生, 还可作为肿瘤抑制子抑制肿瘤的发生. 正常体细胞中端粒酶活性受到严格的调控, 而80%以上的肿瘤细胞中端粒酶活性显著升高, 且研究发现其催化亚基TERT的过表达可引起细胞的永生化[9]. P53是一肿瘤抑制因子, 正常细胞端粒长度的程序性缩短及由此产生的端粒功能丧失可激活依赖P53的信号通路, 同时P53又可抑制端粒酶活性[5,10]. 故本研究对TERT和P53蛋白在肝细胞肝癌发生的动态变化进行了初步探索.
研究结果表明, 端粒酶活性随肝癌的发生、发展逐步升高. 正常肝组织和炎症期组织中端粒酶活性较低, 至肝硬化和肝癌期端粒酶活性急剧升高. 癌变过程中TERT蛋白的表达变化与端粒酶活性升高的趋势基本一致, 并呈正相关(r = 0.954, P = 0.046). 提示TERT可调节端粒酶活性且肿瘤细胞中端粒酶活性越高, 细胞的恶性程度也越高[11-13]. 由于端粒酶的低水平表达不仅可延长肝细胞的寿命, 还可增强其对DNA损伤的耐受性及抑制细胞凋亡, 推测在对照组及造模组炎症期中TERT和端粒酶的这种表达方式对维持肝脏的正常功能起着积极的作用[14]. 随着诱癌的进程, 端粒酶及其组分的高水平表达促进病变由炎症期向肝硬化阶段的演进, 并最终引起细胞不受调控的生长及癌症的发生. 肝硬化阶段端粒酶和TERT的表达激增提示二者的表达变化是诱癌早期事件, 因而可将异常表达的TERT和端粒酶活性作为肿瘤诊治的早期指标, 选择性抑制端粒酶和TERT的过表达极有可能成为肿瘤治疗的又一可行方法[15-16].
肿瘤抑制因子P53在保护基因组的稳定性方面起着重要的作用, 约60%的肿瘤细胞中可检测到P53的失活. 本研究发现正常肝细胞P53的表达量较低, 炎症期P53表达升高. 而肝硬化期P53的表达量却急剧下降, 至肝癌期几乎检测不到. 炎症期P53的表达上调可保护细胞避免死亡并可有效剔除端粒酶受损细胞, 借此维持正常肝细胞的数量和功能[17-19]. 在肝硬化及肝癌期P53的表达失活不仅使其丧失了抑制肿瘤发生的功能, 同时还可激活某些原癌基因, 从而共同促进肿瘤的发生, 如P53的缺失可转录激活c-Myc和TERT[20-22].
P53对端粒酶的调控可分为两类: (1)通过对端粒酶全酶的亚细胞定位的直接调控; (2)通过细胞周期的间接调控. 由于P53是TERT表达的负调控子, 因而P53对端粒酶活性的直接调控是通过P53与TERT启动子结合后抑制TERT的表达实现的. 研究表明P53在其表达升高后的数小时内就可抑制TERT的表达, 而且这种对TERT的抑制作用不依赖于细胞周期的阻滞和凋亡. 因端粒酶活性随细胞周期的变化而变化, 其在G1/S期逐渐增加, S期达到高峰, G2/M期几乎不表达[23], 所以P53又可通过调节Cyclin D1和Cyclin E的表达间接调控端粒酶的活性[24]. 考虑到端粒酶和TERT在整个诱癌时期的变化, P53可能对二者的调控可能是一非常复杂的过程. 本研究发现炎症期P53表达的升高不仅没有表现出TERT及端粒酶的活性的显著降低, 相反, TERT及端粒酶活性较对照组的表达还略有上升. 由于TERT的少量增加可对抗P53引起的凋亡, 提示P53对TERT的抑制可能需要在一定的阈值范围内实现, 并且在P53升高的遗传背景下TERT的表达升高可能起到延缓细胞衰老和延长细胞寿命的作用[5,25]. 至肝硬化及肝癌时, P53的缺失使其失去了对端粒酶及TERT表达的抑制作用, 因而促进了二者活性的激增, 最终导致细胞向癌变方向发展. 尽管我们的研究结果显示P53与端粒酶和TERT在肿瘤发生中不存在相关性, 但三者在诱癌过程中的表达变化提示P53的失活可能是肿瘤发生过程中端粒酶活性升高和TERT过表达所必需的. 随着端粒持续丢失、基因组不稳定性增加, 在P53缺失的细胞中端粒酶活性的增加有助于恢复细胞端粒的功能, 并为细胞提供选择生长优势.
总之, P53与TERT和端粒酶之间不仅是负调控的关系, 很可能是一种相互拮抗的动态变化过程. 而这种复杂的相互关系反映了一种动静态平衡在癌症发生中的双重作用. 这种平衡的维持对细胞是一种保护作用, 一旦被打破, 就可能促使细胞向癌变的方向发展. 同时提示三者可作为肿瘤诊治的候选指标.
目前普遍认为肿瘤的发生与基因组不稳定密切相关, 而与基因组不稳定有关的耐药性的产生又是肿瘤治疗失败的主要原因. 在众多可能引起基因组不稳定的相关因素中, 端粒酶起着重要的作用. 阐明端粒酶在肿瘤发生中的动态变化及作用不仅对理解肿瘤发生机制具有重要的理论指导意义, 而且在有效防治肿瘤方面还具有广阔的应用前景.
高润平, 教授, 吉林大学第一医院肝病科.
端粒酶和P53在肿瘤发生中的作用是肿瘤研究领域的一大热点. 探寻二者在肿瘤发生的相互作用对肿瘤的防治都将具有重要的意义.
本研究首次运用大鼠肝癌模型对端粒酶逆转录酶、端粒酶及P53的表达变化进行了研究, 并对三者的相关性进行了初步探索.
本研究初步揭示端粒酶逆转录酶、端粒酶及P53在肝癌发生过程中的动态变化及相关性. 这为下一步以三者为靶点的分子治疗奠定了基础, 并对肝癌的诊断、治疗及预后有着积极指导作用.
本研究设计较为合理, 研究内容比较新颖, 实验方法比较科学, 对肿瘤发病机制的研究有一定的意义.
编辑: 李军亮 电编:何基才
| 1. | Vaziri H, Benchimol S. Reconstitution of telomerase activity in normal human cells leads to elongation of telomeres and extended replicative life span. Curr Biol. 1998;8:279-282. [PubMed] [DOI] |
| 2. | Bodnar AG, Ouellette M, Frolkis M, Holt SE, Chiu CP, Morin GB, Harley CB, Shay JW, Lichtsteiner S, Wright WE. Extension of life-span by introduction of telomerase into normal human cells. Science. 1998;279:349-352. [PubMed] [DOI] |
| 3. | Kan Q, Jinno S, Yamamoto H, Okayama H. Chemical DNA damage activates p21 WAF1/CIP1-dependent intra-S checkpoint. FEBS Lett. 2007;581:5879-5884. [PubMed] [DOI] |
| 4. | Vaziri H, Benchimol S. From telomere loss to p53 induction and activation of a DNA-damage pathway at senescence: the telomere loss/DNA damage model of cell aging. Exp Gerontol. 1996;31:295-301. [PubMed] [DOI] |
| 5. | Kanaya T, Kyo S, Hamada K, Takakura M, Kitagawa Y, Harada H, Inoue M. Adenoviral expression of p53 represses telomerase activity through down-regulation of human telomerase reverse transcriptase transcription. Clin Cancer Res. 2000;6:1239-1247. [PubMed] |
| 6. | Squire RA, Levitt MH. Report of a workshop on classification of specific hepatocellular lesions in rats. Cancer Res. 1975;35:3214-3223. [PubMed] |
| 7. | Dinser R, Kreppel F, Zaucke F, Blank C, Paulsson M, Kochanek S, Maurer P. Comparison of long-term transgene expression after non-viral and adenoviral gene transfer into primary articular chondrocytes. Histochem Cell Biol. 2001;116:69-77. [PubMed] |
| 8. | Lau WK, Yeung CW, Lui PW, Cheung LH, Poon NT, Yung KK. Different trends in modulation of NMDAR1 and NMDAR2B gene expression in cultured cortical and hippocampal neurons after lead exposure. Brain Res. 2002;932:10-24. [PubMed] [DOI] |
| 9. | Shay JW, Bacchetti S. A survey of telomerase activity in human cancer. Eur J Cancer. 1997;33:787-791. [PubMed] [DOI] |
| 10. | Lee CM, Hsu CY, Eng HL, Huang WS, Lu SN, Changchien CS, Chen CL, Cho CL. Telomerase activity and telomerase catalytic subunit in hepatocellular carcinoma. Hepatogastroenterology. 2004;51:796-800. [PubMed] |
| 11. | Oh BK, Kim H, Park YN, Yoo JE, Choi J, Kim KS, Lee JJ, Park C. High telomerase activity and long telomeres in advanced hepatocellular carcinomas with poor prognosis. Lab Invest. 2008;88:144-152. [PubMed] [DOI] |
| 12. | Henderson YC, Breau RL, Liu TJ, Clayman GL. Telomerase activity in head and neck tumors after introduction of wild-type p53, p21, p16, and E2F-1 genes by means of recombinant adenovirus. Head Neck. 2000;22:347-354. [PubMed] [DOI] |
| 13. | Shimojima M, Komine F, Hisatomi H, Shimizu T, Moriyama M, Arakawa Y. Detection of telomerase activity, telomerase RNA component, and telomerase reverse transcriptase in human hepatocellular carcinoma. Hepatol Res. 2004;29:31-38. [PubMed] [DOI] |
| 14. | Masutomi K, Yu EY, Khurts S, Ben-Porath I, Currier JL, Metz GB, Brooks MW, Kaneko S, Murakami S, DeCaprio JA. Telomerase maintains telomere structure in normal human cells. Cell. 2003;114:241-253. [PubMed] [DOI] |
| 15. | Kyo S, Takakura M, Fujiwara T, Inoue M. Understanding and exploiting hTERT promoter regulation for diagnosis and treatment of human cancers. Cancer Sci. 2008;99:1528-1538. [PubMed] [DOI] |
| 16. | Parkinson EK, Minty F. Anticancer therapy targeting telomeres and telomerase : current status. BioDrugs. 2007;21:375-385. [PubMed] [DOI] |
| 17. | Anderson CW. DNA damage and the DNA-activated protein kinase. Trends Biochem Sci. 1993;18:433-437. [PubMed] [DOI] |
| 18. | Garner E, Raj K. Protective mechanisms of p53-p21-pRb proteins against DNA damage-induced cell death. Cell Cycle. 2008;7:277-282. [PubMed] |
| 19. | García-Cao I, García-Cao M, Tomás-Loba A, Martín-Caballero J, Flores JM, Klatt P, Blasco MA, Serrano M. Increased p53 activity does not accelerate telomere-driven ageing. EMBO Rep. 2006;7:546-552. [PubMed] |
| 20. | Sigal A, Rotter V. Oncogenic mutations of the p53 tumor suppressor: the demons of the guardian of the genome. Cancer Res. 2000;60:6788-6793. [PubMed] |
| 21. | Frazier MW, He X, Wang J, Gu Z, Cleveland JL, Zambetti GP. Activation of c-myc gene expression by tumor-derived p53 mutants requires a discrete C-terminal domain. Mol Cell Biol. 1998;18:3735-3743. [PubMed] |
| 22. | Xu D, Wang Q, Gruber A, Björkholm M, Chen Z, Zaid A, Selivanova G, Peterson C, Wiman KG, Pisa P. Downregulation of telomerase reverse transcriptase mRNA expression by wild type p53 in human tumor cells. Oncogene. 2000;19:5123-5133. [PubMed] [DOI] |
| 23. | Zhu X, Kumar R, Mandal M, Sharma N, Sharma HW, Dhingra U, Sokoloski JA, Hsiao R, Narayanan R. Cell cycle-dependent modulation of telomerase activity in tumor cells. Proc Natl Acad Sci U S A. 1996;93:6091-6095. [PubMed] [DOI] |
| 24. | Landberg G, Nielsen NH, Nilsson P, Emdin SO, Cajander J, Roos G. Telomerase activity is associated with cell cycle deregulation in human breast cancer. Cancer Res. 1997;57:549-554. |