修回日期: 2009-03-18
接受日期: 2009-03-23
在线出版日期: 2009-05-18
目的: 分析胃癌前病变中端粒酶RNA(hTR)、端粒酶逆转录酶(Htert)、c-Myc、增殖细胞核抗原(PCNA)的表达及相互关系, 并探讨H pylori感染致胃癌前病变的可能机制.
方法: 33例胃癌前病变中H pylori阳性19例, H pylori阴性14例. 采用原位杂交法检测胃黏膜活检标本中hTR表达; 免疫组织化学SP法检测hTERT、c-Myc、PCNA表达; TUNEL法检测细胞凋亡.
结果: H pylori阳性胃癌前病变组hTR、hTERT、c-Myc阳性率均显著高于H pylori阴性胃癌前病变组(63.2% vs 28.6%, 68.4% vs 21.4%, 47.4% vs 7.1%, 均P<0.01); 增殖指数及凋亡指数在H pylori阳性组分别为17.5±5.4、17.7±3.9, H pylori阴性组分别为8.3±3.6、9.2±5.2, 两组相比均有显著性差异(P<0.01). 胃癌前病变中hTERT与hTR、hTERT与c-Myc表达均呈显著正相关性(rs = 0.45, 0.54, 均P<0.01).
结论: H pylori感染可诱导胃癌前病变中端粒酶相关基因及c-Myc过度表达, 促进细胞增殖与凋亡,引起胃黏膜上皮细胞动力学紊乱
引文著录: 祝荫, 吕农华, 陈江, 谢勇, 黄德强. H pylori感染在胃癌前病变中对端粒酶相关基因及细胞增殖与凋亡的影响. 世界华人消化杂志 2009; 17(14): 1448-1453
Revised: March 18, 2009
Accepted: March 23, 2009
Published online: May 18, 2009
AIM: To analyze expression of human telomerase RNA (hTR), human telomerase reverse transcriptase (hTERT), c-Myc and proliferating cell nuclear antigen (PCNA) and their relationship, and to explore the mechanism of H pylori in gastric precancerous lesions.
METHODS: Thirty three cases of gastric precancerous lesions including 19 H pylori-positive cases and 14 H pylori-negative cases were included in the study. hTR was determined using in situ RNA hybridization; hTERT, c-Myc and PCNA were detected using streptavidin-peroxidase immunohistochemical method; apoptosis was detected using terminal deoxynucleotidyl transferase-mediated dUTP nick end labeling.
RESULTS: The expression of hTR, hTERT and c-Myc were 63.2%, 68.4% and 47.4% in H pylori-positive group and 28.6%, 21.4% and 7.1% in H pylori-negative group (P < 0.01); the proliferation index (PI) and apoptotic index (AI) were significant higher in H pylori-positive group than in H pylori-negative group (17.5 ± 5.4 vs 8.3 ± 3.6, 17.7 ± 3.9 vs 9.2 ± 5.2, P < 0.01). There were significant correlations between hTERT and hTR (rs = 0.45, P < 0.01), hTERT and c-Myc protein (rs = 0.54, P < 0.01) in gastric precancerous lesions.
CONCLUSION: H pylori infection induces the over-expression of telomerase-associated genes, c-Myc and prompts cell proliferation and apoptosis in gastric precancerous lesions.
- Citation: Zhu Y, Lv NH, Chen J, Xie Y, Huang DQ. Effect of Helicobacter pylori infection on telomerase-associated genes, cell proliferation and apoptosis in gastric precancerous lesion. Shijie Huaren Xiaohua Zazhi 2009; 17(14): 1448-1453
- URL: https://www.wjgnet.com/1009-3079/full/v17/i14/1448.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i14.1448
目前多数学者认为肠型胃癌的发生遵循从慢性浅表性胃炎→慢性萎缩性胃炎→肠上皮化生→异型增生→胃癌这一过程, 幽门螺杆菌(H pylori)感染作用于这个过程的起始阶段, 其可促进慢性萎缩性胃炎(chronic atrophic gastritis, CAG)、肠上皮化生(intestinal metaplasia, IM)、异型增生(dysplasia)的形成, 但H pylori感染致病的确切机制尚不明确[1-2]. 端粒酶激活是恶性肿瘤细胞无限增殖的重要分子基础, 端粒酶RNA(human telomerase RNA, hTR)、端粒酶催化亚单位(human telomerase catalytic subunit, hTERT)是端粒酶的两个重要组分, hTR是端粒酶延长端粒的模板, hTERT又名端粒酶逆转录酶(human telomerase reverase transcriptase), 是端粒酶活性的必需和限速成分, 其表达水平与组织细胞中端粒酶活性水平一致[3-4]. 研究表明, H pylori感染与端粒酶活性具有相关性, 人们推测H pylori感染可能是端粒酶激活的一个启动因子. 除了端粒酶激活, 细胞增殖与凋亡失衡是肿瘤发生的重要病理学基础. 为了探讨胃癌前病变中H pylori感染对端粒酶相关基因、细胞增殖与凋亡的影响, 本研究采用RNA原位核酸杂交和免疫组织化学法检测H pylori阳性和阴性胃癌前病变中hTR、hTERT、c-Myc蛋白及增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)的表达, 脱氧核糖核酸末端转移酶介导的缺口末端标记(TUNEL)法检测细胞凋亡, 并分析各指标相关性, 旨在探讨H pylori感染致胃黏膜癌变可能机制.
所有研究对象均因上消化系症状在我院接受胃镜检查, 并经病理证实为胃癌前病变患者, 共33例, 男25例, 女8例, 年龄27-70岁. 胃镜检查时胃窦幽门前2-3 cm处取胃黏膜2-3块做快速尿素酶试验及改良Gimesa染色, 两项均为阳性者为H pylori阳性, 两项均为阴性者为H pylori阴性. 另于胃窦或镜下可疑病变处取胃黏膜3-4块行病理学检测、hTR、hTERT、PCNA及细胞凋亡检测. 根据H pylori感染状况, 分为H pylori阳性组19例(CAG 4例、IM 10例、CAG并IM 5例), H pylori阴性组14例(CAG 3例、IM 5例、CAG并IM 6例), 两组中疾病构成比无显著性差异.
1.2.1 hTR的检测: 采用RNA原位核酸杂交法, hTR原位杂交试剂盒由北京大学医学院病理系提供. 主要步骤如下: (1)切片常规脱蜡水化; (2)0.1 mol/L HCL室温处理10 min; (3)蛋白酶K消化, 37℃ 10-15 min; (4)40 g/L多聚甲醛后固定10 min, 以上3步后均用PBS漂洗; (5)900 mL/L冰乙醇脱水30 s; (6)加含探针杂交液杂交, 42℃ 16-22 h; (7)不同浓度的SSC及BufferⅠ漂洗; (8)马血清封闭, 37℃ 45 min; (9)滴加碱性磷酸酶标记的链霉卵白素液, 37℃孵育1 h; (10)BufferⅠ及BufferⅢ室温下振洗; (11)BCIP-NBT暗处显色, 自来水冲洗, 明胶甘油封片. 已知阳性切片重复染色为阳性对照, 以PBS代替杂交液及碱性磷酸酶标记的链霉卵白素液为阴性对照. 结果判断: 以胞质或胞核染成蓝紫色为阳性细胞; 每张切片至少观察5个连续高倍视野, 每个视野计数100个上皮细胞; 染色强度分级: 阴性(-): 细胞不着色或平均阳性细胞数<10%; 弱阳性(+): 阳性细胞数10%-50%; 中度阳性(++): 阳性细胞数51%-75%; 强阳性(+++): 阳性细胞数>75%.
1.2.2 细胞凋亡检测: 采用TUNEL法, 细胞凋亡原位检测试剂盒为德国Boehringer Mannheim公司产品. 具体步骤如下: (1)切片经二甲苯脱蜡, 梯度乙醇水化; (2) 30 mL/L H2O2室温封闭30 min; (3)20 mg/L蛋白酶K消化20 min; (4)滴加TUNEL反应液, 4℃冰箱过夜; (5)滴加过氧化物酶标记的抗荧光素抗体, 37℃ 30 min; 以上步骤后均以PBS漂洗3次, 每次5 min; (6)DAB显色, 苏木素复染, 脱水、透明、封片. 设立阳性和阴性对照: 用已知阳性切片重复染色为阳性对照, 以省去TdT溶液的FITC标记的核苷酸液替代TUNEL反应液为阴性对照. 结果判断: 胞核呈棕黄色为阳性. 凋亡细胞计数: 每张切片观察5个连续高倍视野, 每个视野计数100个上皮细胞中的凋亡细胞数, 以平均数为凋亡指数(Apoptotic Index, AI).
1.2.3 hTERT、c-Myc蛋白及PCNA表达的检测: 采用过氧化酶标记的链霉卵白素法(SP)法浓缩型hTERT兔多克隆抗体、c-Myc鼠mAb及PCNA单克隆抗体均为Santa Cruz公司产品, 三者的稀释浓度均为1∶150. 主要步骤如下: (1)切片脱蜡, 水化; (2)30 mL/L H2O2室温封闭10 min; (3)微波炉抗原修复10 min; (4)滴加正常山羊血清封闭液室温15 min; (5)滴加一抗, 4℃过夜; (6)滴加生物素标记的二抗工作液, 37℃ 15 min; (7)滴加辣根酶标记的链霉卵白素工作液, 37℃ 15 min; (8)DAB显色, 苏木素复染, 脱水、透明、封片. 结果判断: hTERT、c-Myc蛋白以胞核或胞质染成棕黄色为阳性细胞; 每张切片至少观察5个连续高倍视野, 每个视野计数100个上皮细胞; 染色强度分级: 阴性(-): 阳性细胞数<5%; 弱阳性(+): 阳性细胞数5%-25%; 中度阳性(++): 阳性细胞数26%-50%; 强阳性(+++): 阳性细胞数>50%.增殖细胞计数: 每张切片观察5个连续高倍视野, 每个视野计数100个上皮细胞中的增殖细胞数, 以平均数为增殖指数(PI). 常规设置对照: 已知阳性切片重复染色为阳性对照, 用PBS代替一抗作为阴性对照.
统计学处理t检验及秩和检验, 各指标之间相关性用Spearman等级相关分析, P<0.05为统计学显著意义.
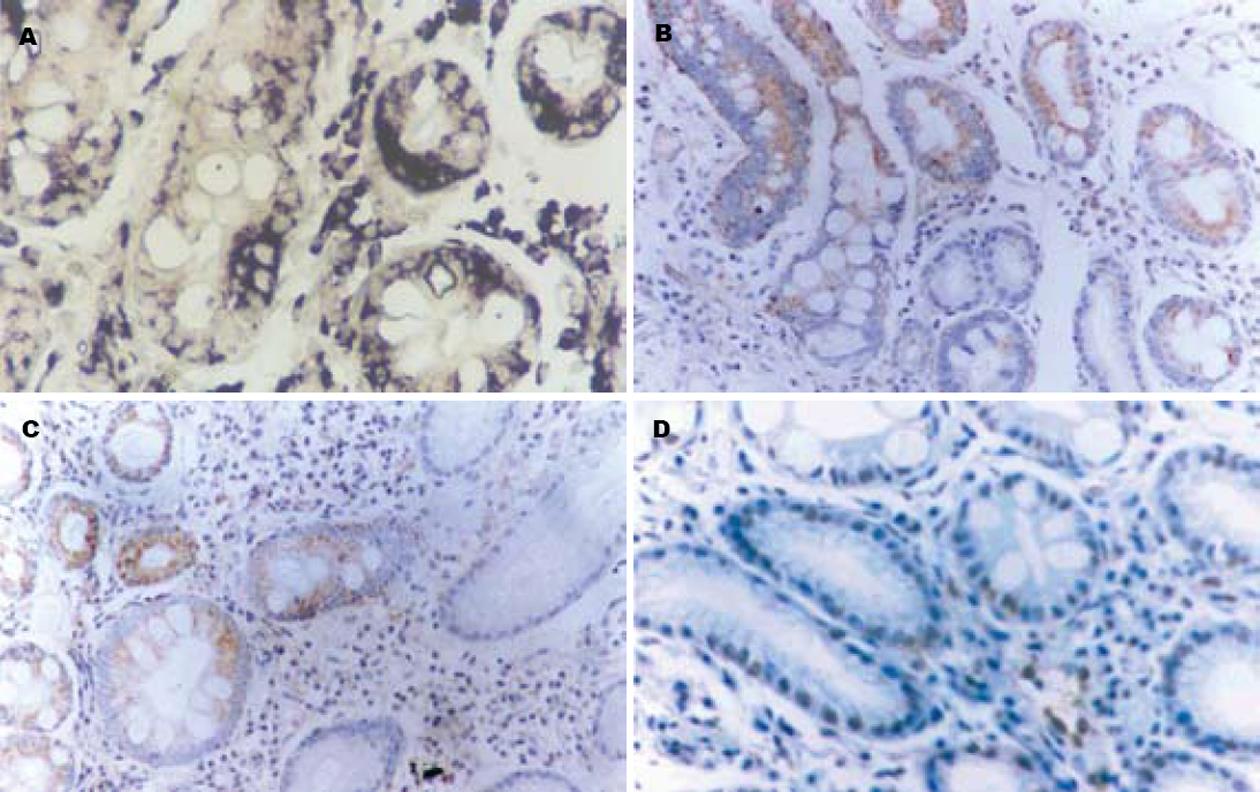
H pylori阳性胃癌前病变组hTR、hTERT、c-Myc阳性率均显著高于H pylori阴性胃癌前病变组(表1, 图1A-C).
H pylori阳性组PI及AI分别为17.5±5.4、17.7±3.9, H pylori阴性组PI及AI分别为8.3±3.6、9.2±5.2, 两组相比均有显著性差异(P<0.01, 图1D).
33例胃癌前病变中hTERT阳性16例, PI为16.1±6.3, hTERT阴性17例, PI为11.2±6.1, 两者相比有显著性差异(P<0.05), hTERT阳性及阴性胃癌前病变中AI分别为15.7±6.0、12.5±6.1, 两者相比无显著性差异(P>0.05).
胃癌前病变中hTERT与hTR、hTERT与c-Myc表达均呈显著正相关性, 相关系数rs分别为0.45、0.54(P<0.01).
端粒酶在结构上是一种核糖核蛋白复合物, 由RNA和蛋白质组成, 具有逆转录酶活性, 能以自身内源性RNA为模板合成端粒重复序列并加至染色体末端以维持染色体的稳定. 大量研究显示, 端粒酶激活是细胞保持持续分裂增殖的基础, 与细胞的异常增殖密切相关, 是肿瘤发生学上的一共同途径. 1995年及1997年hTR及hTERT相继被克隆成功. hTR是端粒酶的重要组成部分, 包含有编码端粒的模板区及端粒酶蛋白结合区. hTERT是端粒酶的催化亚基, 又名端粒酶逆转录酶, 是端粒酶的限制组分, 其表达水平与端粒酶活性直接相关[5-7]. H pylori感染与胃癌的发生密切相关, 1994年世界卫生组织国际癌症研究机构将H pylori列为人类Ⅰ类(即肯定的)致癌因子[8]. 近年研究显示H pylori感染与端粒酶激活有关. Kameshima et al[9]将H pylori接种至成年蒙古鼠胃黏膜中, 6 mo后做胃黏膜病理及端粒酶活性检测, 发现H pylori阳性胃肠上皮化生组织中端粒酶活性显著高于H pylori阴性对照组(P<0.05), 认为慢性H pylori感染是导致胃黏膜IM组织中端粒酶激活的因素之一. Kuniyasu et al[10]研究表明H pylori定植的密度与肠上皮化生的级别、hTR表达水平、端粒酶阳性率呈明显正相关, 推断H pylori感染可能是肠上皮化生组织中hTR过度表达的强启动因子. 本研究显示胃癌前病变中H pylori阳性组hTR、hTERT表达率分别为63.2、68.4%, 显著高于H pylori阴性组(P<0.01), 提示H pylori感染可诱导胃癌前病变中端粒酶相关基因过表达. 研究表明, hTERT和hTR的产物同时存在才可获得端粒酶活性, 两者的单方面突变均可导致端粒酶活性的丧失[5,11]. 本研究显示hTR与hTERT 表达呈显著正相关. 说明hTR与hTERT表达具有一致性. 推测H pylori感染同时诱导hTR、hTERT异常表达, 使端粒酶激活, 导致细胞增殖过度, 从而使胃黏膜易于癌变. 端粒酶激活是H pylori毒性产物的直接作用结果, 还是与H pylori引起的慢性炎症有关, 目前尚无定论. Yang et al研究显示化学致癌剂及H pylori培养产物作用于胃干细胞, 5 d后端粒酶活性及hTR表达明显上调[12]. 国内有学者用H pylori培养液作用于胃癌细胞, 结果显示实验组hTERT、Bcl-2表达显著高于对照组, 且随着作用时间延长而呈递增趋势[13].
c-Myc原癌基因定位于人类染色体8q24, 是调控细胞周期、调节细胞增殖与分化的一重要基因, c-Myc转录产物参与细胞内其他基因尤其是那些与细胞增殖有关基因的转录调控. c-Myc可被促有丝分裂原或生长因子刺激物激活并过度表达, 促进细胞从G1期到S期转化, 导致细胞恶性转化[14-15]. 在CAG并重度IM病变中, H pylori阳性组端粒酶活性、c-Myc表达显著高于H pylori阴性组, 且c-Myc表达在H pylori阳性胃癌病变中亦显著高于H pylori阴性胃癌[16]. 本研究亦显示H pylori阳性胃癌前病变组c-Myc阳性率显著高于H pylori阴性胃癌前病变组(P<0.01). 研究发现, 在肿瘤细胞中c-Myc表达与hTERT水平相平行, 且hTERT基因启动子中有c-Myc蛋白的结合位点, c-Myc蛋白可能对激活hTERT表达起关键作用[17-18]. Wang et al[19]将Myc基因转染二倍体正常人体细胞, 发现转染后的细胞hTERT基因表达上调, 端粒酶活性增加, 但hTR基因的表达不增加, 认为Myc基因可以通过上调hTERT基因的表达来增加端粒酶活性. 藤黄素作用胃癌细胞株后, c-Myc表达下降同时hTERT表达下调, 端粒酶活性降低[20]. 本研究中hTERT与c-Myc蛋白表达呈显著正相关. 由此我们认为, H pylori感染导致的胃癌前病变中c-Myc蛋白过度表达可引起hTERT基因表达上调, 使端粒酶激活, 从而促进细胞恶性转化, 导致胃黏膜癌变, 这可能是H pylori感染致胃黏膜癌变机制之一.
细胞凋亡是在基因调控下的主动性细胞死亡过程, 是程序性细胞死亡的主要形式. 细胞凋亡的异常是肿瘤形成的重要病理基础之一. 新近一项研究显示, 胃黏膜上皮细胞凋亡与胃炎尤其是胃窦部炎症活动度及H pylori定植密度有关, 但与萎缩性胃炎发生无关[21]. Tseng et al研究显示PCNA在慢性胃炎、肠上皮化生、胃腺癌中的表达明显高于正常胃黏膜组织[22]. 本研究显示H pylori阳性组PI及AI分别为17.5±5.4和17.7±3.9, 均显著高于H pylori阴性组(8.3±3.6和9.2±5.2)(P<0.01), 提示H pylori感染可诱导细胞凋亡, 促进细胞增殖, 引起胃黏膜上皮细胞动力学紊乱. 国内有研究显示胃癌患者腹水端粒酶阳性患者PCNA表达明显高于腹水端粒酶阴性者, 认为端粒酶活性与胃癌高增殖状态相关[23]. 但是, 也有研究显示在泌尿系移行细胞癌中hTERT mRNA与PCNA表达及预后无明显关系[24]. 本研究显示33例胃癌前病变中hTERT阳性16例, PI为16.1±6.3, hTERT阴性17例, PI为11.2±6.1, 两者相比有显著性差异(P<0.05); hTERT阳性及阴性胃癌前病变中AI分别为15.7±6.0、12.5±6.1, 两者相比无显著性差异, 表明hTERT阳性细胞多处于高增殖状态. 王国安 et al[25]对胃癌及癌前病变的研究显示, H pylori阳性且hTERT蛋白阳性组凋亡指数显著高于H pylori阴性且hTERT蛋白阳性组(P<0.05), 认为H pylori感染可能一方面通过激活端粒酶促进细胞永生化, 而使胃黏膜出现永生化、高增殖性细胞, 同时通过诱导细胞凋亡方式淘汰非永生化细胞以及永生化、高增殖性细胞群中增殖性相对较低者, 继而形成稳定的永生化、高增殖性细胞群体, 使细胞积聚速度明显增加, 肿瘤生长加快并表现出恶性行为.
总之, 本研究提示在胃癌前病变中H pylori感染可诱导端粒酶相关基因及c-Myc过度表达, 促进细胞增殖与凋亡, 引起胃黏膜上皮细胞动力学紊乱, 这可能是H pylori致胃黏膜癌变机制之一.
H pylori感染是慢性胃炎及消化性溃疡的主要病因, 与胃癌的发生也密切相关, 但其确切致病机制尚不清楚. 本文研究胃癌前病变中端粒酶相关基因、细胞增殖及凋亡与H pylori感染的关系, 探讨H pylori感染致胃癌前病变的机制.
白爱平, 副教授, 南昌大学第一附属医院消化内科; 刘改芳, 主任医师, 河北医科大学第三医院消化内科
H pylori感染致胃黏膜癌变的分子机制一直是该领域的研究热点, H pylori根除后胃癌前病变能否逆转尚无定论, 尚需大规模长期的临床随访研究确定.
Kameshima et al动物实验显示H pylori阳性肠上皮化生组织中端粒酶活性显著高于H pylori阴性对照组, 认为慢性H pylori感染是导致胃黏膜肠上皮化生组织中端粒酶激活的因素之一; Kuniyasu et al认为H pylori感染可能是肠上皮化生组织中hTR过度表达的强启动因子.
本文同时研究了胃癌前病变中端粒酶相关基因及c-Myc的表达, 以及细胞凋亡与增殖, 并分析hTERT与其他各指标间相互关系, 从多角度研究H pylori感染致胃癌前病变机制.
本研究探讨了H pylori感染致胃癌前病变可能机制, 从分子生物学角度进一步支持H pylori阳性胃癌前病变应进行H pylori根除治疗.
端粒酶: 是一种核糖核蛋白复合物, 由RNA和蛋白质组成, 具有逆转录酶活性, 能以自身内源性RNA为模板合成端粒重复序列并加至染色体末端, 以弥补细胞分裂时端粒DNA的丢失, 维持端粒的长度, 保持染色体的动态平衡.
本文从端粒酶活性角度探讨H pylori感染对胃上皮细胞细胞增殖与凋亡的影响, 选题准确, 实验方案可行, 学术价值较好.
编辑: 李军亮 电编:吴鹏朕
| 1. | Correa P, Houghton J. Carcinogenesis of Helicobacter pylori. Gastroenterology. 2007;133:659-672. [PubMed] [DOI] |
| 2. | Kato I, van Doorn LJ, Canzian F, Plummer M, Franceschi S, Vivas J, Lopez G, Lu Y, Gioia-Patricola L, Severson RK. Host-bacterial interaction in the development of gastric precancerous lesions in a high risk population for gastric cancer in Venezuela. Int J Cancer. 2006;119:1666-1671. [PubMed] [DOI] |
| 3. | Nakamura TM, Morin GB, Chapman KB, Weinrich SL, Andrews WH, Lingner J, Harley CB, Cech TR. Telomerase catalytic subunit homologs from fission yeast and human. Science. 1997;277:955-959. [PubMed] [DOI] |
| 4. | Meyerson M, Counter CM, Eaton EN, Ellisen LW, Steiner P, Caddle SD, Ziaugra L, Beijersbergen RL, Davidoff MJ, Liu Q. hEST2, the putative human telomerase catalytic subunit gene, is up-regulated in tumor cells and during immortalization. Cell. 1997;90:785-795. [PubMed] [DOI] |
| 5. | Weinrich SL, Pruzan R, Ma L, Ouellette M, Tesmer VM, Holt SE, Bodnar AG, Lichtsteiner S, Kim NW, Trager JB. Reconstitution of human telomerase with the template RNA component hTR and the catalytic protein subunit hTRT. Nat Genet. 1997;17:498-502. [PubMed] [DOI] |
| 6. | Ramakrishnan S, Eppenberger U, Mueller H, Shinkai Y, Narayanan R. Expression profile of the putative catalytic subunit of the telomerase gene. Cancer Res. 1998;58:622-625. [PubMed] |
| 7. | Nakayama J, Tahara H, Tahara E, Saito M, Ito K, Nakamura H, Nakanishi T, Tahara E, Ide T, Ishikawa F. Telomerase activation by hTRT in human normal fibroblasts and hepatocellular carcinomas. Nat Genet. 1998;18:65-68. [PubMed] [DOI] |
| 8. | Schistosomes, liver flukes and Helicobacter pylori. IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Lyon, 7-14 June 1994. IARC Monogr Eval Carcinog Risks Hum. 1994;61:1-241. [PubMed] |
| 9. | Kameshima H, Yagihashi A, Yajima T, Watanabe N, Ikeda Y. Helicobacter pylori infection induces telomerase activity in premalignant lesions. Am J Gastroenterol. 1999;94:547-548. [PubMed] [DOI] |
| 10. | Kuniyasu H, Domen T, Hamamoto T, Yokozaki H, Yasui W, Tahara H, Tahara E. Expression of human telomerase RNA is an early event of stomach carcinogenesis. Jpn J Cancer Res. 1997;88:103-107. [PubMed] |
| 11. | McEachern MJ, Blackburn EH. Runaway telomere elongation caused by telomerase RNA gene mutations. Nature. 1995;376:403-409. [PubMed] [DOI] |
| 12. | Yang YC, Wang SW, Hung HY, Chang CC, Wu IC, Huang YL, Lin TM, Tsai JL, Chen A, Kuo FC. Isolation and characterization of human gastric cell lines with stem cell phenotypes. J Gastroenterol Hepatol. 2007;22:1460-1468. [PubMed] [DOI] |
| 14. | Meichle A, Philipp A, Eilers M. The functions of Myc proteins. Biochim Biophys Acta. 1992;1114:129-146. [PubMed] |
| 15. | Daksis JI, Lu RY, Facchini LM, Marhin WW, Penn LJ. Myc induces cyclin D1 expression in the absence of de novo protein synthesis and links mitogen-stimulated signal transduction to the cell cycle. Oncogene. 1994;9:3635-3645. [PubMed] |
| 16. | Zhang GX, Gu YH, Zhao ZQ, Xu SF, Zhang HJ, Wang HD, Hao B. Coordinate increase of telomerase activity and c-Myc expression in Helicobacter pylori-associated gastric diseases. World J Gastroenterol. 2004;10:1759-1762. [PubMed] |
| 17. | Kyo S, Takakura M, Taira T, Kanaya T, Itoh H, Yutsudo M, Ariga H, Inoue M. Sp1 cooperates with c-Myc to activate transcription of the human telomerase reverse transcriptase gene (hTERT). Nucleic Acids Res. 2000;28:669-677. [PubMed] [DOI] |
| 18. | Takakura M, Kyo S, Kanaya T, Hirano H, Takeda J, Yutsudo M, Inoue M. Cloning of human telomerase catalytic subunit (hTERT) gene promoter and identification of proximal core promoter sequences essential for transcriptional activation in immortalized and cancer cells. Cancer Res. 1999;59:551-557. [PubMed] |
| 19. | Wang J, Xie LY, Allan S, Beach D, Hannon GJ. Myc activates telomerase. Genes Dev. 1998;12:1769-1774. [PubMed] [DOI] |
| 20. | Yu J, Guo QL, You QD, Lin SS, Li Z, Gu HY, Zhang HW, Tan Z, Wang X. Repression of telomerase reverse transcriptase mRNA and hTERT promoter by gambogic acid in human gastric carcinoma cells. Cancer Chemother Pharmacol. 2006;58:434-443. [PubMed] [DOI] |
| 21. | Vorobjova T, Maaroos HI, Uibo R. Immune response to Helicobacter pylori and its association with the dynamics of chronic gastritis in the antrum and corpus. APMIS. 2008;116:465-476. [PubMed] [DOI] |
| 22. | Tseng HH, Hsu PI, Chen HC, Lai KH, Lo GH, Lo CC, Chou NH, Mok KT, Chen IS, Chou NH. Compartment theory in Helicobacter pylori-associated gastric carcinogenesis. Anticancer Res. 2003;23:3223-3229. [PubMed] |
| 23. | Da MX, Wu XT, Guo TK, Zhao ZG, Luo T, Qian K, Zhang MM, Wang J. Clinical significance of telomerase activity in peritoneal lavage fluid from patients with gastric cancer and its relationship with cellular proliferation. World J Gastroenterol. 2007;13:3122-3127. [PubMed] |
| 24. | Nakanishi K, Hiroi S, Kawai T, Aida S, Kasamatsu H, Aurues T, Ikeda T. Expression of telomerase catalytic subunit (hTERT) mRNA does not predict survival in patients with transitional cell carcinoma of the upper urinary tract. Mod Pathol. 2001;14:1073-1078. [PubMed] [DOI] |