修回日期: 2009-04-10
接受日期: 2009-04-13
在线出版日期: 2009-05-18
目的: 探讨贞清方对2型糖尿病非酒精性脂肪肝的治疗作用及可能机制.
方法: 高脂高糖饮食结合小剂量链脲佐菌素(STZ)腹腔注射建立2型糖尿病并发非酒精性脂肪肝大鼠模型. 将成模大鼠随机分为模型组、贞清方治疗组和女贞子治疗组(n = 8), 并设立正常对照组(n = 10), 灌胃治疗8 wk. 比较喂养4、8和16 wk时各组大鼠空腹血糖(FBG)、血清甘油三酯(TG)、总胆固醇(TC)、胰岛素(FINs)和胰岛素敏感指数(ISI)的变化. 并于喂养16 wk时观察各组大鼠肝脏指数、TG含量和血清丙氨酸转氨酶(ALT)的水平以及病理变化. 用PCR法观察大鼠肝X受体(LXRα)及其下游固醇调节元件结合蛋白-1c (SREBP-1c) mRNA的表达, 免疫组织化学法观察肝脏LXRα蛋白的表达.
结果: 灌胃干预8 wk后, 与正常组相比, 模型组大鼠FBG、血清TG、肝脏指数及肝脏TG含量明显升高(均P<0.01), 胰岛素敏感性明显降低(P<0.01), 肝脏脂肪变明显加重, 肝脏LXRα mRNA、SREBP-1c mRNA和LXRα蛋白的表达明显增多(均P<0.01). 与模型组相比, 贞清方治疗组大鼠FBG水平、血清TG水平、肝脏指数及肝脏TG含量明显降低(10.94±3.33 mmol/L vs 16.67±4.33 mmol/L; 0.79±0.27 mmol/L vs 1.33±0.33 mmol/L; 5.72±0.81 vs 7.61±1.24; 0.041±0.0110 mmol/g vs 0.059±0.0160 mmol/g, 均P<0.01), 肝脏脂肪变明显改善, 肝脏LXRα mRNA、SREBP-1c mRNA和LXRα蛋白的表达明显减少(0.75±0.11 vs 1.23±0.17, 0.68±0.16 vs 1.07±0.14, 0.220±0.071 vs 0.334±0.037, 均P<0.01).
结论: 贞清方对2型糖尿病性非酒精性脂肪肝具有一定的治疗作用, 且其治疗作用可能与贞清方能下调非酒精性脂肪肝组织LXRα的表达有关.
引文著录: 罗琼, 文秀英, 鲁敏, 许明旺, 熊亮. 贞清方对2型糖尿病并发非酒精性脂肪肝大鼠LXRα表达的影响. 世界华人消化杂志 2009; 17(14): 1394-1401
Revised: April 10, 2009
Accepted: April 13, 2009
Published online: May 18, 2009
AIM: To investigate prevention and functional mechanism of Zhengqing Recipe (ZQR) in the models of type 2 diabetic rats complicated with non-alcoholic fatty liver disease.
METHODS: The model of type 2 diabetic rats complicated with non-alcoholic fatty liver was established by feeding high-glucose and high-fat diet, and injection of low dose streptozotocin. The model rats were randomly divided into four groups: model group, ZQR group and fructus ligustri lucidi group (n = 8), and normal control group (n = 10). Intragastric administration lasted for 8 wk. On 4 wk, 8 wk and 16 wk, the levels of fasting blood glucose (FBG), fasting serum insulin (FINs), serum triglyceride (TG) and serum total cholesterol (TC) in each group were tested and the level of insulin sensitivity index (ISI) was calculated. On 16 wk, serum alanine aminotransferase (ALT), index of liver and liver TG content in each group were examined as well. Meanwhile, pathological changes of liver, the expression of liver X receptor α (LXRα) mRNA, sterol regulatory element-binding protein-1c (SREBP-1c) mRNA and LXRα protein of liver tissues in each group were detected.
RESULTS: After treatment for 8 wk, the levels of FBG, serum TG and TC, index of liver and liver TG content were significantly higher (all P < 0.01), ISI was significantly lower (P < 0.01), liver cirrhosis was significantly exacerbated, and the expressions of LXRα mRNA,SREBP-1c mRNA and LXRα protein were significantly increased (all P < 0.01) in model group compared with control group. Compared with model rats, the levels of FBG, serum TG, index of liver and liver TG content were significantly lower (10.94 ± 3.33 mmol/L vs 16.67 ± 4.33 mmol/L; 0.79 ± 0.27 mmol/L vs 1.33 ± 0.33 mmol/L; 5.72 ± 0.81 vs 7.61 ± 1.24; 0.041 ± 0.0110 mmol/g vs 0.059 ± 0.0160 mmol/g, all P < 0.01). Liver cirrhosis was significantly improved, and the expressions of LXRα mRNA,SREBP-1c mRNA and LXRα protein were significantly decreased (0.75 ± 0.11 vs 1.23 ± 0.17, 0.68 ± 0.16 vs 1.07 ± 0.14, 0.220 ± 0.071 vs 0.334 ± 0.037, all P < 0.01) in ZQR group.
CONCLUSION: ZQR could possess favorable efficacy on non-alcoholic fatty liver in the model of type 2 diabetic rats and the mechanism may be related to the down-regulated expression of LXRα in non-alcoholic fatty liver.
- Citation: Luo Q, Wen XY, Lu M, Xu MW, Xiong L. Regulation of Zhenqing Recipe on expression of hepatic LXRα in type 2 diabetic rats complicated with non-alcoholic fatty liver disease. Shijie Huaren Xiaohua Zazhi 2009; 17(14): 1394-1401
- URL: https://www.wjgnet.com/1009-3079/full/v17/i14/1394.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i14.1394
非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)是一种与饮酒无关的、由多病因引起的肝细胞内脂质蓄积过多的临床病理综合征. 流行病学研究认为, 2型糖尿病患者有着比正常人更高的NAFLD患病率[1]. 如何防治NAFLD将成为糖尿病科研工作中不可忽视的重要环节. 肝X受体α(liver X receptor α, LXRα)是目前研究发现的与NAFLD的发生发展密切相关的一种核转录因子, 可通过上调其下游与脂质合成相关的基因(如SREBP-1c)的表达, 促进脂质在肝脏沉积, 从而与NAFLD的发生和发展密切相关[2-3]. LXRα很可能成为今后防治NAFLD的一个重要的靶点. 我们在前期的临床实践和动物实验中发现, 贞清方在降低2型糖尿病患者和动物模型的糖脂水平、改善胰岛素抵抗和治疗糖尿病肾病上具有一定的疗效[4-5], 但其对2型糖尿病性NAFLD的治疗效果如何还有待研究. 为此, 本研究采用高糖高脂饮食结合小剂量链脲佐菌素腹腔注射的方法建立2型糖尿病并发NAFLD的动物模型[6-8], 给予贞清方提取液进行干预治疗, 观察LXRα及其下游基因SREBP-1c在脂肪肝组织的表达情况, 探讨贞清方对2型糖尿病性NAFLD的治疗作用及可能机制.
♂Wistar大鼠40只, 清洁级, 体质量150-170 g(湖北省医学科学院实验动物中心, 生产许可证号: SCXK(鄂)2008-0005, 每笼4只, 饲养于标准环境, 自由摄食, 12 h光照周期. 胆固醇(武汉亚法生物技术有限公司); 链脲佐菌素(streptozotocin, STZ)(Sigma, 美国); 小鼠抗大鼠LXRa mAb(Abcam, 英国); 引物、TRIzol(Invitrogen, 美国); RT-PCR试剂盒、Marker(北京天根生化科技有限公司); 甘油三酯生化试剂盒(北京中生生物工程高技术公司); 胰岛素放免试剂盒(北京北方生物技术研究所); 两步法抗兔/鼠通用型免疫组化试剂盒(上海基因科技有限公司). 所用中药饮片均购自武汉银杏中药饮片厂. FSH-2可调高速电动匀浆机(江苏金坛市佳美仪器有限公司); Cerfrfuge 5415R低温高速离心机(Eppendorf, 德国); Mastercycler gradiet PCR扩增仪(Eppendorf, 德国); DYY-2型电泳仪(北京市六一仪器厂); 奥林巴斯AU-400自动生化分析仪(广州宝迪公司); SX-300凝胶图像分析系统(Elementar, 德国); 奥林巴斯显微镜及显微摄像仪(Olympus, 日本); HPLC-10A高效液相色谱仪(岛津, 日本).
1.2.1 药物制备: (1)贞清方提取液的制备: 贞清方由女贞子, 地龙等中药组成. 贞清方中的女贞子采用醇提, 提取液浓缩至稠膏状, 减压真空干燥得粉(收膏率约为19%), 以高效液相色谱法测定其中齐墩果酸含量(每克生药含齐墩果酸不低于1.7 mg)为评价指标. 地龙采用水提, 提取液浓缩至稠膏状, 减压真空干燥得粉(收膏率约为12%), 以高效液相色谱法测定其中次黄嘌呤含量(每克生药含次黄嘌呤不低于3.6 mg)作为评价指标. 临用前用蒸馏水溶解, 配成3 g生药/L浓度, 4℃保存. (2)女贞子提取液的制备: 方法同贞清方提取液制备中女贞子的提取. 临用前用蒸馏水溶解, 配成3 g生药/L浓度, 4℃保存.
1.2.2 动物模型制备: 将实验动物随机选择10只作为正常对照组, 喂以普通饲料(华中科技大学同济医学院附属梨园医院动物房提供); 其余30只用于制备模型. 造模方法: 高糖高脂(饲料成分百分比: 普通饲料60.5%, 蔗糖20%、猪油10%、胆固醇2%、蛋黄粉1.5%、豆油6%)饲养4 wk后以30 mg/kg的剂量一次性腹腔注射链脲佐菌素(用0.1 mol/L柠檬酸缓冲液配制成2%溶液, pH4.4), 正常对照组仅注射等体积柠檬酸-柠檬酸钠缓冲液. 继续高糖高脂饲料喂养4 wk, 空腹尾静脉采血测空腹血糖(FBG)并计算胰岛素敏感指数(ISI), 以FBG大于11.1 mmol/L且ISI降低作为成模标准, 共有24只成模.
1.2.3 分组和治疗: 24只成模动物随机分成3组,每组8只: (1)模型组, 灌以等体积蒸馏水; (2)贞清方治疗组, 灌以贞清方提取液26 g/(kg·d); (3)女贞子治疗组, 灌以女贞子提取液26 g/(kg·d). 正常对照组给予等体积蒸馏水. 持续治疗8 wk, 每周称体质量1次, 根据体质量变化调整给药剂量.
1.2.4 标本的收集: 分别于实验4、8和16 wk末空腹尾静脉采血, 分离血清, 用于测FBG、血清胰岛素(FINs)、血清甘油三酯(TG)、血清总胆固醇(TC)并计算ISI. 实验结束时禁食12 h后称体质量、断头处死动物, 立即打开腹腔, 迅速取出肝脏, 先用精确到0.01的电子天平称取肝湿质量, 计算肝脏指数(肝脏指数 = 肝湿质量/体质量×100%), 然后从肝脏右叶中部取小块肝组织置40 g/L多聚甲醛溶液中固定用于HE染色及免疫组织化学染色, 最后将剩余肝组织置于-78℃超低温冰箱内以备测肝组织TG含量及RT-PCR检测.
1.2.5 生化指标的测定: (1)FBG: 葡萄糖氧化酶法检测; (2)TG、TC和ALT: 自动生化分析仪检测; (3)FINs及ISI: FINs用放免法检测, ISI用李氏法计算[9]: ISI = ln(1/FBG×FINS).
1.2.6 肝组织TG含量的测定: 肝组织TG含量用GPO-PAP比色法测定: 肝组织TG量用GPO-PAP比色法测定: 将肝组织自然解冻电子天平称质量后按比例加入冰生理盐水制成100 g/L的匀浆液, 离心机3000 r/min, 15 min, 取等量上清液按甘油三酯生化试剂盒说明进行操作, 半自动生化仪500 nm波长处测定肝组织TG量, 并经肝组织总蛋白校正.
1.2.7 肝组织HE染色: 石蜡包埋切片, 厚度约1 μm, 常规HE染色. 先用低倍镜观察肝脏的大体情况, 再调至高倍镜下观察.
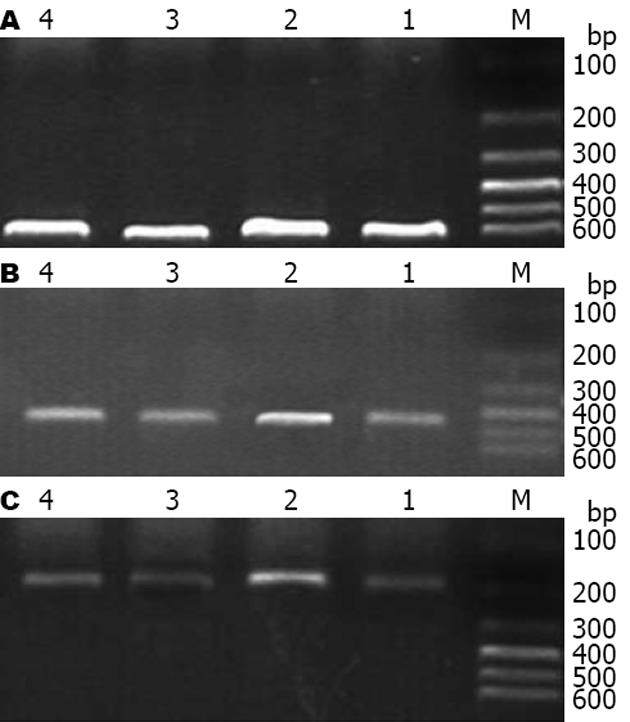
1.2.8 RT-PCR法测定肝组织LXRα mRNA和SREBP-1c mRNA的表达: 取少量肝组织, 采用TRIzol试剂提取总RNA, 其A260/A280值在1.8-2.0 范围内. 各取样本5 μg, 反转录制备cDNA. PCR总反应体积25 μL, 模版1 μL, 上下游引物各1 μL, 2×Taq PCR Master Mix 12.5 μL, ddH2O 9.5 μL. 以β-actin为内参照进行PCR扩增. PCR扩增引物及产物长度为: (1)LXRα: 上游引物5'-CCTACAGAACTTCGTCCACAGA-3'; 下游引物5'-GCAGCCACCAACTTCTCAATC-3'; 扩增片段长434 bp. (2)SREBP-1c: 上游引物5'-GGAGCCATGGATTGCACATT-3'; 下游引物5'-AGGAAGGCTTCCAGAGAGGA-3'; 扩增片段长191 bp. (3)β-actin: 上游引物5'-TACAACTCCTTGCAGCTCC-3'; 下游引物5'-ATCTTCATGAGGTAGTCAGTC-3'; 扩增片段长609 bp. LXRα、SREBP-1c及β-actin扩增条件为: 94℃预变性5 min, 94℃变性45 s, 57℃退火1 min, 72℃延伸1 min, 30次循环后, 再行72℃延伸7 min. 取PCR产物6 μL于12 g/L琼脂糖凝胶中电泳, 600 bp的Marker作为标准, 采用SX-300凝胶图像分析系统测定特异性条带的面积吸光度值(A), 并计算LXRα/β-actin和SREBP-1c/β-actin值比, 代表LXRα mRNA和SREBP-1c mRNA的表达.
1.2.9 肝组织LXRα免疫组织化学染色和图像分析: 免疫组织化学染色采用EnVision两步法, DAB显色, 并以0.01 mmol/L的PBS缓冲液作空白对照. 胞质及胞核内出现棕黄色颗粒物质为阳性. 免疫组化图像分析采用同济医学院病理学系HMIAS-2000型全自动医学彩色图像分析系统. 分析图像经标准灰度校正后, 每张切片随机选择5个视野, 在同等条件下测定LXRα的A值.
统计学处理 计量资料以mean±SD表示, 采用SPSS13.0软件进行数据整理和统计, 两组间比较用t检验, 多组间比较用ANOVA方法, 如果方差不齐, 采用Dunnett T3法分析, 取P<0.05时有统计学意义.
喂养4 wk后, 与正常对照组相比, 模型组大鼠FBG有所升高但无显著性差异(P>0.05); FINs、ISI升高有显著性差异(P<0.01或0.05). 喂养8 wk后(即注射STZ 4 wk后), 与正常对照组相比, 模型组大鼠FBG升高有显著性差异(P<0.01)且与自身喂养4 wk时相比升高亦有显著性差异(P<0.01); ISI降低有显著性差异(P<0.01)且与自身喂养4 wk时相比降低亦有显著性差异(P<0.05); FINs与注射前(即喂养4 wk)相比显著下降(P<0.01), 但高于正常对照组不明显(P>0.05). 喂养16 wk后(即治疗8 wk后), 与模型组组相比, 贞清方治疗组和女贞子治疗组大鼠FBG降低有显著性差异(P<0.01或0.05), FINs升高有显著性差异(P<0.01或0.05), ISI降低有显著性差异(P<0.05). 且与女贞子治疗组相比, 贞清方治疗组大鼠FBG降低有显著性差异(P<0.05), FINs升高有显著性差异(P<0.05, 表1-3).
| 分组 | n | FBG(mmol/L) | FINs(mU/L) | ISI | TG(mmol/L) | TC(mmol/L) | ALT(U/L) |
| 正常对照组 | 10 | 5.21±0.53 | 28.25±9.39 | -4.03±0.44 | 0.66±0.17 | 2.13±0.19 | 34.30±6.22 |
| 模型组 | 8 | 16.67±4.33b | 51.44±7.15b | -6.75±0.57b | 1.33±0.33b | 4.35±1.91b | 80.34±11.30b |
| 贞清方组 | 8 | 10.94±3.33de | 40.12±6.13de | -5.33±0.77c | 0.79±0.27de | 4.44±0.87 | 46.30±9.45de |
| 女贞子组 | 8 | 12.86±3.57c | 36.29±7.35c | -5.96±0.69c | 1.02±0.31c | 4.37±0.64 | 51.79±10.14c |
喂养4 wk后, 与正常对照组相比, 模型组组大鼠血清TG、TC升高有显著性差异(P<0.05); 喂养8 wk后(即注射STZ 4 wk后), 与正常对照组相比, 模型组组大鼠血清TG、TC升高有显著性差异(P<0.01)且与自身喂养4 wk时相比升高亦有显著性差异(P<0.01或0.05). 喂养16 wk后(即治疗8 wk后), 与正常对照组相比, 模型组血清ALT升高有显著性差异(P<0.01); 与模型组相比, 贞清方治疗组和女贞子治疗组大鼠血清TG下降有显著性差异(P<0.01或P<0.05)、ALT下降有显著性差异(P<0.01或P<0.05)但血清TC变化不大(P>0.05). 且与女贞子治疗组相比, 贞清方治疗组大鼠血清ALT升高有显著性差异(P<0.05), 血清TG下降有显著性差异(P<0.05, 表1-3).
喂养16 wk后(即治疗8 wk后), 与正常对照组相比, 模型组大鼠肝脏湿质量、肝脏指数及肝组织TG含量升高有显著性差异(P<0.01); 与模型组相比, 贞清方治疗组和女贞子治疗组大鼠肝脏湿重及肝组织TG含量降低有显著性差异(P<0.01或0.05), 肝脏指数降低有显著性差异(P<0.01或0.05). 且与女贞子治疗组相比, 贞清方治疗组肝脏指数下降有显著性差异(P<0.05, 表4).
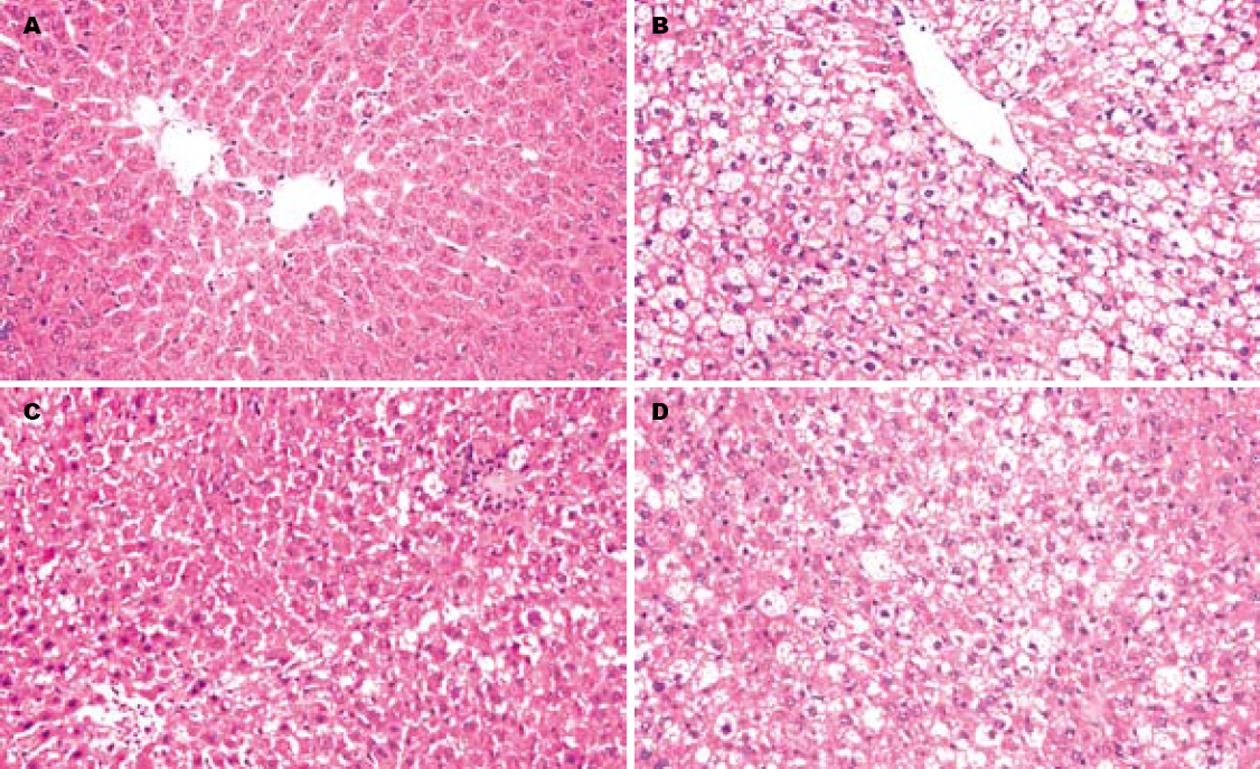
喂养16 wk后(即治疗8 wk后),正常对照组大鼠肝组织结构完整, 肝细胞以中央静脉为中心向四周呈放射状整齐排列, 肝细胞分界清, 大小较一致, 核1-2个, 圆而清晰, 核位于细胞中央, 胞质丰富, 肝窦排列规则, 汇管区清晰, 无炎症反应. 模型组大鼠肝小叶结构明显紊乱, 肝细胞索消失, 肝窦消失, 肝细胞变大, 胞质内充满大量大小不等的圆形脂滴, 出现广泛弥漫性肝细胞空泡样变性(>75%), 但未见炎症、坏死和纤维化, 呈现重度单纯性脂肪肝改变. 贞清方治疗组大鼠肝小叶结构较完整, 肝索排列较清晰, 空泡样变的肝细胞数目明显减少(30%-75%)、体积明显缩小, 胞质中可见细小脂滴, 未见炎症、坏死和纤维化, 呈现轻度单纯性脂肪肝改变. 女贞子治疗组大鼠肝小叶结构较完整, 肝索排列欠清晰, 空泡样变的肝细胞数目明显减少(50%-75%)、体积缩小, 胞质中可见大小不等的脂滴, 未见炎症、坏死和纤维化, 呈现中度单纯性脂肪肝改变(图1).
喂养16 wk后(即治疗8 wk后),与正常对照组相比较, 模型组肝脏LXRα和SREBP-1c的mRNA表达显著升高(P<0.01); 与模型组相比, 贞清方治疗组肝脏LXRα和SREBP-1c的mRNA表达明显降低(P<0.01); 女贞子治疗组肝脏SREBP-1c的mRNA表达明显降低(P<0.05)而LXRα的mRNA表达变化不大(P>0.05). 且贞清方治疗组LXRα mRNA表达低于女贞子治疗组(P<0.05, 图2, 表5).
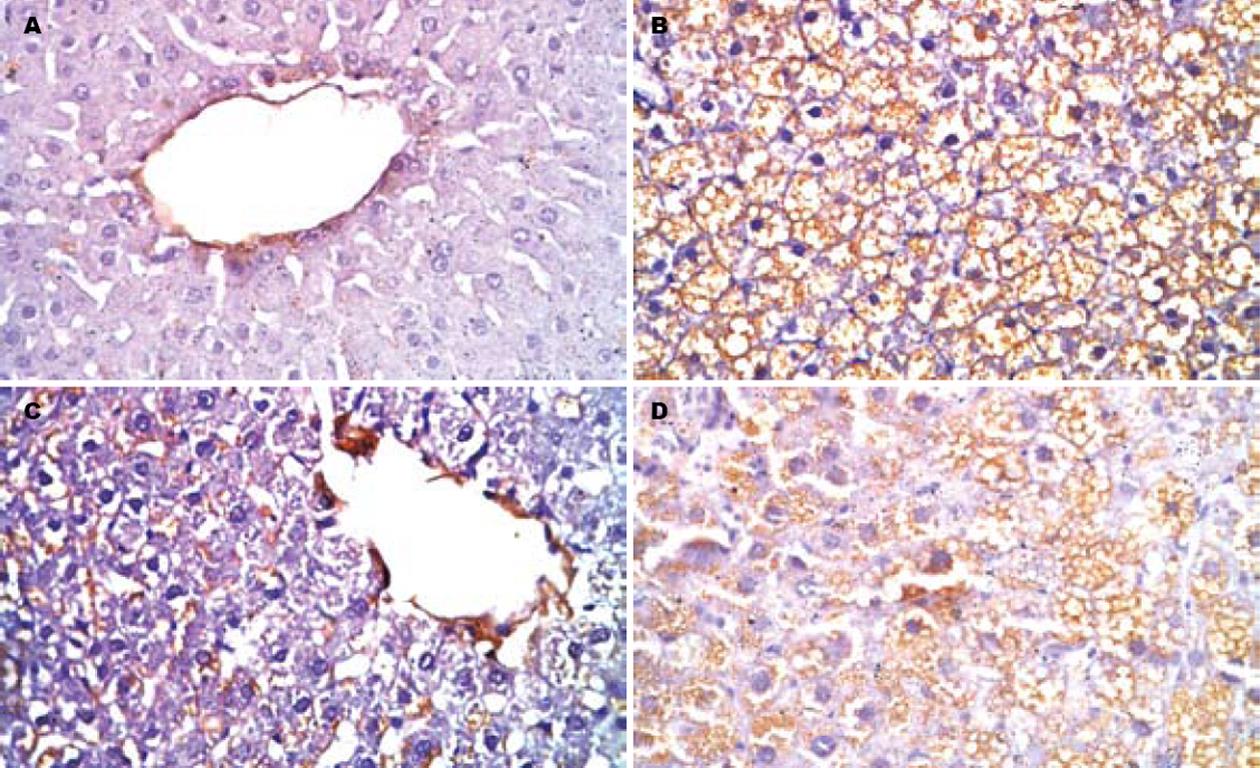
免疫组化结果显示: 喂养16 wk后(即治疗8 wk后), 正常对照组大鼠肝组织内仅有少量棕黄色颗粒散在分布; 模型组肝组织内棕黄色颗粒明显增多, 以肝窦周围及汇管区明显; 贞清方治疗组肝组织内棕黄色颗粒较模型组明显减少且表达强度降低, 而女贞子治疗组肝组织内棕黄色颗粒表达与模型组相比无明显差异. 图像分析结果示: 与正常对照组相比较, 模型组肝脏LXRα的A值显著升高(P<0.01); 与模型组组相比较, 贞清方治疗组LXRα的A值明显降低(P<0.01), 而女贞子治疗组LXRα的A值变化不大(P>0.05), 且贞清方治疗组LXRα的A值低于女贞子治疗组(P<0.05, 图3, 表5).
虽然2型糖尿病并发NAFLD机制尚未明确, 但脂质代谢紊乱被认为是2型糖尿病并发NAFLD重要的病理基础[10]. 2型糖尿病时, 由于胰岛素抵抗等因素的共同作用, 肝脏内脂肪, 尤其是甘油三酯, 合成增多而分解和转出减少, 多余脂肪在肝细胞内异常沉积, 导致肝细胞脂肪变, 促进NAFLD的发生发展[10-11]. 所以, 纠正脂质代谢紊乱, 减轻肝脏脂质沉积, 对2型糖尿病并发的NAFLD具有重要的治疗意义.
LXRs属于孤核受体超家族, 是目前为国内外学者所关注的脂代谢通路的关键信号转导因子, 已知的主要有LXRα(NR1H3)和LXRβ(NR1H2)两种同源亚型, 其中肝脏以LXRα的表达最多, 他们和9-顺-视黄醛受体(RXR)形成异源二聚体后才具有与DNA配体结合的能力, 与配体结合后LXR才具有转录活性[2,12]. 研究表明, LXRs可通过上调其靶基因, 糖脂代谢的两个关键转录因子: SREBP-1c和CHREBP的表达, 介导生脂基因FAS, ACC等的表达来参与脂代谢[12-14]. LXRs激活剂TO901317可诱导小鼠肝脏SREBP-1c和FAS的表达[15], 而LXRs基因敲除的小鼠其肝脏SREBP-1c、FAS和ACC的表达均降低[16]. 国内外的研究还发现: NAFLD患者和NAFLD模型大鼠肝脏LXRα的表达均明显高于正常对照组[3,17], 且在NAFLD患者, LXRα的表达与SREBP-1c的表达密切相关而与CHREBP关系不大[3]. 因而, LXRs尤其LXRα为我们从源头上抑制肝脏脂质异常沉积、防治NAFLD提供了重要的靶点.
本实验的结果显示: 高脂高糖饮食结合小剂量STZ注射方法建立的2型糖尿病并发NAFLD模型, 其肝脏LXRα mRNA和SREBP-1c mRNA表达及肝脏LXRα蛋白的表达均明显高于正常对照组, 这与之前关于LXRα的文献报道[3]是相符的. 用贞清方治疗8 wk后, 模型大鼠的空腹血糖、血清TG含量显著降低、胰岛素敏感性明显提高, 表明贞清方在改善2型糖尿病并发NAFLD大鼠的糖脂水平和胰岛素抵抗方面具有一定的作用; 而且, 模型大鼠血清ALT明显降低、肝脏TG含量明显减少及HE染色显示肝细胞脂肪变明显减轻, 表明贞清方在改善2型糖尿病并发NAFLD大鼠的肝功能、减轻肝脏脂质沉积、治疗肝脏脂肪变方面具有一定作用; 同时, 模型大鼠肝脏 LXRα mRNA和SREBP-1c mRNA表达及肝脏LXRα蛋白的表达均明显减少, 表明贞清方对2型糖尿病NAFLD的治疗作用可能和其能抑制脂肪肝组织LXRα及其下游SREBP-1c的表达有关.
在实验中作者还发现, 贞清方的主要成分女贞子对2型糖尿病NAFLD也有一定的治疗作用. 以往的文献报道, 女贞子的主要有效成分齐墩果酸具有良好的降糖降脂功能[18-19], 但其对脂肪肝的治疗效果如何还有待研究. 本实验结果表明, 经女贞子治疗8 wk后, 模型大鼠空腹血糖、血清TG含量、胰岛素敏感性、血清ALT及肝脏指数、肝脏TG含量和肝脏脂肪变均明显改善, 肝脏SREBP-1c mRNA表达也明显减少, 但是肝脏LXRα mRNA表达和LXRα蛋白的表达与模型组大鼠相比无明显变化. 说明女贞子对脂肪肝的治疗作用可能与肝脏SREBP-1c的表达有关, 而与LXRα的表达关系不大. 这同时也说明, 中药复方与单味中药相比, 具有多靶点治疗的优势.
总之, 贞清方能有效降低2型糖尿病并发NAFLD大鼠的糖脂水平、改善其胰岛素敏感性、减轻肝脏脂质沉积, 对2型糖尿病NAFLD具有一定的治疗作用, 其机制可能与其能够下调脂肪肝组织LXRα及其下游SREBP-1c的表达有关.
流行病学研究认为, 2型糖尿病患者有着比正常人更高的NAFLD患病率. 如何防治NAFLD将成为糖尿病科研工作中不可忽视的重要环节. 肝X受体α(LXRα)是目前研究发现的与NAFLD的发生发展密切相关的一种核转录因子, 其可通过上调其下游与脂质合成相关的基因(如SREBP-1c)的表达, 促进脂质在肝脏沉积, 从而与NAFLD的发生和发展密切相关.
王学美, 研究员, 北京大学第一医院中西医结合研究室
研发前沿 虽然2型糖尿病并发NAFLD机制尚未明确, 但脂质代谢紊乱被认为是2型糖尿病并发NAFLD重要的病理基础. 纠正脂质代谢紊乱, 减轻肝脏脂质沉积,对2型糖尿病并发的NAFLD具有重要的治疗意义.
国内外的研究发现, NAFLD患者和NAFLD模型大鼠肝脏LXRα的表达均明显高于正常对照组, 且在NAFLD患者中, LXRα的表达与SREBP-1c的表达密切相关而与CHREBP关系不大.
本研究证实贞清方对改善2型糖尿病的糖脂水平、治疗糖尿病性NAFLD方面确有疗效, 而且贞清方对糖尿病性NAFLD治疗作用可能与他能够下调肝脏LXRα的表达有关.
固醇调节元件结合蛋白(SREBPs): 是一类位于内质网上的膜连接蛋白, 是脂代谢通路的关键信号传导分子之一. SREBPs有两类: SREBP-1和SREBP-2, SREBP-1有两个亚型: SREBP-1a 和SREBP-1c.
本研究设计严谨, 科学性较强, 实验方法及数据可信, 结论正确, 学术价值较好.
编辑: 李军亮 电编:何基才
| 1. | Leite NC, Salles GF, Araujo AL, Villela-Nogueira CA, Cardoso CR. Prevalence and associated factors of non-alcoholic fatty liver disease in patients with type-2 diabetes mellitus. Liver Int. 2009;29:113-119. [PubMed] |
| 2. | Chawla A, Repa JJ, Evans RM, Mangelsdorf DJ. Nuclear receptors and lipid physiology: opening the X-files. Science. 2001;294:1866-1870. [PubMed] [DOI] |
| 3. | Higuchi N, Kato M, Shundo Y, Tajiri H, Tanaka M, Yamashita N, Kohjima M, Kotoh K, Nakamuta M, Takayanagi R. Liver X receptor in cooperation with SREBP-1c is a major lipid synthesis regulator in nonalcoholic fatty liver disease. Hepatol Res. 2008;38:1122-1129. [PubMed] [DOI] |
| 5. | 郑 龙轶, 文 秀英, 许 明望, 刘 浩, 孙 立敏, 陈 斌, 熊 亮. 贞清方对2型糖尿病大鼠肾组织基质金属蛋白酶-9和基质金属蛋白酶组织抑制物-1表达的调节作用. 中国中西医结合杂志. 2006;26:72-76. |
| 7. | 钟 岚, 范 建高. 非酒精性脂肪肝动物模型. 国外医学·消化系疾病分册. 1999;19:175-178. |
| 8. | 胡 爱民, 肖 凤英, 郑 云. 2型糖尿病并脂肪肝实验性大鼠模型的建立及评价. 中国中西医结合消化杂志. 2006;14:156-159. |
| 10. | Raszeja-Wyszomirska J, Lawniczak M, Marlicz W, Miezyńska-Kurtycz J, Milkiewicz P. [Non-alcoholic fatty liver disease--new view]. Pol Merkur Lekarski. 2008;24:568-571. [PubMed] |
| 11. | Lewis GF, Carpentier A, Adeli K, Giacca A. Disordered fat storage and mobilization in the pathogenesis of insulin resistance and type 2 diabetes. Endocr Rev. 2002;23:201-229. [PubMed] [DOI] |
| 12. | Yoshikawa T, Shimano H, Amemiya-Kudo M, Yahagi N, Hasty AH, Matsuzaka T, Okazaki H, Tamura Y, Iizuka Y, Ohashi K. Identification of liver X receptor-retinoid X receptor as an activator of the sterol regulatory element-binding protein 1c gene promoter. Mol Cell Biol. 2001;21:2991-3000. [PubMed] [DOI] |
| 13. | Dentin R, Girard J, Postic C. Carbohydrate responsive element binding protein (ChREBP) and sterol regulatory element binding protein-1c (SREBP-1c): two key regulators of glucose metabolism and lipid synthesis in liver. Biochimie. 2005;87:81-86. [PubMed] [DOI] |
| 14. | Cha JY, Repa JJ. The liver X receptor (LXR) and hepatic lipogenesis. The carbohydrate-response element-binding protein is a target gene of LXR. J Biol Chem. 2007;282:743-751. [PubMed] [DOI] |
| 15. | Wang B, Cheng LJ, Gao ZN, Zhang XY, Huo M, Zhang DJ, Wu J, Wei MF. [Activation of liver X receptor regulates fatty acid synthase expression in diabetic liver]. Zhonghua Yixue Zazhi. 2008;88:848-852. [PubMed] |