修回日期: 2009-03-20
接受日期: 2009-03-23
在线出版日期: 2009-05-18
目的: 探讨p21WAF1(p21)基因转染对食管鳞癌细胞系EC109细胞增殖的影响.
方法: 根据转染质粒的不同和是否进行质粒转染分为3组. p21转染组: 用脂质体Lipofectamine2000介导将pCDNA3.1(+)-p21质粒转染入EC109细胞; 空载体转染组: 同样方法将pCDNA3.1(+)-neo质粒转染入EC109细胞; 未转染组: 未转染的EC109细胞. 应用RT-PCR、Western blot分别检测p21基因mRNA、P21蛋白变化; 流式细胞仪分析细胞周期变化, 应用MTT、流式细胞仪和透射电镜检测转染外源p21基因对EC109细胞增殖和凋亡的影响.
结果: p21转染细胞中p21 mRNA和P21蛋白高表达; p21转染组EC109细胞生长速度低于空载体组和未转染组; 流式细胞仪观察到P21蛋白高表达使EC109细胞发生G1/S阻滞, G1期细胞比例显著高于空载体组和未转染组(63.120%±2.893% vs 41.380%±6.536%, 42.173%±5.301%, 均P<0.01), S期比例显著低于空载体组和未转染组(18.923%±3.084% vs 22.573%±5.463%, 26.867%±2.922%, 均P<0.01), 并出现亚G1峰(凋亡峰). 透射电镜亦发现p21转染组发生细胞凋亡.
结论: p21基因转染可以抑制人食管鳞癌细胞系EC109细胞增殖并能诱导其发生细胞凋亡.
引文著录: 张学彦, 景德怀, 刘志强, 关景明, 刘伟. p21WAF1基因对人食管鳞癌细胞增殖的抑制作用. 世界华人消化杂志 2009; 17(14): 1384-1389
Revised: March 20, 2009
Accepted: March 23, 2009
Published online: May 18, 2009
AIM: To investigate the effect of p21WAF1 (p21) gene transfection on the proliferation of cell line EC109in esophageal squamous cell carcinoma.
METHODS: Based on transfection plasmid and presence of the transfection, 3 groups were randomized. In p21 transfection group, pCDNA3.1(+)-p21 was transfected into EC109 cell by the vector of Lipofectamine2000; in empty plasmid transfection group, pCDNA3.1(+)-neo plasmid was transfected into EC109 cell using the above-mentioned method; in non-transfection group, the EC109 cell was not transfected. The p21 gene mRNA and P21 protein expression were assayed using PCR and Western blot. The proliferation and apoptosis were studied using MTT, flow cytometry and transmission electron microscopy.
RESULTS: In p21 transfection group, the expressions of p21 mRNA and P21 protein were at a high level. The cell growth was inhibited. With high protein expression of P21, EC109 cell cycle was arrested in G1/S phase, the cell ratio in G1 phase was significantly increased, compared with either empty plasmid transfection group or non-transfection group (63.120% ± 2.893% vs 41.380% ± 6.536%, 42.173% ± 5.301%, both P < 0.01). The number in S phase was significantly lower than the other two groups (18.923% ± 3.084% vs 22.573% ± 5.463%, 26.867% ± 2.922%, both P < 0.01), and G1 sub-peak (apoptosis peak) appeared. Apoptosis was also found under transmission electron microscope in the pCDNA3.1(+)-p21 transfection group EC109 cells.
CONCLUSION: After p21 gene transfection EC109 cell proliferation could be significantly arrested and apoptosis could be induced in vitro.
- Citation: Zhang XY, Jing DH, Liu ZQ, Guan JM, Liu W. Effect of p21WAF1 gene transfection on the proliferation of human esophageal squamous carcinoma cells. Shijie Huaren Xiaohua Zazhi 2009; 17(14): 1384-1389
- URL: https://www.wjgnet.com/1009-3079/full/v17/i14/1384.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i14.1384
p21WAF1(简称p21)是近年来发现的细胞周期蛋白依赖性激酶抑制因子(cyclin-dependent kinase inhibitors, CKI)家族中的一个新成员. 已经证实p21是食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)发生过程中经常失活的靶基因, 与食管鳞癌的发生, 发展及组织学类型密切相关[1]. 为探讨恢复p21表达是否有抑制人食管鳞癌细胞增殖的作用, 我们采用脂质体介导的基因转染技术, 将p21转染到人食管鳞癌细胞系EC109中, 以研究其对食管鳞癌细胞生长的影响.
委托上海生工公司全基因合成p21的插入片段, 克隆构建p21真核表达质粒pcDNA3.1(+)-p21. EC109细胞株购自中国科学院上海细胞所. TRIzol试剂盒为Gibco公司产品, Taq酶为上海生工公司产品, 逆转录试剂盒、限制性内切酶、转染级质粒中提试剂盒是Promega公司产品. p21小鼠抗人单抗是Neo Markers公司产品. 辣根酶标山羊抗小鼠IgG为北京中杉金桥公司产品. Actin beta(ACTB)抗体和Western blot发光试剂是Santa Cruz公司产品. 脂质体Lipofectamine2000购于Invitrogen公司. T4连接酶是MBI公司产品. 凝胶回收试剂盒是上海生工公司产品. 上海生工公司进行质粒测序和引物合成.
1.2.1 细胞培养: 人食管癌EC109细胞系在37℃, 50 mL/L CO2饱和湿度条件下, 用含100 mL/L胎牛血清的DMEM高糖培养基培养传代, 取对数生长期细胞进行相关实验.
1.2.2 p21真核表达质粒的克隆: 制备p21的插入片段, 两端设计加上BamHⅠ和EcoRⅠ酶切位点, 对此插入片段和pCDNA3.1(+)空载体进行BamHⅠ和EcoRⅠ双酶切, 琼脂糖凝胶电泳, 回收酶切产物, 使用T4 DNA连接酶连接p21目的片段和pCDNA3.1(+)载体. 将连接产物转化感受态大肠杆菌DH5α, 挑取单克隆, 双酶切鉴定后用PCDNA3.1(+)载体的测序引物T7测序.
1.2.3 RT-PCR检测EC109细胞p21 mRNA表达: 用TRIzol试剂盒提取细胞总RNA. 逆转录cDNA第1链合成: 反应体系20 μL, 含随机引物0.5 μg, 逆转录酶200 U, RNA 1.0 μg, dNTP 0.5 mmol/L, RNasin 20 U, 37℃ 60 min, 95℃ 5 min. PCR反应: 反应体系25 μL, 含Mg2+ 2.5 mmol/L, dNTP 0.5 mmol/L, cDNA 2 μL, Taq DNA合成酶2 U, 上下游引物各0.4 μmol/L, p21引物(退火56℃, 产物218 bp): 上游:5'-TGTCCGTCAGAACCCATG-3', 下游: 5'-GTGGGAAGGTAGAGCTTGG-3'.β-actin引物(退火56℃, 产物100 bp): 上游: 5'-CCCAGCACAATGAAGATCAAGATCAT-3', 下游: 5'-ATCTGCTGGAAGGTGGACAGCGA-3'. 反应35个循环. 产物经12 g/L琼脂糖凝胶电泳, 照相.
1.2.4 基因转染: (1)分组: 根据转染质粒的不同和是否进行质粒转染分为3组, 每组3个样本. p21转染组: 采用Lipofectamine2000脂质体介导转染, 将pCDNA3.1(+)-p21真核表达质粒导入EC109细胞; 空载体转染组: 用pCDNA3.1(+)-neo空载体以上述相同方法转染, 作为阴性对照; 未转染组: 不进行转染的同期培养的EC109细胞, 作为空白对照. (2)转染方法: 按照Lipofectamine2000说明书进行. 采用6孔板转染细胞, 每孔用2 mL无抗生素生长培养基含5×105个细胞制板, 每孔用5 μg DNA, 15 μL Lipofectamine2000. 转染48 h后加入G418终浓度为400 mg/L的选择培养基. 每2-4 d更换培养基, 4 wk后挑选阳性克隆扩大培养. (3)转染细胞p21基因检测: RT-PCR检测p21基因方法同1.2.3; Western blot检测外源P21蛋白. 提取细胞总蛋白, 用Bradford法定量. 50 g/L积层胶、120 g/L SDS-聚丙烯酰胺凝胶电泳, 转膜, 进行一抗、酶标二抗孵育和显色, 并照相.
1.2.5 生长曲线(MTT法): 取对数生长期细胞按3×106/L接种96孔板, 每孔加入MTT溶液(5 g/L)20 μL, 37℃温育4 h, 每孔加入180 μL二甲基亚砜, 振荡10 min, 选490 nm波长, 在酶标仪上测定吸光度值, 每隔24 h测定1次, 连续测定7 d, 绘制细胞生长曲线, 计算生长抑制率. 生长抑制率 = (对照组A值-实验组A值)/对照组A值×100%.
1.2.6 流式细胞仪检测: 取各组细胞, 每组1×106个细胞, 用磷酸缓冲液(PBS)洗2次, 加入700 mL/L冷乙醇4℃固定24 h, PBS洗2次, 用RNA酶(50 mg/L)于37℃处理30 min, 加碘化丙啶(100 mg/L)染色, 避光30 min, 进行流式细胞仪测定.
1.2.7 透射电镜: 取各组细胞, 每组1×106个细胞, 用PBS洗2次, 1500 r/min离心10 min, 加入30 g/L戊二醛固定1 wk, 按常规制备电镜标本, 送透射电镜检测.
统计学处理 数据以mean±SD表示, 应用SPSS11.0统计软件, 采用单因素方差分析, 多个均数之间两两比较q检验.
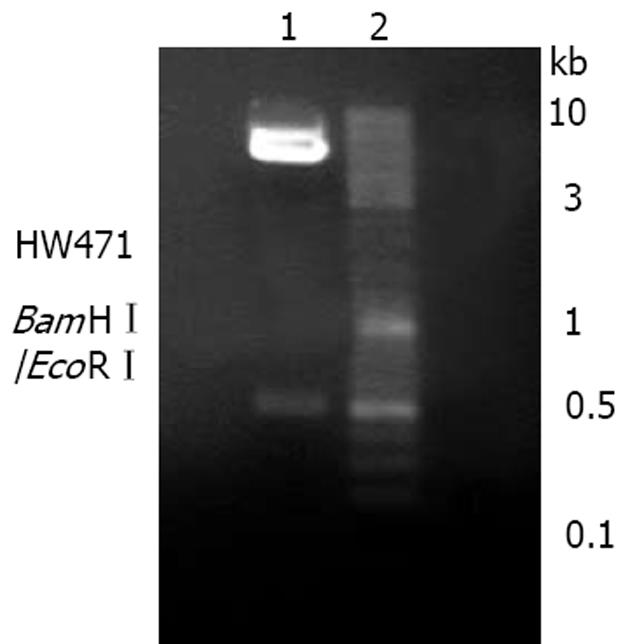
2.1.1 限制性内切酶BamHⅠ和EcoRⅠ双酶切鉴定: 可见重组质粒约5.9 kb, 双酶切后产生约5.4 kb, 471 bp的2个片段, 分别为pcDNA3.1(+)载体及目的片段, 证明已将目的基因克隆入pcDNA3.1(+)载体(图1).
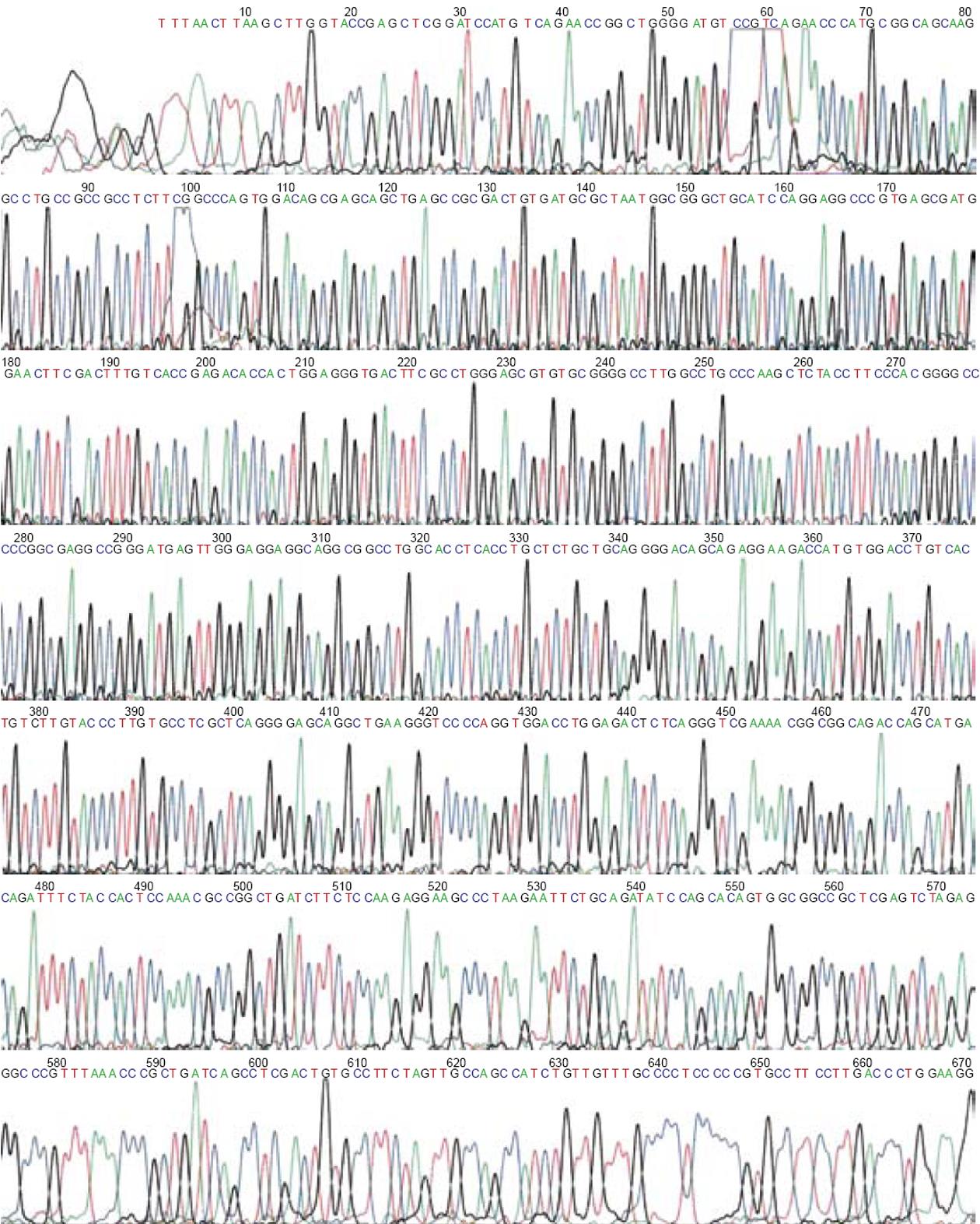
2.1.2 T7测序结果: 测序结果与GenBank比对, 证明pcDNA3.1(+)中插入片段为Homo sapiens cyclin-dependent kinase inhibitor 1A(p21, Cip1)(CDKN1A), transcript variant 1, mRNA. NM_000389.2; GI: 17978496. 无碱基序列突变(图2).
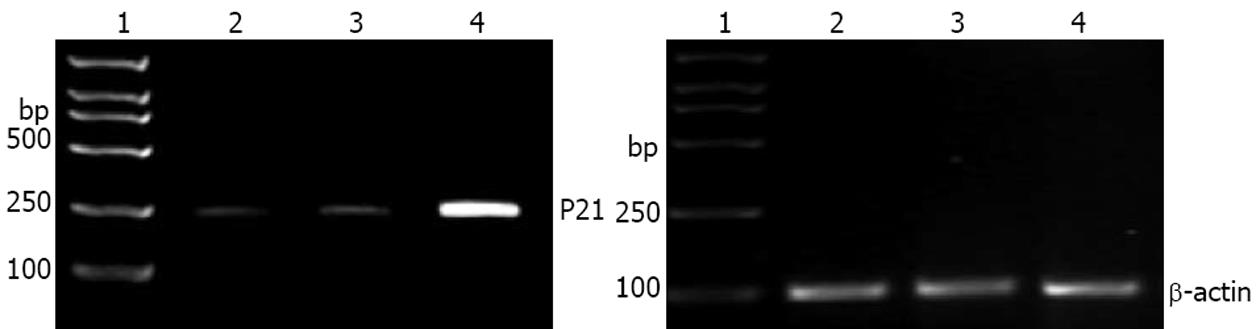
2.2.1 p21 mRNA表达: RT-PCR发现未转染组和空载体转染EC109细胞p21 mRNA低表达, 而在p21转染细胞中p21基因mRNA高表达, 扩增得到218 bp片段, 可证明p21已成功转染入受体癌细胞并可高表达(图3).
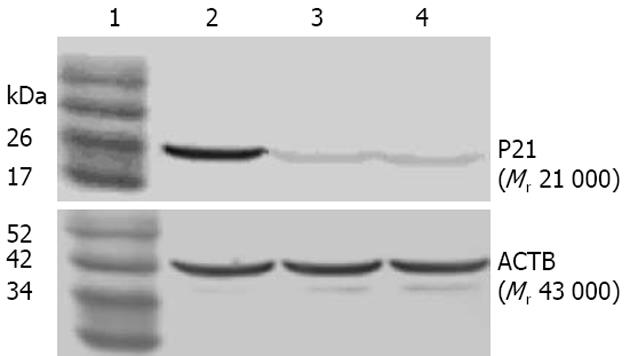
2.2.2 外源性P21蛋白检测: Western blot证实未转染和空载体转染组P21蛋白低表达, P21转染组P21蛋白高表达, 可证明p21已成功转染入受体癌细胞并可高表达P21蛋白(图4).
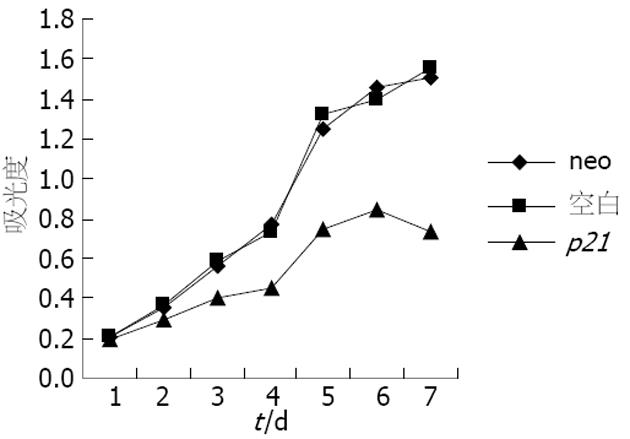
通过比较3种细胞的生长曲线, 可以看出空载体转染组和未转染组细胞的生长曲线较为接近, 而p21转染组细胞的生长曲线则位于前两者的下方, 说明neo转染后其增殖特性未受影响, 细胞在转染p21基因后其增殖特性受到抑制. 在第2天增殖开始被抑制, 生长抑制率为17.9%, 随时间延长抑制率逐渐升高, 至第7天生长抑制率达50.8%(图5).
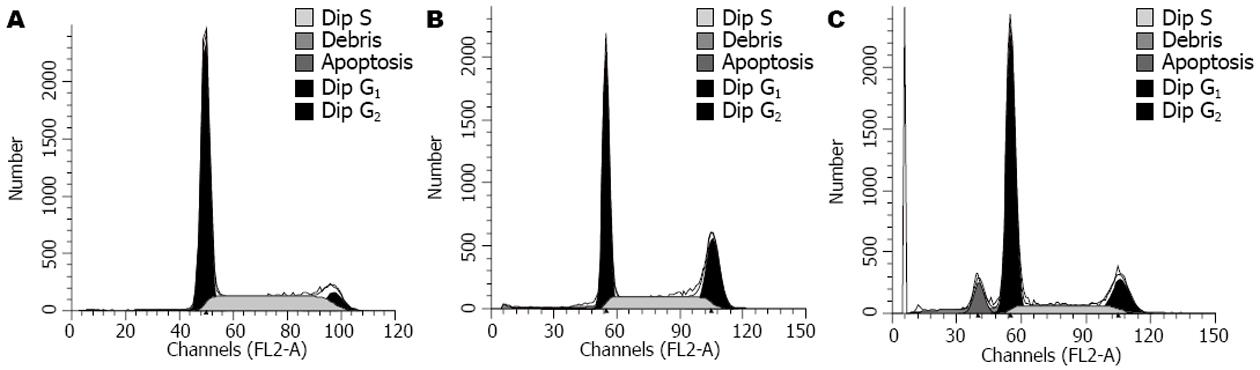
与亲本细胞比较, P21蛋白高表达使EC109细胞发生G1/S阻滞, G1期细胞比例显著高于空载体组和未转染组(63.120%±2.893% vs 41.380%±6.536%, 42.173%±5.301%, P<0.01), S期比例显著低于空载体组和未转染组(18.923±3.084% vs 22.573±5.463%, 26.867±2.922%, P<0.01), 并出现亚G1峰(凋亡峰)(图6, 表1).
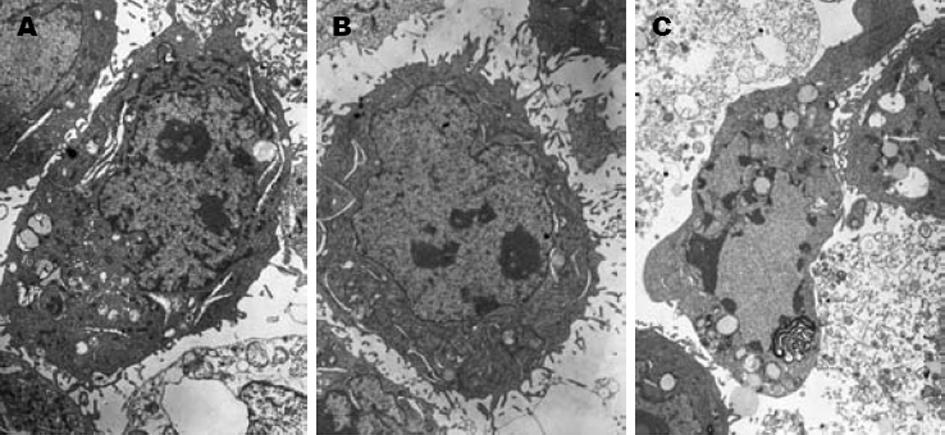
空白对照及空载体转染组: 细胞生长状态较好, 未见凋亡形态学改变, 核浆比例大, 圆形核仁多, 细胞表面绒毛密集排列, 双层核膜结构清晰, 胞质内有丰富的游离核蛋白体. p21转染组: 可见部分细胞发生凋亡, 细胞体积变小, 表面绒毛消失, 核固缩, 染色质形成高密度斑块. 细胞内有大量脂滴出现, 胞质内出现大量脂肪滴颗粒, 双层核膜结构清晰, 部分线粒体出现髓样变, 游离核糖体减少(图7).
食管癌是最常见的消化系统恶性肿瘤之一, 我国是世界上食管癌发病率和死亡率最高的国家. 鳞癌是最多见的组织学类型[2], 占90%以上. 基因治疗是当今攻克癌症的主要研究方向, 探寻食管鳞癌新的基因治疗方法具有重要意义.
p21是近年来发现的一类CKI分子, 1编码由164个氨基酸残基组成的蛋白质, 相对分子质量为21 kDa, 是非常重要的抑癌基因. p21也称野生型p53激活片段1(wild-type p53 activated fragment 1, WAF1), 细胞周期蛋白依赖性激酶抑制因子1A(cyclin-dependent kinase inhibitor 1A, CDKN1A), 细胞周期蛋白依赖性激酶相互作用蛋白1[Cyclin dependent kinase (CDK) interacted protein 1, CIP1]; CDK2结合蛋白20(CDK2-associated protein-20, CAP20); 衰老细胞释放的抑制因子(senescent cell-derived inhibitor, SDI)等, 从不同角度反映了p21的功能. CIP与CAP反映其结合并抑制CDK, WAF1反映其受p53调控, SDI反映其防止衰老细胞进入细胞周期的功能. P21蛋白有C端和N端, C端抑制DNA复制必需因子-增殖细胞核抗原(proliferating-cell nuclear antigen, PCNA), N端抑制Cyclin-CDK, 并且N端Cyclin-CDK2抑制区也抑制细胞生长[3]. P21蛋白广泛地抑制各种Cyclin-CDK复合物, 如Cyclin D-CDK 4、CyclinE-CDK2和CyclinA-CDK2. 通过对CDK和PCNA的双重抑制作用, P21可阻止DNA受损后进入S期, 使细胞有足够的时间进行DNA修复, 从而阻止被损伤DNA的修复, 维持细胞遗传信息的稳定性[4]. 从而使得增殖细胞在G1向S期过渡受阻, 以便修复受损的DNA或最终导致细胞的凋亡. P21蛋白可以和增殖细胞核抗原(PCNA)结合形成复合物(p21.CyclinE.cdk2.PCNA四联复合物), 抑制Rb磷酸化, 从而抑制 DNA的复制而使细胞周期中止.
p21在人的肿瘤细胞表达可抑制肿瘤细胞的生长, 一旦p21表达缺失, 会导致正常的细胞周期控制能力丧失; 有p53基因突变或缺失的细胞, p21产生减少或缺乏, 不能通过调节CDK复合物活性与PCNA的DNA复制功能, 不能协调DNA复制与细胞周期进程, 或者产生异常的DNA复制, 从而导致基因组不稳定, 可导致细胞癌变[4]. 在胃癌、结肠癌、膀胱癌、卵巢癌和胆管癌中p21基因的表达与肿瘤的预后明显相关[5]. 通过改变p21基因的表达可以起到调节肿瘤生长的作用, 如陆丽华 et al[6]发现药物氧化苦参碱通过上调细胞周期负调控因子p21基因表达, 来发挥其抗结肠癌肿瘤细胞作用. 耿长新 et al[7]发现多烯紫杉醇使人肝癌细胞p21表达上调, 从而发挥对该肿瘤的生长抑制作用. 反之, 郭晓榕 et al[8]发现HBx基因可下调p21 mRNA的表达, 从而促进细胞增殖、抑制细胞凋亡.
p21基因失活在食管鳞癌发生发展机制中起着重要作用[9]. 王言飞 et al[1]发现P21蛋白的异常表达与食管鳞癌的发生, 发展及组织学类型、淋巴结转移TNM分期密切相关, 提示p21基因失活是食管癌发生发展过程中的早期分子事件. 说明p21基因在食管癌的调控机制中起负性调控作用, 其调节通路障碍可能参与了食管癌的发生, 其表达对于评估食管癌的恶性程度, 提示自然病程及预后有重要意义. 刘卫梅 et al[10]发现p21基因与食管鳞癌的分化程度、浸润深度均有关, 高分化者及浸润深度浅者, 其p21基因表达高于中低分化及深层浸润食管鳞癌, 认为p21基因检测可作为一种简单的方法评测食管癌的生物学行为及预后. Bahnassy et al[11]研究发现食管癌患者总生存率与p21阳性表达呈正相关. 上述发现说明用p21基因转染治疗食管鳞癌是可行的.
我们发现EC109细胞在转染p21基因而产生P21蛋白高表达后, 其增殖特性明显受到抑制. 在接种第2天增殖开始被抑制, 随时间延长抑制率逐渐升高, 至第7天与对照组比较生长抑制率达50.8%. 流式细胞仪检测发现有明显的G1/S期阻滞, 出现凋亡特征性的亚G1峰, 透射电镜亦发现细胞凋亡发生. 本研究提示p21转染对食管鳞癌有明显的生长抑制作用并能诱导细胞凋亡, 这为食管鳞癌的基因治疗提供了一种新途径, p21转染的优点是其片段长度小, 克隆和转染操作比较方便, 是具有应用前景的基因治疗的很好的靶基因.
p21是细胞周期蛋白依赖性激酶抑制因子(CKI)家族成员, 是食管鳞状细胞癌(ESCC)中经常失活的基因, 与食管鳞癌的发生, 发展密切相关. P21蛋白抑制DNA复制必需因子-增殖细胞核抗原(PCNA)和各种Cyclin-CDK复合物, 使得增殖细胞在G1向S期过渡受阻.
同行评议者 吕宾, 教授, 浙江中医学院附属医院(浙江省中医院、浙江省东方医院)消化科; 王健生, 教授, 西安交通大学医学院第一附属医院肿瘤外科
针对细胞周期进行的抗肿瘤治疗是研究热点, 基因治疗是抗肿瘤治疗的发展方向, 亟待解决的问题是选择何种恰当、有效的基因, 以何种安全、方便、有效的方式导入受体.
Bahnassy et al发现食管癌患者总生存率与p21阳性表达呈正相关. 刘卫梅 et al发现p21与食管鳞癌的分化程度、浸润深度有关, 认为p21基因检测可作为一种简单的方法评测食管癌的生物学行为及预后.
本研究将p21转染到人食管鳞癌细胞系EC109中, 研究其对食管鳞癌细胞生长的影响, 探讨恢复p21表达是否有抑制人食管鳞癌细胞增殖的作用, 这可能是食管鳞癌基因治疗的一种新途径.
本研究提示p21转染对食管鳞癌有明显的生长抑制作用并能诱导细胞凋亡, p21转染的优点是其片段长度小, 克隆和转染操作比较方便, 是具有应用前景的基因治疗的很好靶基因.
本研究设计合理, 方法先进, 结果表述清晰, 结论可靠, 学术价值较好.
编辑: 李军亮 电编:何基才
| 2. | Metzger R, Schneider PM, Warnecke-Eberz U, Brabender J, Hölscher AH. Molecular biology of esophageal cancer. Onkologie. 2004;27:200-206. [PubMed] [DOI] |
| 3. | Chen J, Jackson PK, Kirschner MW, Dutta A. Separate domains of p21 involved in the inhibition of Cdk kinase and PCNA. Nature. 1995;374:386-388. [PubMed] [DOI] |
| 4. | Datta K, Babbar P, Srivastava T, Sinha S, Chattopadhyay P. p53 dependent apoptosis in glioma cell lines in response to hydrogen peroxide induced oxidative stress. Int J Biochem Cell Biol. 2002;34:148-157. [PubMed] [DOI] |
| 5. | Rose SL, Goodheart MJ, DeYoung BR, Smith BJ, Buller RE. p21 expression predicts outcome in p53-null ovarian carcinoma. Clin Cancer Res. 2003;9:1028-1032. [PubMed] |
| 11. | Bahnassy AA, Zekri AR, Abdallah S, El-Shehaby AM, Sherif GM. Human papillomavirus infection in Egyptian esophageal carcinoma: correlation with p53, p21, mdm2, C-erbB2 and impact on survival. Pathol Int. 2005;55:53-62. [PubMed] [DOI] |