修回日期: 2009-04-01
接受日期: 2009-04-08
在线出版日期: 2009-05-08
目的: 探讨阿司匹林对肠上皮细胞增殖的影响及作用机制.
方法: 将不同浓度的阿司匹林溶液与肠上皮细胞株Caco-2细胞共同培养24 h及48 h, 采用MTT法检测阿司匹林对Caco-2细胞的增殖作用. 建立Caco-2单层细胞模型, 采用不同浓度阿司匹林溶液处理后, 用EVOM电压电阻仪测定细胞跨膜电阻抗(TER)变化.
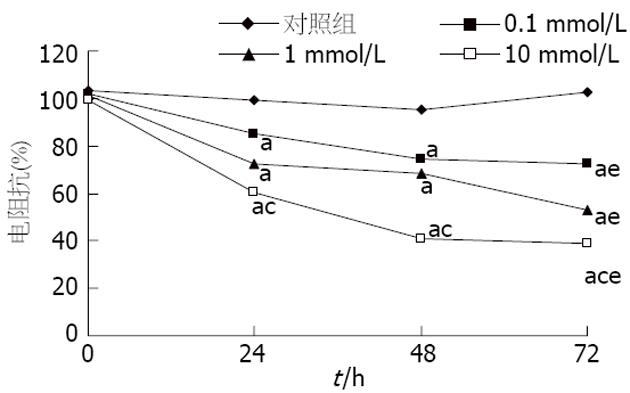
结果: 在不同浓度的阿司匹林(0、0.1、1、10 mmol/L)作用下, 24 h细胞存活率分别为96.67%±1.13%、84.32%±1.29%、62.33%±2.02%和42.99%±2.09%; 48 h细胞存活率分别为96.45%±1.21%、76.89±2.28%、50.28%±0.98%和32.66%±1.99%, 阿司匹林对Caco-2细胞的增殖作用呈现剂量-时间依赖性(P<0.05). 与对照组相比, 阿司匹林作用组TER明显降低, 至10 mmol/L组作用72 h时, TER值降低至50.1%.
结论: 阿司匹林可抑制肠上皮细胞的增殖, 同时损伤细胞屏障功能, 损伤紧密连接, 且以上两种作用呈剂量和时间依赖性.
引文著录: 安敏, 张振玉. 阿司匹林对肠上皮细胞的损伤作用及机制. 世界华人消化杂志 2009; 17(13): 1355-1358
Revised: April 1, 2009
Accepted: April 8, 2009
Published online: May 8, 2009
AIM: To investigate the effect and mechanism of aspirin on proliferation of enterocytes.
METHODS: After co-culture of aspirin solution with Caco-2 cells for 24 h and 48 h, the proliferation of Caco-2 cells in each group was examined using MTT. Caco-2 monolayer cells model was established. After treatment with different concentrations of aspirin , Transepithelial resistance (TER) of cells was measured by EVOM voltohmmeter.
RESULTS: After 24 h, the cell survival rates were 96.67% ± 1.13%, 84.32% ± 1.29%, 62.33% ± 2.02% and 42.99% ± 2.09% in groups with aspirin of 0, 0.1, 1, 10 mmol/L, respectively; after 48 h, the cell survival rates were respectively 96.45% ± 1.21%, 76.89% ± 2.28%, 50.28% ± 0.98% and 32.66% ± 1.99%. The TER in the group with aspirin of 10 mmol/L was reduced to 50.1% after 72 h. Multiple factors chi square test showed that the influence of aspirin on the proliferation of Caco-2 cells and the epithelial barrier was dose-dependent and time-dependent.
CONCLUSION: Aspirin could inhibit the proliferation of enterocyte and affect the epithelial barrier, in a dose-dependent and time-dependent manner.
- Citation: An M, Zhang ZY. Effects and mechanism of aspirin on enterocyte injury. Shijie Huaren Xiaohua Zazhi 2009; 17(13): 1355-1358
- URL: https://www.wjgnet.com/1009-3079/full/v17/i13/1355.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i13.1355
阿司匹林是最用的非甾体类抗炎药(non-steroidal anti-inflammatory drugs, NSAIDs)之一. 一般短期使用常用于缓解各种疼痛, 退热及手术期的镇痛; 长期则主要用于治疗类风湿性关节炎, 骨性关节炎等风湿性疾病, 而且近来常采用低剂量阿司匹林来临床用于预防心肌梗死、动脉血栓、动脉粥样硬化等心血管疾病. 近年研究证实阿司匹林还可预防结直肠癌[1]. 随着阿司匹林的临床应用的日趋广泛, 其消化系不良反应也日益受到关注[2]. 长期以来人们比较注意其引起的胃损伤, 但是近年来随着胶囊内镜、双气囊小肠镜等检查方式在临床的逐渐普及, 发现NSAIDs引起的肠道不良反应作用并不低, 可以引起小肠出血、蛋白丢失性肠病、回肠吸收功能障碍、肠通透性升高及结肠出血、穿孔等[3-5]. 所以, 对于长期服用阿司匹林的安全性应予以足够的重视. 本研究采用Caco-2细胞与阿司匹林共培养, 通过MTT法及Caco-2单层细胞跨膜电阻抗的测定, 研究阿司匹林对Caco-2细胞增殖的影响以及对细胞紧密连接屏障的作用, 探讨阿司匹林引起肠道损伤的机制.
Caco-2细胞细胞株由中国人民解放军南京军区总院普外科惠赠. DMEM高糖培养液为美国Hyclone公司生产. 新生小牛血清为杭州四季青公司生产. 阿司匹林购自山东新华制药股份有限公司, 批号为0702285. 噻唑蓝(MTT)、二甲基亚砜(DMSO)购自美国Sigma公司.
1.2.1 细胞培养: 将Caco-2细胞置于细胞培养瓶内, 以DMEM(dulbecco's modified eagle's medium)为培养液: 含4.5 g/L D-葡萄糖、L-谷氨酰胺, 不含丙酮酸钠和碳酸氢钠、1×105 U/L青霉素、100 mg/L链霉素、100 mL/L小牛血清, pH值为7.2. 在37℃、50 mL/L CO2培养箱中进行培养, 隔天更换培养液, 每3 d按1∶3比例传代, 实验时取对数生长期细胞.
1.2.2 MTT比色实验: 将处于对数生长期的细胞, 用2.5胰蛋白酶消化后, 以每孔2×104加入96孔培养板中, 每孔体积200 μL, 置于37℃, 50 mL/L CO2的培养箱中培养24 h后换上含不同浓度阿司匹林的培养液(0.1、1、10 mmol/L)180 μL, 每种浓度设6孔重复, 以不含阿司匹林的培养液180 μL为阴性对照, 分组继续培养24、48 h后, 每孔加入MTT 20 μL(5 g/L), 温浴4 h, 弃上清液, 每孔加入DMSO 150 μL, 室温避光摇床上充分振荡20 min, 混匀后以空白孔调零, 在酶标仪上检测490 nm波长吸光度值(A). 按下列公式计算细胞增殖抑制率. 细胞增殖抑制率 = (1-实验组A值/对照组A值)×100%. 经换算成细胞存活率. 每次实验重复3次.
1.2.3 跨膜电阻抗(TER)的测定: 用STX2双杆电极EVOM电压电阻仪测定单层细胞的跨膜电阻抗. Caco-2细胞以1×105/cm2接种于涂明胶的多聚碳膜Transwell培养板的顶层小室微孔膜上(直径6.5 mm, 孔径大小0.4 μm)培养. 当测定的TER值达到稳定后4 d, 进行实验处理. 处理分为4组, 即对照组, 0.1、1、10 mmol/L的阿司匹林处理组. 每个处理组取3个孔, 重复实验, 计算其平均值. 测定的TER结果, 用最初测定结果的百分比表示.
统计学处理 实验所得数据, 用Stata 9.0统计软件分析, 采用多因素卡方检验, P<0.05为差异有显著性意义.
随着阿司匹林作用浓度的增加及作用时间的延长, Caco-2细胞的生长抑制率逐渐升高, 即细胞存活率越来越低, 且这种作用呈现剂量-时间依赖性(表1, P<0.05).
为了确定阿司匹林是否对Caco-2细胞的屏障功能有直接的破坏作用, 本实验观察了阿司匹林对培养的Caco-2细胞的作用. 测定不同浓度阿司匹林作用不同时间的跨膜电阻抗(TER)变化(图1).
近年来, 大量的研究证实阿司匹林可以引起较多的不良反应[6], 尤其是胃肠道损害较为突出, 主要表现为黏膜糜烂和溃疡, 严重者可以发生出血或者穿孔. 但是阿司匹林对肠道的不良反应则研究较少[7]. 阿司匹林引起肠道损伤的可能机制有以下几点: (1)阿司匹林对肠黏膜有直接的化学刺激作用, 而且由于其肠肝循环特点, 从而延长了其与肠黏膜的接触时间. 肠腔内容物如细菌、胆盐、食物等可以进一步诱导损伤, 其中细菌可能是主要的侵袭因素. (2)阿司匹林选择性抑制环氧合酶COX尤其是COX-1的活性[8-9], 减少了内源性前列腺素的合成与释放, 破坏肠上皮黏膜的屏障作用, 引起肠内细菌及侵袭因子的侵入, 从而诱发新的炎性病灶的产生, 诱发旧的溃疡病灶复发. (3)阿司匹林可以诱导中性粒细胞在肠黏膜受损的部位聚集, 浸润, 从而加重受损部位的免疫损伤. (4)阿司匹林还可以促进一些炎性介质, 如肿瘤坏死因子(tumor necrosis factor, TNF)和白三烯(leukotriene, LT)的释放. 超过生理限度的TNF及LTB可以引起前列环素释放减少, 内皮素释放增加, 而内皮素则是强烈的缩血管因子. 二者比例失调, 可以影响受损黏膜的修复.
Caco-2细胞来源于人结肠癌细胞株, 以普通的培养条件培养成熟的Caco-2细胞可形成与小肠上皮细胞相同的细胞极性和致密的单细胞层组织, 其形态与人体的肠上皮细胞相似, 并且可以分泌与人体相同的酶类及转化因子等[10], 且与被动吸收的营养物质有较好的相关性, 临床常用于建立体外肠屏障模型[11].
本项研究利用MTT比色方法了解阿司匹林对Caco-2细胞的剂量及时间毒性情况. MTT还原物甲攒是能量代谢的反映, 其生成量随着细胞数的增多而增加[12-13]. 由本研究可以看出, 阿司匹林在实验给定浓度(0.1、1、10 mmol/L)条件下, 对Caco-2细胞的生长有显著的抑制作用, 且这种抑制作用随着作用时间和作用浓度的增加越来越明显. 这说明阿司匹林可以直接作用于肠上皮细胞, 引起肠上皮细胞的损伤. 此外本实验进一步测定Caco-2细胞单层细胞的跨膜电阻抗, 实验结果表明阿司匹林可以使TER值明显降低, 说明单层细胞的通透性升高, 即提示上皮细胞完整性可能已经遭到破坏. 肠黏膜屏障是肠道最重要的一道屏障, 由完整的肠上皮细胞和紧密连接构成. 阿司匹林对细胞屏障功能的破坏可能是由于破坏了细胞间的紧密连接而引起[14-15]. 这种可能的机制将在今后的实验中进一步证实.
本实验证明, 阿司匹林对肠上皮细胞有直接的杀伤作用, 且可以破坏上皮细胞屏障功能, 为进一步研究阿司匹林损伤肠上皮细胞屏障功能及其机制奠定了一定的实验基础.
阿司匹林是最用的非甾体类抗炎药(NSAIDs)之一. 随着阿司匹林的临床应用的日趋广泛, 其消化系不良反应也日益受到关注. 长期以来人们比较注意其引起的胃损伤.
王志刚, 副主任医师, 上海市第六人民医院普外科.
近年来随着胶囊内镜、双气囊小肠镜等检查方式在临床的逐渐普及, 发现NSAIDs引起的肠道不良反应作用并不低, 其可以引起小肠出血、蛋白丢失性肠病、回肠吸收功能障碍、肠通透性升高及结肠出血、穿孔等. 所以, 对于长期服用阿司匹林的安全性应予以足够的重视.
国外已有报道FHIT基因过表达能增加胰腺癌细胞系对外源性凋亡诱导剂的敏感性. 体内实验结果显示FHIT基因的转导能阻止肿瘤的生长, 延长模型小鼠的生存时间, 抑制暴露致癌环境下小鼠体内肿瘤的产生.
本研究采用Caco-2细胞与阿司匹林共培养, 通过MTT法及Caco-2单层细胞跨膜电阻抗的测定, 研究阿司匹林对Caco-2细胞增殖的影响以及对细胞紧密连接屏障的作用, 探讨阿司匹林引起肠道损伤的机制.
本研究紧密结合临床, 设计合理, 技术可行, 结果对临床工作具有一定的指导价值.
编辑: 李军亮 电编:何基才
| 2. | Takeuchi K, Hatazawa R, Tanigami M, Tanaka A, Ohno R, Yokota A. Role of endogenous nitric oxide (NO) and NO synthases in healing of indomethacin-induced intestinal ulcers in rats. Life Sci. 2007;80:329-336. [PubMed] [DOI] |
| 3. | Thiéfin G, Beaugerie L. Toxic effects of nonsteroidal antiinflammatory drugs on the small bowel, colon, and rectum. Joint Bone Spine. 2005;72:286-294. [PubMed] [DOI] |
| 4. | Bjarnason I, Takeuchi K, Simpson R. NSAIDs: the emperor's new dogma? Gut. 2003;52:1376-1378. [PubMed] [DOI] |
| 5. | Hawkey CJ. NSAIDs, coxibs, and the intestine. J Cardiovasc Pharmacol. 2006;47 Suppl 1:S72-S75. [PubMed] [DOI] |
| 6. | Somasundaram S, Sigthorsson G, Simpson RJ, Watts J, Jacob M, Tavares IA, Rafi S, Roseth A, Foster R, Price AB. Uncoupling of intestinal mitochondrial oxidative phosphorylation and inhibition of cyclooxygenase are required for the development of NSAID-enteropathy in the rat. Aliment Pharmacol Ther. 2000;14:639-650. [PubMed] [DOI] |
| 7. | Goltsov A, Maryashkin A, Swat M, Kosinsky Y, Humphery-Smith I, Demin O, Goryanin I, Lebedeva G. Kinetic modelling of NSAID action on COX-1: focus on in vitro/in vivo aspects and drug combinations. Eur J Pharm Sci. 2009;36:122-136. [PubMed] [DOI] |
| 8. | Yokomizo A, Moriwaki M. Transepithelial permeability of myricitrin and its degradation by simulated digestion in human intestinal Caco-2 cell monolayer. Biosci Biotechnol Biochem. 2005;69:1774-1776. [PubMed] [DOI] |
| 9. | Cruz N, Qi L, Alvarez X, Berg RD, Deitch EA. The Caco-2 cell monolayer system as an in vitro model for studying bacterial-enterocyte interactions and bacterial translocation. J Burn Care Rehabil. 1994;15:207-212. [PubMed] [DOI] |
| 10. | Adebayo D, Bjarnason I. Is non-steroidal anti-inflammaory drug (NSAID) enteropathy clinically more important than NSAID gastropathy? Postgrad Med J. 2006;82:186-191. [PubMed] [DOI] |
| 12. | Czyzewski K, Styczynski J. Imatinib is a substrate for various multidrug resistance proteins. Neoplasma. 2009;56:202-207. [PubMed] |
| 13. | Motskin M, Wright DM, Muller K, Kyle N, Gard TG, Porter AE, Skepper JN. Hydroxyapatite nano and microparticles: Correlation of particle properties with cytotoxicity and biostability. Biomaterials. 2009; Mar 20. [Epub ahead of print]. [PubMed] |
| 14. | Oshima T, Miwa H, Joh T. Aspirin induces gastric epithelial barrier dysfunction by activating p38 MAPK via claudin-7. Am J Physiol Cell Physiol. 2008;295:C800-C806. [PubMed] [DOI] |