修回日期: 2009-04-28
接受日期: 2009-05-05
在线出版日期: 2009-05-08
目的: 探讨血管内皮生长因子(VEGF-C)和胶原三股螺旋重复蛋白1(CTHRC1)在直肠癌组织中的表达特点及二者的相关性.
方法: 收集我院2004-10/2006-08手术切除的直肠癌病理标本98例, 术前均未行任何治疗. 采用免疫组织化学方法检测VEGF-C和CTHRC1的表达. 分析他们的表达与患者年龄、性别以及直肠癌分化程度、临床分期及淋巴结转移的关系.
结果: VEGF-C主要分布于肿瘤细胞中, 其表达与直肠癌分化程度、临床分期及淋巴结转移密切相关(P<0.05); CTRHC1表达与直肠癌分化程度、临床分期密切相关(P<0.05), 二者与直肠癌发生的年龄、性别无明显相关. 此外, CTRHC1与VEGF-C的表达量呈正相关(r = 0.629, P<0.001).
结论: VEGF-C和CTHRC1在直肠癌侵袭转移中可能起重要作用, 二者的表达可作为判定直肠癌生物学行为的参考指标.
引文著录: 李靖涛, 赵洪川, 高春, 姚力, 陈少轩, 姚树坤. CTHRC1和VEGF-C在直肠癌组织中的表达及相关性. 世界华人消化杂志 2009; 17(13): 1318-1323
Revised: April 28, 2009
Accepted: May 5, 2009
Published online: May 8, 2009
AIM: To study expression and correlation between CTHRC1 and VEGF-C in human rectal carcinoma.
METHODS: Ninety-eight patients diagnosed with rectal carcinoma at China-Japan Friendship Hospital from October 2004 to August 2008, were included in our study. No treatment was given before surgery and the specimens were collected after surgery. The expression of CTHRC1 and VEGF-C was examined by immunohistochemistry and the correlation with clinical characteristics was analyzed by SPSS10.0.
RESULTS: VEGF-C was mainly located in the tumor cells, and its expression was statistically correlated with tumor differentiation, clinical stages and lymph metastasis (P < 0.05). The expression of CTRHC1 was correlated with the clinical stages and tumor differentiation (P < 0.05), both of the expressions had no correlation with the age or gender of patients. Moreover, a positive correlation was observed between VEGF-C and CTHRC1 by correlative analysis (r = 0.629, P < 0.001).
CONCLUSION: CTHRC1 and VEGF-C may play important roles in invasion and metastasis in human rectal carcinoma. The two biomarkers can be applied to assess the malignancy of rectal cancer.
- Citation: Li JT, Zhao HC, Gao C, Yao L, Chen SX, Yao SK. Expression and correlation between CTHRC1 and VEGF-C in human rectal carcinoma. Shijie Huaren Xiaohua Zazhi 2009; 17(13): 1318-1323
- URL: https://www.wjgnet.com/1009-3079/full/v17/i13/1318.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i13.1318
直肠癌是我国常见的恶性肿瘤之一, 近年来其发病率有明显增高趋势[1]. 血管内皮生长因子C(vascular endothelial growth factor-C, VEGF-C)已经被研究证实可以通过促进血管形成和诱导淋巴管生成等机制参与肿瘤的发生、发展. 胶原三股螺旋重复蛋白1(collagen triple helix repeat containing 1, CTHRC1)也被体外实验证实能够提高细胞的迁移能力[2], 但其在直肠癌组织中的表达报道较少. 本研究采用免疫组织化学方法研究直肠癌组织中VEGF-C和CTHRC1的表达, 并进行相关性分析, 初步探讨VEGF-C和CTHRC1在直肠癌发生、发展中的作用.
收集我院2004-10/2006-08手术切除的直肠癌病理标本98例, 男54例, 女44例, 年龄35-90(62.88±10.2)岁, 术前均未行任何治疗. 临床分期: Ⅰ期20例, Ⅱ期24例, Ⅲ期54例. 病理分期: T1N0 6例, T2N0 14例, T3N0 21例, T4N0 3例, T2N1 3例, T3N1 8例, T4N1 43例. 病理类型: 高分化腺癌14例, 中分化腺癌57例, 低分化腺癌27例. 兔抗人VEGF-C pAb(ZA-0266)、二步法检测试剂盒(K86815B)、DAB显色试剂盒(ZLI-9018)为中杉金桥产品. 兔抗人CTHRC1 pAb(ab54181-100)为Abcam公司产品.
1.2.1 免疫组织化学法: 组织常规石蜡包埋, 连续作厚4 μm的切片. 免疫组织化学实验采用SP法, 操作过程严格参照说明书进行, 阳性对照使用由既往实验证实的阳性组织, 阴性对照使用PBS代替一抗.
1.2.2 图像分析: 阳性信号为棕黄色细小颗粒, 表达强度根据细胞着色强弱和着色细胞比例综合确定, 在200倍, 5个及以上视野下按切片中细胞染色强度记分: 0分为细胞无染色, 1分为染色呈浅黄色, 2分为染色呈棕黄色, 3分为染色呈褐色; 再按切片中显色细胞所占比例记分: 0分为无阳性染色细胞, 1分为染色细胞占总数的30%以下, 2分为30%-70%, 3分为70%以上细胞染色. 每张切片肿瘤细胞染色积分为: 强度计分×比例记分.
统计学处理 实验结果用mean±SD表示, 应用SPSS10.0统计软件根据数据性质, 分别应用t检验、方差分析、Pearson相关分析等方法分析, P<0.05表示差异显著有统计学意义.
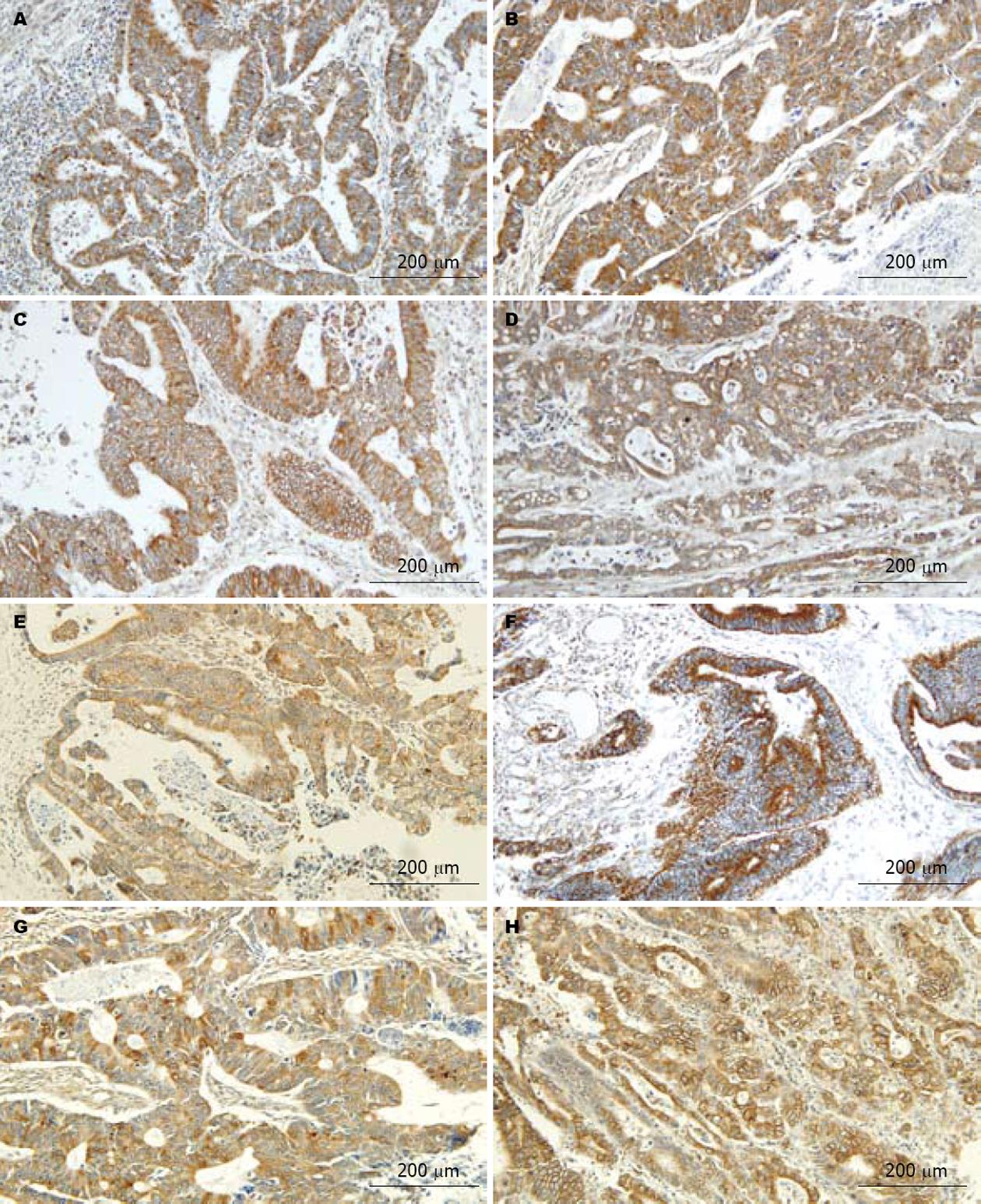
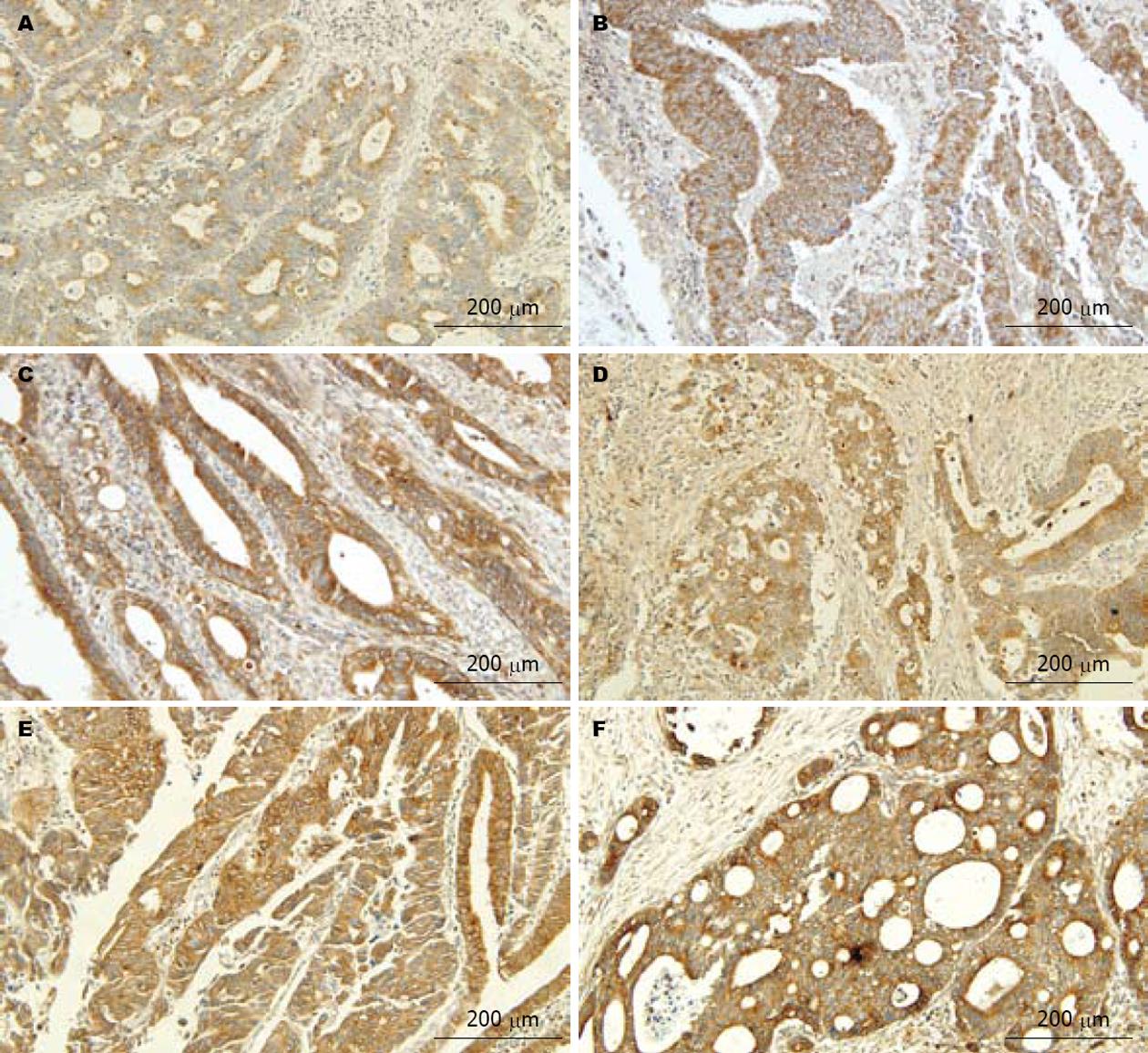
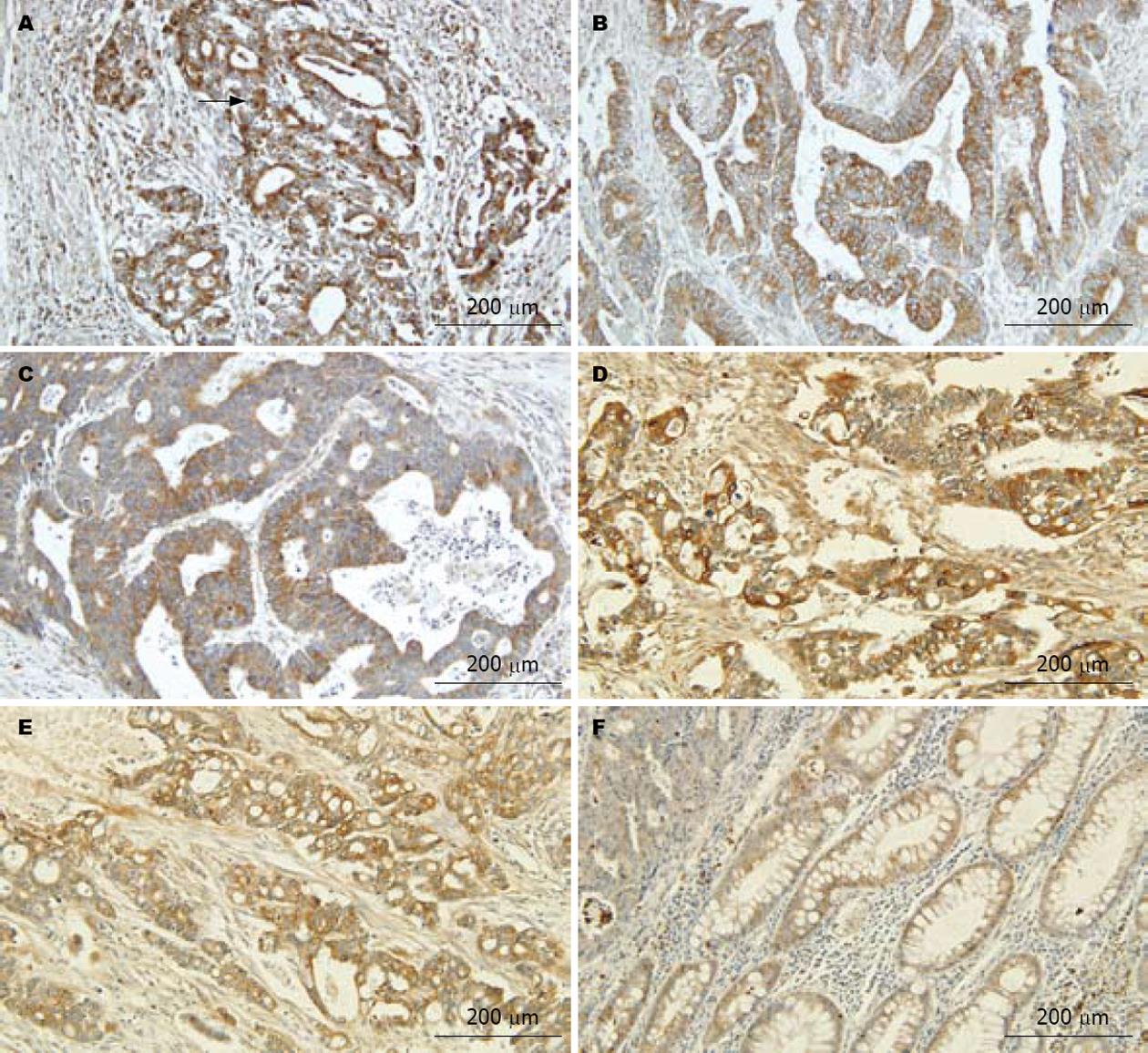
CTHRC1、VEGF-C阳性物质呈棕黄色细颗粒状, 在癌组织中, 主要定位于癌细胞的胞膜和(或)胞质, 少数病例癌细胞胞核着色, 血管内皮细胞上未见VEGF-C染色(图1-3).
VEGF-C积分与CTHRC1积分间具有一定正相关性(r = 0.629, P<0.001); 年龄与VEGF-C、CTHRC1积分无明显相关.
t检验结果显示, 不同性别之间VEGF-C积分(t = 0.40, P = 0.688)、CTHRC1积分(t = 0.33, P = 0.745)均无显著性差异(表1).
| 性别 | n | VEGF-C | CTHRC1 |
| M | 55 | 4.82±5.36 | 5.84±6.35 |
| F | 43 | 4.64±5.20 | 5.72±6.23 |
VEGF-C积分在T分期之间无显著性差异(图1A, C和E), 在N分期之间有显著性差异, N1积分值>N0积分值(P<0.001, 图1A-F). CHTRC1积分在不同TN分期间无显著性差异(表2, 图1G-H).
| T分期 | N分期 | n | VEGF-C | CHTRC1 |
| T1 | N0 | 6 | 3.54±1.34 | 4.10±0.77 |
| T2 | N0 | 14 | 3.27±1.73 | 5.24±1.66 |
| T2 | N1 | 3 | 6.20±1.93 | 7.20±0.60 |
| T3 | N0 | 21 | 4.05±1.47 | 4.89±1.63 |
| T3 | N1 | 8 | 6.03±0.85 | 7.38±1.23 |
| T4 | N0 | 3 | 5.00±0.34 | 7.27±0.50 |
| T4 | N1 | 43 | 6.63±1.26 | 7.31±1.11 |
直肠癌是我国常见的恶性肿瘤之一, 因其易发生转移和扩散、术后复发转移率较高, 探索其转移机制一直是众多学者的研究重点[3]. 肿瘤血管形成和淋巴管生成对肿瘤的生长及转移有重要作用, 并受多种细胞因子的诱导和调节, VEGF-C是其中重要的因子之一. VEGF-C的表达已经被研究证实可能与肿瘤的预后密切相关[4-7]. 本研究发现VEGF-C的表达与直肠癌的分化程度和临床分期密切相关, 与既往结论基本一致. Zheng et al[8]的研究中也发现VEGF-C表达与直肠癌分化程度密切相关, 随着直肠癌分化程度降低, VEGF-C表达增强. 汪美华 et al研究结果表明VEGF-C表达与结肠癌病理分级无关, 其原因可能与仅将结肠癌病理分为高、低分化两级或所用分析方法不一致有关[9-10].
本研究还发现VEGF-C的表达与性别、年龄在统计学上无明显相关, 但与淋巴结转移密切相关. VEGF-C的表达在不同性别和不同年龄无明显差异, 与文献[11-12]报道基本一致. 但De Vita et al在研究中发现[12], 血清中VEGF-C水平与年龄呈负相关, 其原因可能与所选择标本有关, 血清中的VEGF-C表达可能与直肠癌组织有差异. 目前已有研究发现VEGF-C过度表达的肿瘤细胞具有较高的局部淋巴结转移率[13], 本研究在直肠癌组织中证实了上述观点. 我们的研究结果显示VEGF-C的表达与淋巴结转移有显著的相关性, 并与直肠癌组织的临床分期密切相关, 也许VEGF-C可以作为评价直肠癌预后的独立危险因素.
对于VEGF-C在肿瘤组织的表达部位及作用方式, 目前文献报道不一. Wizigmann-Voos et al[14]认为VEGF-C主要表达于肿瘤细胞, Brown et al却发现VEGF-C不仅表达于肿瘤细胞, 也可表达于血管内皮细胞[15-16]. 我们的研究结果发现, VEGF-C主要表达于直肠癌细胞中, 在肿瘤血管内皮细胞中并无明显表达. 结合目前已经明确的作用机制, 我们推测VEGF-C可能主要是通过旁分泌作用诱导肿瘤血管及淋巴管形成, 从而促进肿瘤细胞的生长、转移, 同时可能作为一种自分泌生长调节因子直接促进肿瘤细胞的生长.
CTHRC1基因在体外实验中已经被证实其过表达能够提高细胞的迁移能力并抑制I型胶原的合成[2], 可以通过限制胶原基质沉积和促进细胞迁移参与血管的损伤修复, 因此, 其表达可能与肿瘤的侵袭及恶性程度相关[17]. 本研究的结果证实在直肠癌组织中CTRHC1的表达与直肠癌的分化程度和临床分期密切相关, 但是与直肠癌发生的年龄和性别无明显相关. 另外, 本研究发现CTRHC1的表达与VEGF-C的表达呈显著正相关, 也许CTHRC1能够与VEGF-C发挥协同作用, 从而为肿瘤细胞的侵袭和转移创造合适的细胞外环境.
因此, 我们推测CTHRC1和VEGF-C可能在直肠癌的血管发生和侵袭转移中起着重要作用, 检测CTHRC1和VEGF-C的表达可能作为判断直肠癌生物学行为的参考指标, 辅助判断直肠癌的预后. 但是二者间的确切关系尚不清楚, 有待进一步深入研究和证实.
直肠癌是我国常见的恶性肿瘤之一, 因其易发生转移和扩散、术后复发转移率较高, 探索其转移机制一直是众多学者的研究重点. VEGF已经被证实可以通过促进新生血管形成等机制参与肿瘤的发生、发展. CTHRC1被体外实验证实能够提高细胞的迁移能力, 但其在直肠癌组织中的表达报道较少.
房林, 副教授, 同济大学附属上海市第十人民医院普外科.
目前研究铂类配合物的重点和热点是对现有的经典结构的改造, 如将单核的铂类配合物改为双核或多核, 增加特异性和疗效; 增加空间阻位, 防止耐药性的发生; 引入新的极性离子, 增加可溶性; 增加脂溶性, 来改变用药途径, 等等. 以此达到高效、低毒、水溶性好、选择性高、与顺铂无交叉耐药性、可口服的新型铂类.
CTHRC1基因在体外实验中已经被证实其过表达能够提高细胞的迁移能力并抑制I型胶原的合成, 可以通过限制胶原基质沉积和促进细胞迁移参与血管的损伤修复, 因此, 其表达可能与肿瘤的侵袭及恶性程度相关.
本研究采用免疫组织化学方法研究直肠癌组织中CTHRC1和VEGF-C的表达, 并进行相关性分析, 初步探讨VEGF-C和CTHRC1在直肠癌发生、发展中的作用.
CTHRC1和VEGF-C可能在直肠癌的血管发生和侵袭转移中起着重要作用, 检测CTHRC1和VEGF-C的表达可能作为判断直肠癌生物学行为的参考指标, 辅助判断直肠癌的预后.
CTHRC1在直肠癌的研究目前未见相关报道, 研究发现CTHRC1在直肠癌组织中呈高表达, 且与VEGF的表达量呈正相关, 对进一步研究CTHRC1在直肠癌中的生物学作用有参考价值.
编辑: 李军亮 电编:何基才
| 1. | Ferlay J, Autier P, Boniol M, Heanue M, Colombet M, Boyle P. Estimates of the cancer incidence and mortality in Europe in 2006. Ann Oncol. 2007;18:581-592. [PubMed] [DOI] |
| 2. | Pyagay P, Heroult M, Wang Q, Lehnert W, Belden J, Liaw L, Friesel RE, Lindner V. Collagen triple helix repeat containing 1, a novel secreted protein in injured and diseased arteries, inhibits collagen expression and promotes cell migration. Circ Res. 2005;96:261-268. [PubMed] [DOI] |
| 3. | Bernstein C, Bernstein H, Payne CM, Dvorak K, Garewal H. Field defects in progression to gastrointestinal tract cancers. Cancer Lett. 2008;260:1-10. [PubMed] [DOI] |
| 4. | Duff SE, Jeziorska M, Kumar S, Haboubi N, Sherlock D, O'Dwyer ST, Jayson GC. Lymphatic vessel density, microvessel density and lymphangiogenic growth factor expression in colorectal cancer. Colorectal Dis. 2007;9:793-800. [PubMed] [DOI] |
| 5. | Lee JJ, Chu E. An update on treatment advances for the first-line therapy of metastatic colorectal cancer. Cancer J. 2007;13:276-281. [PubMed] [DOI] |
| 6. | Zafirellis K, Agrogiannis G, Zachaki A, Gravani K, Karameris A, Kombouras C. Prognostic significance of VEGF expression evaluated by quantitative immunohistochemical analysis in colorectal cancer. J Surg Res. 2008;147:99-107. [PubMed] [DOI] |
| 7. | Ferroni P, Palmirotta R, Spila A, Martini F, Formica V, Portarena I, Del Monte G, Buonomo O, Roselli M, Guadagni F. Prognostic value of carcinoembryonic antigen and vascular endothelial growth factor tumor tissue content in colorectal cancer. Oncology. 2006;71:176-184. [PubMed] [DOI] |
| 8. | Zheng S, Han MY, Xiao ZX, Peng JP, Dong Q. Clinical significance of vascular endothelial growth factor expression and neovascularization in colorectal carcinoma. World J Gastroenterol. 2003;9:1227-1230. [PubMed] |
| 10. | 欧 玉荣, 于 东红, 刘 德纯, 承 泽农. COX-2与VEGF-C在大肠癌中的表达及与预后的关系. 中国组织化学与细胞化学杂志. 2008;17:320-323. |
| 11. | 牟 江洪, 阎 晓初, 王 东, 吴 小华, 李 增鹏, 向 德兵. 大肠癌VEGF-C表达与淋巴结转移和预后的关系. 世界华人消化杂志. 2004;12:1061-1064. [PubMed] |
| 12. | De Vita F, Orditura M, Lieto E, Infusino S, Morgillo F, Martinelli E, Castellano P, Romano C, Ciardiello F, Catalano G. Elevated perioperative serum vascular endothelial growth factor levels in patients with colon carcinoma. Cancer. 2004;100:270-278. [PubMed] [DOI] |
| 13. | Shibuya M, Claesson-Welsh L. Signal transduction by VEGF receptors in regulation of angiogenesis and lymphangiogenesis. Exp Cell Res. 2006;312:549-560. [PubMed] [DOI] |
| 14. | Wizigmann-Voos S, Breier G, Risau W, Plate KH. Up-regulation of vascular endothelial growth factor and its receptors in von Hippel-Lindau disease-associated and sporadic hemangioblastomas. Cancer Res. 1995;55:1358-1364. [PubMed] [DOI] |
| 15. | Brown LF, Berse B, Jackman RW, Tognazzi K, Manseau EJ, Dvorak HF, Senger DR. Increased expression of vascular permeability factor (vascular endothelial growth factor) and its receptors in kidney and bladder carcinomas. Am J Pathol. 1993;143:1255-1262. [PubMed] |
| 17. | Tang L, Dai DL, Su M, Martinka M, Li G, Zhou Y. Aberrant expression of collagen triple helix repeat containing 1 in human solid cancers. Clin Cancer Res. 2006;12:3716-3722. [PubMed] [DOI] |