修回日期: 2009-03-26
接受日期: 2009-03-30
在线出版日期: 2009-05-08
目的: 研究沉默肝癌衍生生长因子(hepatoma-derived growth factor, HDGF)对人大肠癌lovo细胞增殖的影响.
方法: 将3条HDGF的特异性小干扰RNA(HDGF-siRNA)通过脂质体介导瞬时转染入大肠癌lovo细胞, RT-PCR及Western blot法分别检测HDGF mRNA和蛋白质表达受抑程度, 并筛选出1条沉默效率最高的siRNA用于后续试验; MTT法观察HDGF-siRNA对大肠癌细胞增殖生长的影响; Western blot法检测增殖细胞核抗原(PCNA)及ERK通路蛋白在转染前后大肠癌lovo细胞中表达含量的变化.
结果: HDGF-siRNA转染能有效抑制大肠癌lovo细胞中HDGF的表达; 与空白及阴性对照组相比, RNA干扰组大肠癌lovo细胞增殖率明显降低(t = 4.432, 4.263, 均P<0.01)、PCNA和p-ERK1/2蛋白均明显下调(t = 14.89, 11.92, 均P<0.01).
结论: HDGF-siRNA不仅有效阻断HDGF在大肠癌lovo细胞的表达, 而且明显抑制大肠癌lovo细胞的增殖, 其作用机制可能与下调PCNA, 抑制ERK1/2蛋白活化有关.
引文著录: 廖斐, 董卫国, 罗和生, 刘蒙. 沉默肝癌衍生生长因子对大肠癌细胞增殖的抑制. 世界华人消化杂志 2009; 17(13): 1286-1291
Revised: March 26, 2009
Accepted: March 30, 2009
Published online: May 8, 2009
AIM: To study the effect of specific HDGF-siRNA on proliferation of human colon carcinoma lovo cells.
METHODS: Three pairs of specific HDGF-siRNA were transiently transfected into lovo cells by liposome and then the expression of HDGF was detected by RT-PCR and Western blot. The most efficient siRNA was selected for following experiments. Cell proliferation was examined by MTT assay. Finally we also detected the expression of proliferating cell nuclear antigen (PCNA) by RT-PCR and Western blot.
RESULTS: After the specific siRNA was transfected into colon carcinoma lovo cells, the expression level of HGDF showed a significantly decrease which was detected by RT-PCR and Western blot. The cell survival rate was significantly lower in interference group than in blank control group or in negative control group (t = 4.432, 4.263, both P < 0.01), and the expression levels of PCNA and ERK1/2 protein were lower in interference group than in the other two groups (t = 14.89, 11.92, both P < 0.01).
CONCLUSION: The results show that the specific HDGF-siRNA can effectively silence the expression of HDGF, and HDGF-siRNA significantly inhibit proliferation of colon carcinoma cell line lovo cells, accompanied by down-regulation of PCNA and p-ERK1/2.
- Citation: Liao F, Dong WG, Luo HS, Liu M. Effects of specific HDGF siRNA on proliferation of human colon carcinoma cells. Shijie Huaren Xiaohua Zazhi 2009; 17(13): 1286-1291
- URL: https://www.wjgnet.com/1009-3079/full/v17/i13/1286.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i13.1286
大肠癌是一种常见的消化系恶性肿瘤, 其发病率呈逐年上升趋势, 严重威胁患者生命. 寻求有效的治疗靶标显得尤为重要. 许多研究表明生长因子如表皮生长因子(epidermal growth factor, EGF)、血管内皮生长因子(vascular endothelial growth factor, VEGF)在肿瘤的发生发展中扮演重要角色. 近年来, 一种新的生长因子, 即肝癌衍生生长因子(hepatoma-derived growth factor, HDGF), 因其在许多生理病理过程中起重要作用, 已越来越受到研究者的关注. 目前研究表明, HDGF在许多正常组织中呈低表达或不表达, 而在某些恶性肿瘤如肝癌、肺癌和胃癌中的表达水平显著高于正常组织, 并随着HDGF表达强度的升高, 肿瘤的恶性程度也越高, 暗示HDGF与恶性肿瘤的发生发展及预后密切相关[1].
RNA干扰技术是目前用于高效快速鉴定基因功能[2]的一项分子学生物技术. 为了明确HDGF对结肠癌细胞生长是否有影响, 本实验利用该技术阻断大肠癌lovo细胞中HDGF的表达, 以观察HDGF基因敲除后对大肠癌lovo细胞增殖的影响, 并进一步探讨其作用机制.
TRIzol试剂购于Invitrogen公司. 逆转录试剂盒、通用PCR试剂盒购于Fermenent公司. Annexin V-FITC试剂盒购于晶美公司. 脂质体Lipofectamine2000及化学合成的三对HDGF siRNA均购于广州瑞博生物技术有限公司. HDGF单克隆鼠抗、PCNA单克隆鼠抗及内参Acting均购于英国Abcam公司. ERK-1、ERK-2兔抗人mAb及p-ERK小鼠抗人mAb均购于美国Santa Cruz Biotechnology公司. 所有二抗均购于美国Pierce公司. 细胞裂解液、BCA蛋白浓度测定试剂盒均购于江苏碧云天生物技术研究所. ECL发光剂购于美国Milipore公司. 人大肠癌lovo细胞株购自中科院上海细胞典藏中心. 三条siRNA正反义链序列分别为: siRNA1, CAACAAAUACCAAGUCUUU dTdT, dTdT GUUGUUUAUGGUUCAGAAA; siRNA2, CAAGGAGAAGAACGAGAAA dTdT, dTdT GUUCCUCUUCUUGCUCUUU; siRNA3, CUACCAAGGAAGAUGCUGA dTdT, dTdT GAUGGUUCCUUCUACGACU.
1.2.1 细胞培养: lovo细胞株为Dukes分期为C期的大肠癌细胞株, 以含100 mL/L的胎牛血清的DMEM高糖培养基, 在37℃、50 mL/L CO2、饱和湿度培养箱中培养.
1.2.2 细胞转染: 当细胞密度达30%左右, 将HDGF siRNA及阴性对照siRNA以脂质体Lipofectamine2000介导转染入大肠癌lovo细胞, 具体操作按试剂说明书进行.
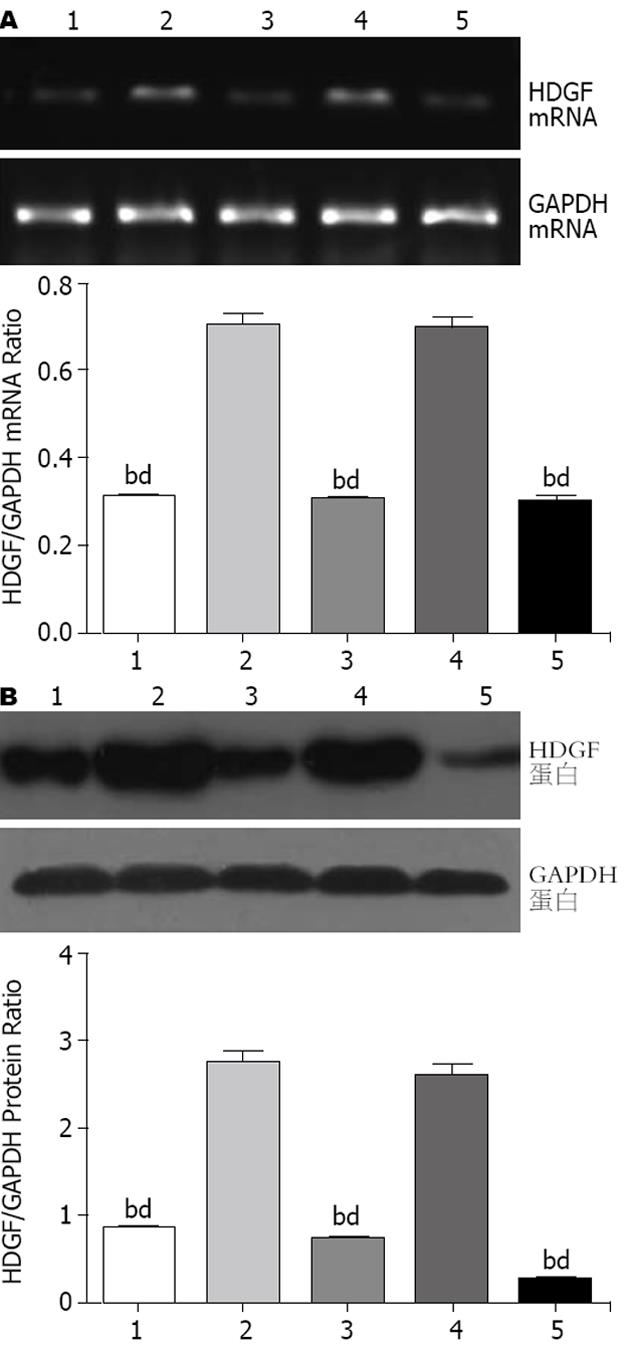
1.2.3 RT-PCR检测HDGF mRNA的表达: 转染后24 h, 用TRIzol试剂提取各组细胞总RNA, 紫外分光光度仪测定RNA纯度及含量, 以逆转录得到的cDNA为模板, 根据设计的内参引物GAPDH(正义引物5'-GAAGGTCGGAGTCAACGG-3', 反义引物5'-GGAAGATGGTGATGGGATT-3')、HDGF基因引物(正义引物5'-ACGAGACGGCATTCCTGG-3', 反义引物5'-CCTCTTCAACGCTCCTTT-3')进行PCR扩增, 扩增长度分别为221 bp和311 bp. 20 g/L琼脂糖凝胶电泳检测PCR产物, EB溶液染色、拍照并成像分析.
1.2.4 Western blot检测HDGF蛋白的表达: 转染后48 h, 以细胞裂解液裂解培养瓶中的细胞, 提取蛋白, BCA蛋白浓度测定试剂盒测定蛋白浓度后, 进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE), 转移至硝酸纤维素薄膜、封闭、加入一抗4℃孵育5 h, 漂洗后加入二抗常温孵育1 h, 漂洗后, 置于暗室中ECL试剂盒(Milipore公司)发光、显影、定影、冲洗晾干、拍照并成像分析. 通过以上实验筛选出RNA干扰效率最高的HDGF特异性siRNA用于后续实验.
1.2.5 实验分组: 将大肠癌lovo细胞分为3组: A: 空白对照组; B: 非特异性siRNA转染的阴性对照组; C: 特异性siRNA干扰组.
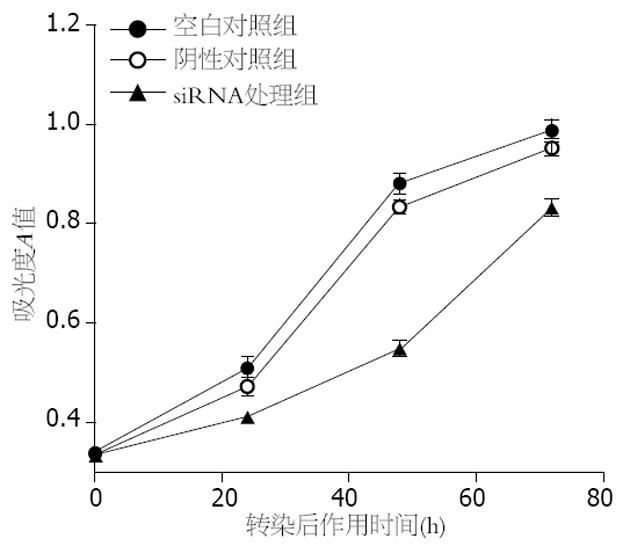
1.2.6 MTT细胞增殖实验: 取对数生长期细胞, 用胰酶消化制成单细胞悬液, 调整细胞浓度为1×108/L, 以每孔200 μL接种于96孔培养板上培养. 置于37℃、50 mL/L CO2培养箱培养, 分别于转染后置不含血清培养基中继续孵育24、48及72 h后检测各组细胞, 每组设4个复孔. 每孔中加入终浓度为5 g/L的MTT液20 μL, 继续培养3 h后终止培养, 吸去上清液, 加入二甲基亚砜(DMSO)每孔150 μL, 充分震荡10 min. 酶标仪(Bio-TekEX-800, 美国)在490 nm波长比色测定每孔A值. 比较各组细胞的生长.
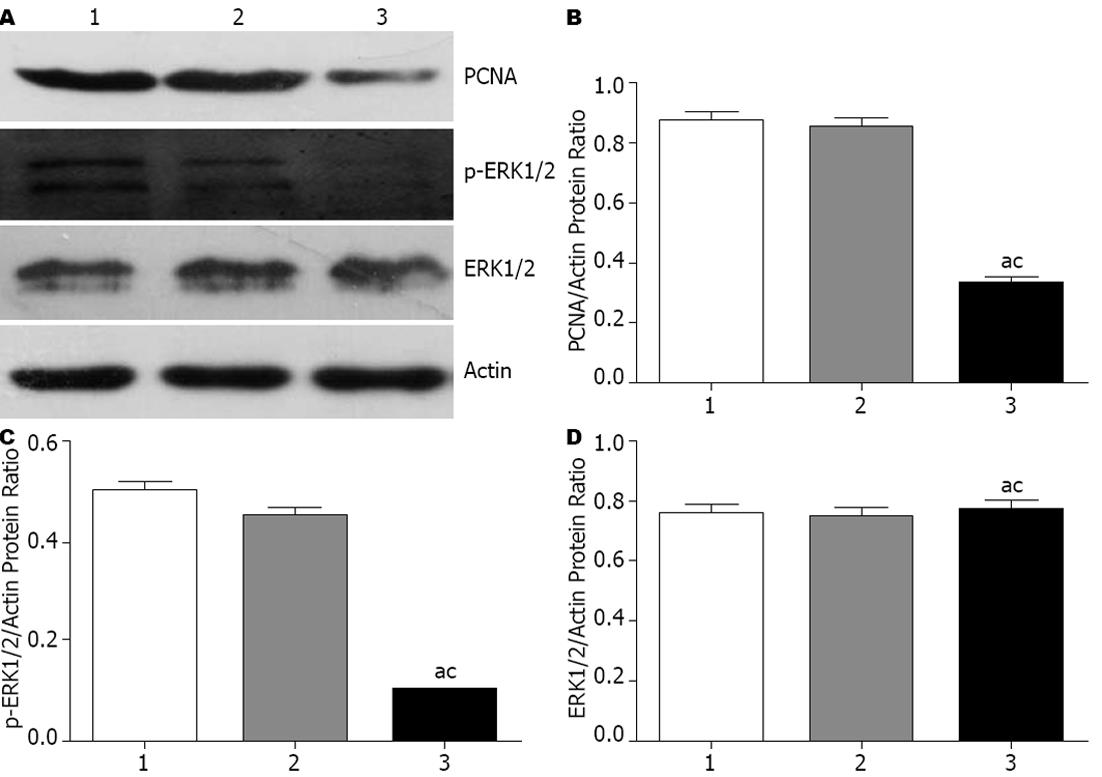
1.2.7 检测增殖细胞核抗原PCNA及ERK1/2通路: 于转染HDGF siRNA 48 h后, 收集各组细胞, 利用免疫印迹法检测PCNA、ERK1/2、p-ERK1/2及内参Actin蛋白的表达.
统计学处理 本实验每组设3个平行样本, 各组数据用SPSS11.5统计软件进行方差分析和组间q检验, 以P<0.05为差异有统计学意义.
转染24 h后收集大肠癌lovo细胞, RT-PCR结果显示: 阴性对照组及未转染组大肠癌lovo细胞HDGF mRNA呈阳性表达, 而3对特异性siRNA对HDGF mRNA表达均有明显抑制, 与两个对照组相比差异有显著性(t = 22.08, P<0.01), 各组细胞均表达内参GAPDH(221 bp), 其表达强度无明显差异. 转染48 h后收集细胞, Western blot检测各组细胞HDGF蛋白的表达, 可见阴性对照组及空白对照组大肠癌lovo细胞HDGF蛋白呈阳性表达, 而HDGF siRNA转染组大肠癌lovo细胞中HDGF蛋白表达明显减弱, 与对照组相比差异有显著统计学意义(t = 15.63, P<0.01). 三条特异性HDGF siRNA对HDGF均有明显的抑制, 以第3条siRNA的干扰效率最高, 故将其应用于后续实验(图1).
空白对照组和阴性对照组的大肠癌lovo细胞在转染后24, 48和72 h时细胞生长和增殖均未受影响, 两者比较差异无统计学意义(P>0.05). 而HDGF siRNA转染组的大肠癌细胞生长增殖受到明显的抑制, 与两对照组相比, 差异有显著统计学意义(t = 4.432, P<0.01、t = 4.263, P<0.01). 48 h后HDGF siRNA转染组大肠癌细胞增殖活性有所恢复, 但仍低于其他两组(图2).
转染后48 h, 提取细胞总蛋白, Western blot法检测各组细胞中PCNA、ERK通路蛋白的含量, 结果如图3所示, 通过灰度值分析得出RNA干扰组细胞中的PCNA蛋白及pERK1/2蛋白含量较其他两个对照组有明显下调, 差异均有显著统计学意义(tPCNA = 14.89, PPCNA<0.01、tp-ERK1/2 = 11.92, Pp-ERK1/2<0.01). 但转染前后各组细胞的ERK总蛋白含量无明显改变, 各组间差异无统计学意义(P>0.05).
大肠癌是我国最常见的恶性肿瘤之一, 目前的治疗主要依赖于手术及化疗, 手术治疗对患者生活质量有影响且术后易复发. 化疗易产生耐药且全身不良反应大. 随着生物学技术的快速发展, 以癌细胞为靶标的基因治疗被认为是治疗一些恶性肿瘤(包括大肠癌等)的最佳方案.
目前研究报道, 生长因子如EGF、bFGF和 PDGF等在肿瘤的发生发展中扮演重要角色, 而HDGF作为一种新的生长因子, 因其具有一个高度保守的PWWP结构域, 提示其可能具有更为重要的功能. 近年来的研究表明, HDGF参与心血管、肺、肝、肾等组织器官生长发育的调控[3-6], 还具有血管损伤修复、神经营养等作用[7-8]. 此外还有文献报道HDGF与肝癌、肺癌、食管癌及肺癌的发展及预后关系密切. 但目前国内外尚无关于HDGF对大肠癌细胞生物学行为的研究. 为了研究HDGF与大肠癌的关系, 我们前期采用免疫组织化学法对106例大肠癌、30例大肠腺瘤患者的病理组织切片进行了研究, 发现HDGF主要表达于细胞核, 在胞膜也有表达. 统计学分析显示HDGF在大肠癌组织中的表达明显高于大肠腺瘤组织[1], 并与肿瘤的分期、转移有关, 这提示HDGF可能成为大肠癌治疗的一个潜在的分子靶标. 本研究进一步利用RNA干扰技术阻断HDGF基因的表达, 观察该疗法能否抑制结肠癌细胞的生长.
细胞异常增殖是肿瘤发生发展的重要机制之一, 也是近年国内外学者研究的热点. 有研究报道HDGF对血管平滑肌细胞、肝癌细胞[9-10]等具有明显的促增殖作用. 本研究利用RNA干扰技术来瞬时抑制HDGF在大肠癌细胞lovo中的表达, 反面论证其抑制大肠癌细胞的增殖与否. 值得一提的是小干扰RNA转染入细胞内通常在24 h内尚未完全引起蛋白翻译转录受到抑制, 其发挥沉默效应的有效时间段多集中在转染后24-48 h, 随着小干扰RNA在细胞内停留时间继续延长, 越来越多的核酸酶将其破坏掉, 故48 h后大量的小干扰RNA被破坏掉, 从而导致HDGF转录翻译再度进行. 本研究结果显示: 瞬时转染HDGF siRNA 48 h前, 大肠癌lovo细胞的生长增殖受到抑制, 尤以转染后24-48 h抑制效果最为明显, 而48 h后lovo细胞的生长增殖活性又有所增强, 这些结果与小干扰RNA在细胞内的效应时间完全吻合, 恰好证明了对大肠癌生长的抑制作用来源于HDGF siRNA, 由此可见HDGF对大肠癌细胞增殖的调节起着极为重要的作用.
近年来同源蛋白学研究表明: HDGF蛋白与高迁移率族蛋白1(high mobility group protein-1, HMG)具有高度同源性[11], HMG蛋白是一种广泛存在于真核生物细胞核内的非组蛋白, 其最重要的功能是对基因表达转录的调控, HDGF与HMG-1的同源性提示HDGF可能也参与转录的调节过程, 并可能对控制肿瘤细胞的生长增殖的关键基因进行调控. 本研究结果显示: 通过RNA干扰抑制HDGF表达的同时, 检测到增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)的表达也随之下调, 这与Hu et al[12]研究认为HDGF与PCNA在细胞核内共显性表达的结论相符合. PCNA是DNA多聚酶δ的辅助蛋白, 合成于晚G1期和S期, 参与调节DNA的合成, 与细胞的增殖周期密切相关, 可较好地反映细胞增殖状态, PCNA阳性表达愈强, 说明细胞正处于增殖状态, 增殖也愈旺盛[13]. PCNA的这一生理功能使他被作为一项评估细胞增殖状态的指标, 广泛用于恶性肿瘤的研究. 本实验结果显示无论是从蛋白水平还是基因水平, PCNA的表达都随HDGF的表达下调而下调. 由此我们推测, PCNA可能是HDGF下游的调节因子之一. 阻断HDGF抑制了PCNA蛋白的转录合成, 从而影响了DNA的合成, 使大肠癌lovo细胞增殖受到抑制.
此外, 细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)是丝裂原激活蛋白激酶(mitogen activated protein kinase, MAPK)家族重要成员之一, 在细胞增殖与分化的调控中起关键作用[14]. ERK1/2在受到生长因子、细胞因子、有丝分裂等刺激和一些血管活性物质刺激后, 可转化为具有活性的磷酸化形式的p-ERK1/2. p-ERK1/2可从细胞质转位进入细胞核内, 进一步激活多种转录调节基因如myc、jun、fos等, 从而启动细胞增殖相关蛋白、基因的转录和表达, 引起细胞增殖、促进胶原及蛋白质的合成等[15]. 相应的, 磷酸化的p-ERK1/2的下调则可抑制细胞生长、阻碍各种促生长因子信号刺激基因转录. 本实验结果显示: 阻断HDGF基因后, p-ERK1/2在大肠癌lovo细胞中的表达含量明显降低, 而总ERK1/2的表达无明显变化, 即p-ERK1/2与总ERK1/2的比值下降, 表明ERK1/2通路处于被抑制状态. 由此可见, 阻断HDGF可以抑制p-ERK1/2的形成, 导致p-ERK1/2入核减少, 使其下游导致细胞增殖的因子表达减少, 从而抑制大肠癌lovo细胞的增殖. 因此ERK1/2通路也参与了HDGF siRNA抑制大肠癌细胞增殖的调节过程. 然而HDGF基因还可能通过哪些机制参与对大肠癌细胞增殖的调节, 具体的相互作用关系以及是否会给生物个体带来毒副作用等尚未明确, 值得我们进一步深入研究.
总之, 本研究表明沉默HDGF基因可以抑制大肠癌细胞的生长增殖, 其作用机制既可能与HDGF本身强有力的促有丝分裂作用被抑制有关, 也可能与下调PCNA, 抑制ERK1/2通路蛋白活化有关. 这些结论都提示HDGF基因不失为大肠癌治疗的一个极好的潜在分子靶标. 相信研制HDGF靶向抑制剂对治疗结肠癌有着广阔的临床应用前景.
近年研究发现肝癌衍生生长因子HDGF具有很强的促肿瘤生长作用, 在肿瘤及胚胎组织中呈过表达, 与多种肿瘤的生长、侵袭、转移、复发关系密切. 因此进一步研究HDGF拮抗物对肿瘤的作用已成为肿瘤靶向治疗研究的热点. 此外利用RNA干扰技术在mRNA水平上诱导基因表达抑制, 现已经成为研究基因治疗和寻找药物靶点的重要工具.
张国梁, 主任医师, 天津市第一中心医院消化内科.
随着分子生物学技术的发展, 信号转导及表达调控机制成为当今肿瘤研究中的热点. 如能从细胞内信号转导角度深入研究HDGF基因沉默后抑制大肠癌细胞增殖的机制, 将有助于从基因水平阐明HDGF的分子作用机制, 并为大肠癌的治疗提供新的途径.
国内外有关报道提示外源性添加HDGF生长因子对多种肿瘤细胞具有显著的促生长作用. 国内外已有的研究证明增加HDGF的内源性表达能够促进肿瘤的细胞的非锚着性生长, 但对敲除HDGF基因后的体外作用机制尚缺乏报道.
本文应用RNA干扰技术合成的HDGF siRNA, 在mRNA和蛋白水平上靶向抑制大肠癌lovo细胞中HDGF表达, 进而引起PCNA的下调及ERK通路的失活, 最终达成抑制大肠癌细胞增殖.
随着生物学技术的快速发展, 以癌细胞为靶标的基因治疗被认为是治疗一些恶性肿瘤(包括大肠癌等)的最佳方案.
本文立题很好, 意义重大, 实验水平很高, 结果可信, 对临床工作者的研究会有很大的帮助.
编辑: 李军亮 电编:何基才
| 2. | Semizarov D, Frost L, Sarthy A, Kroeger P, Halbert DN, Fesik SW. Specificity of short interfering RNA determined through gene expression signatures. Proc Natl Acad Sci U S A. 2003;100:6347-6352. [PubMed] [DOI] |
| 3. | Everett AD. Identification, cloning, and developmental expression of hepatoma-derived growth factor in the developing rat heart. Dev Dyn. 2001;222:450-458. [PubMed] [DOI] |
| 4. | Cilley RE, Zgleszewski SE, Chinoy MR. Fetal lung development: airway pressure enhances the expression of developmental genes. J Pediatr Surg. 2000;35:113-118; discussion 119. [PubMed] |
| 5. | Enomoto H, Yoshida K, Kishima Y, Okuda Y, Nakamura H. Participation of hepatoma-derived growth factor in the regulation of fetal hepatocyte proliferation. J Gastroenterol. 2002;37 Suppl 14:158-161. [PubMed] |
| 6. | Oliver JA, Al-Awqati Q. An endothelial growth factor involved in rat renal development. J Clin Invest. 1998;102:1208-1219. [PubMed] [DOI] |
| 7. | Narron JV, Stoops TD, Barringhaus K, Matsumura M, Everett AD. Hepatoma-derived growth factor is expressed after vascular injury in the rat and stimulates smooth muscle cell migration. Pediatr Res. 2006;59:778-783. [PubMed] [DOI] |
| 8. | Zhou Z, Yamamoto Y, Sugai F, Yoshida K, Kishima Y, Sumi H, Nakamura H, Sakoda S. Hepatoma-derived growth factor is a neurotrophic factor harbored in the nucleus. J Biol Chem. 2004;279:27320-27326. [PubMed] [DOI] |
| 9. | Everett AD, Stoops T, McNamara CA. Nuclear targeting is required for hepatoma-derived growth factor-stimulated mitogenesis in vascular smooth muscle cells. J Biol Chem. 2001;276:37564-37568. [PubMed] [DOI] |
| 10. | Yoshida K, Nakamura H, Okuda Y, Enomoto H, Kishima Y, Uyama H, Ito H, Hirasawa T, Inagaki S, Kawase I. Expression of hepatoma-derived growth factor in hepatocarcinogenesis. J Gastroenterol Hepatol. 2003;18:1293-1301. [PubMed] [DOI] |
| 11. | Nakamura H, Izumoto Y, Kambe H, Kuroda T, Mori T, Kawamura K, Yamamoto H, Kishimoto T. Molecular cloning of complementary DNA for a novel human hepatoma-derived growth factor. Its homology with high mobility group-1 protein. J Biol Chem. 1994;269:25143-25149. [PubMed] |
| 12. | Hu TH, Huang CC, Liu LF, Lin PR, Liu SY, Chang HW, Changchien CS, Lee CM, Chuang JH, Tai MH. Expression of hepatoma-derived growth factor in hepatocellular carcinoma. Cancer. 2003;98:1444-1456. [PubMed] [DOI] |
| 13. | Ding X, Yang J, Hu S, Wu X, Li Q. [Evaluation of p53, p21waf1, and PCNA in the diagnosis on lung cancer]. Zhonghua Liuxing Bingxue Zazhi. 2001;22:54-57. [PubMed] |