修回日期: 2009-04-08
接受日期: 2009-04-13
在线出版日期: 2009-05-08
目的: 探讨清肝活血方及拆方对酒精性肝损伤大鼠内质网应激反应性凋亡GRP78/Bip、GRP94、caspase-12基因和蛋白表达的影响.
方法: 建立大鼠慢性酒精性肝损伤复合模型, 第11周将造模大鼠按体质量和状态均衡分为模型组、清肝活血方组9.5 g/(kg•d)、清肝方组3 g/(kg•d)、活血方组6.5 g/(kg•d)和空白对照组, 每组10只. 各组每日上午仍灌胃给予乙醇混合液, 下午给予药液或生理盐水, 连续给药2 wk, 末次给药1 h后称质量, 腹主动脉采血, 处死, 分离肝脏. DNA ladder法和流式细胞术对肝细胞凋亡进行定性和定量检测, RT-PCR和Western blot法检测大鼠肝组织GRP78/Bip、GRP94和caspase-12基因和蛋白表达.
结果: 与正常组比较, 造模12 wk大鼠血清ALT和AST水平明显升高(138.3±43.3 U/L vs 33.9±9.8 U/L, 257.4±162.3 U/L vs 119.6±28.6 U/L, P<0.01); 肝细胞发生早期凋亡改变, 总凋亡率和早期凋亡率分别达到29%和26%(P<0.01); 肝组织GRP78/Bip、GRP94和caspase-12基因和蛋白表达明显增强(P<0.05或0.01). 经2 wk治疗后, 清肝活血方及拆方均能明显降低酒精性肝损伤大鼠血清ALT、AST水平; 抑制肝细胞凋亡, 总凋亡率和早期凋亡率分别降至8%和6%; 清肝活血方及清肝方显著降低肝组织GRP78/Bip、GRP94和caspase-12基因和蛋白表达, 与模型组比较有统计学差异(P<0.05或0.01), 而活血方组与模型组则无明显差异.
结论: 清肝活血方及拆方对酒精性肝损伤大鼠肝细胞凋亡均表现出较强的抑制作用, 其机制可能与下调内质网应激反应性凋亡相关基因caspase-12、GRP78/Bip和GRP94表达有关.
引文著录: 韩向晖, 陈珺明, 张莉, 王淼, 王磊, 郑培永, 季光. 清肝活血方对酒精性肝损伤大鼠内质网应激反应性凋亡基因表达的影响. 世界华人消化杂志 2009; 17(13): 1279-1285
Revised: April 8, 2009
Accepted: April 13, 2009
Published online: May 8, 2009
AIM: To assess the role of Qinggan Huoxue (QGHX) formula and its decomposed formulas in inhibition of GRP78/Bip, GRP94 and caspase-12 activation during endoplasmic reticulum (ER) stress-mediated apoptosis in rats with ethanol-induced liver injury.
METHODS: A rat model with ethanol-induced liver injury was successfully developed by gastric gavage of a mixture of ethanol and corn oil for 10 wk. Then, fifty rats were further divided into five condition- and weight-matched groups (n = 10): control, model, QGHX, QG, and HX group. Rats in model and treatment groups were given this ethanol mixture every morning, and subsequently administrated with normal saline, QGHX [9.5 g/(kg•d)], QG [3 g/(kg•d)], or HX [6.5 g/(kg•d)] every afternoon. Rats in control group were given the same volume of normal saline. Two weeks after treatment, blood samples were immediately collected from abdominal aorta, then all rats were killed and livers were excised. Hepatocyte apoptosis was detected using DNA agarose gel and flow cytometry. The expressions of GRP78/Bip, GRP94, and caspase-12 mRNA and proteins in liver were detected using real-time PCR and Western blot, respectively.
RESULTS: Compared with control rats, the model rats showed higher serum levels of ALT and AST (138.3 ± 43.3 U/L vs 33.9 ± 9.8 U/L, 257.4 ± 162.3 U/L vs 119.6 ± 28.6 U/L, both P < 0.01), elevated percentages of early and total apoptosis (29% and 26%, both P < 0.01), and activated expression of GRP78/Bip, GRP94, caspase-12 mRNA and protein (P < 0.01). QGHX formula and its decomposed formulas treatment for 2 wk obviously lowered the levels of serum ALT and AST, remarkably inhibited hepatocyte apoptosis (the percentages of early and total apoptosis were reduced by 8% and 6%, respectively). Additionally, the expressions of GRP78/Bip, GRP94, caspase-12 mRNA and proteins in liver were significantly decreased in QGHX and QG group than those in model group (P < 0.05 or 0.01). However, the expressions of these genes showed no significant difference between HX and model group.
CONCLUSION: It is proposed that QGHX and QG formula prevent hepatocyte apoptosis in rats with ethanol-induced liver injury by blocking an ER-mediated apoptotic pathway as well as GRP78/Bip, GRP94, caspase-12 activation.
- Citation: Han XH, Chen JM, Zhang L, Wang M, Wang L, Zheng PY, Ji G. Effects of Qinggan Huoxue formula on gene expression during endoplasmic reticulum stress-induced apoptosis in rats with ethanol-induced liver injury. Shijie Huaren Xiaohua Zazhi 2009; 17(13): 1279-1285
- URL: https://www.wjgnet.com/1009-3079/full/v17/i13/1279.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i13.1279
酒精性肝病(alcoholic liver disease, ALD)已逐渐发展为仅次于病毒性肝炎的第二大肝病[1]. 如何有效地预防和治疗ALD, 是亟待解决的问题. 肝细胞凋亡在ALD发病机制中具有重要作用, 而内质网应激(endoplasmic reticulum stress, ERS)反应性凋亡通路是近年的研究热点之一. 研究发现, 组织中GRP94、GRP78/Bip等内质网分子伴侣表达上调是ERS发生的标志, 而天冬氨酸特异性半胱氨酸蛋白酶-12(cysteine-containing aspartate-specific proteases 12, caspase-12)则是ERS介导的细胞凋亡特异性启动蛋白酶, 其活化是凋亡的中心环节[2-3]. 前期研究工作表明, 清肝活血方能显著降低酒精性肝损伤大鼠的肝细胞凋亡指数. 本实验通过建立大鼠慢性酒精性肝损伤复合模型, 从ERS反应性凋亡通路的角度, 研究清肝活血方及其拆方对相关信号分子基因和蛋白表达的影响, 从而探讨该方抗肝细胞凋亡的可能机制.
SD大鼠, SPF级, 体质量280±20 g, 上海斯莱克实验动物有限公司提供, 动物合格证号SCXK(沪)2003-0003号; 清肝活血方(柴胡9 g、黄芩9 g、丹参15g、鳖甲9 g、葛根15 g)、清肝方(柴胡9 g、黄芩9 g)及活血方(丹参15 g、鳖甲9 g、葛根15 g)颗粒由上海中医药大学附属龙华医院制剂室制备; Annexin-FITC凋亡检测试剂盒购自美国BD公司; TRIzol、Easy-DNATM试剂盒为Invitrogen公司产品; 逆转录试剂盒: Revert Aid First Strand cDNA Synthesis Kit 购自MBI公司; 兔抗大鼠GRP78/Bip、GRP94和caspase-12多克隆抗体购自英国Abcam公司. 其余试剂均为分析纯.
1.2.1 慢性酒精性肝损伤模型的建立: 正常大鼠75只, 在课题组原有造模方法的基础上加以改进, 复制大鼠慢性酒精性肝损伤模型[4]. 即每日上午ig乙醇混合液15 mL/kg(56度白酒∶玉米油∶吡唑 = 5∶1∶10)1次, 每周ip CCl4橄榄油溶液0.3 mL/kg(CCl4∶橄榄油 = 1∶3)1次, 连续10 wk. 病理结果显示造模成功, 诊断标准参照文献[5]. 第11周起将造模大鼠按体质量和状态均衡随机分为模型组、清肝活血方组9.5 g/(kg·d)、清肝方组3 g/(kg·d)、活血方组6.5 g/(kg·d)、空白对照组. 每组10只, 各组每日上午仍灌胃给予乙醇混合液, 下午给予药液或生理盐水, 连续给药2 wk, 末次给药1 h称质量后, 腹主动脉采血, 处死, 分离肝脏. 肝脏标本-70℃冻存或甲醛固定. 分离血清, 全自动生化分析仪检测丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)的水平. 取肝组织, 100 g/L甲醛溶液固定、石蜡包埋、切片, 行常规HE染色, 光镜下观察肝组织脂肪变性、炎症坏死等病变程度.
1.2.2 Annexin V-FITC/PI双标记法检测肝细胞凋亡: 新鲜肝组织剪碎至1 mm3大小, 然后置于100目铜网上轻搓, 边搓边以生理盐水冲洗, 2500 r/min离心5 min, 弃去上清及细胞碎片, 收集细胞悬液; 冷PBS液洗涤两遍, 用结合缓冲液调整细胞浓度至1×109 cell/L; 加入Annexin V-FITC和PI各5 μL; 旋涡混匀, 避光室温孵育15 min后立即用流式细胞仪进行检测, Cell Quest软件分析数据.
1.2.3 DNA ladder分析: 使用Easy-DNATM抽提方法提取肝组织DNA, 取DNA样本行20 g/L琼脂糖凝胶电泳, 进行凋亡特征性梯状条带(DNA ladder)分析.
1.2.4 实时荧光定量PCR检测肝组织GRP78/Bip、GRP94和caspase-12 mRNA的表达: 将100 mg组织放入研钵中加液氮粉碎, 每100 mg组织对应1 mL TRIzol混匀, 4℃离心(12 000 r/min, 10 min), 取上清液, 加入200 μL的氯仿, 混匀, 室温静置15 min; 4℃离心(12 000 r/min, 15 min), 取上层水相, 加入等体积异丙醇, 摇匀, 室温静置10 min; 4℃离心(12 000 r/min, 10 min), 分离白色沉淀即mRNA; 提取的总RNA溶于DEPC水中, 分光光度计测RNA浓度, -70℃冻存. 用Revert Aid First Strand cDNA Synthesis Kit对总mRNA进行逆转录, 合成cDNA. 取0.5 μL的cDNA于25 μL反应体系中进行PCR扩增(引物与条件见表1), 在进行正式实验前, 预扩增产物须通过电泳鉴定(电泳条件: 120 g/L琼脂糖凝胶, 10 V/cm凝胶的电压)以确定是否真正得到了预期特定扩增产物. 内参照选用GAPDH. 所用引物序列根据GenBank公布的相关数据设计, 由上海英骏生物工程公司合成. PCR反应完成后, 数据采用仪器自带软件: ABI Prism 7300 SDS Software分析, 通过Comparative Delta-delta Ct法对肝脏中GRP78/Bip、GRP94和caspase-12 mRNA的表达水平进行相对定量分析.
| 基因 | 引物序列(5'-3') | 长度(bp) | 退火温度(℃) |
| GRP78/Bip | 上游引物: ATCAGGGCAACCGCATCACACC | 312 | 56 |
| 下游引物: ACG CCTCGGCAGTTTCCTTCATTT | |||
| GRP94 | 上游引物: GACGGGCAAGGACATCTCTACAAA | 362 | 56 |
| 下游引物: CTTCTTCTTCTGCCCCTGCGTCTG | |||
| caspase-12 | 上游引物: ATTCCTGGTCTTTATGTCCC | 495 | 58 |
| 下游引物: ATACTCTCTCAATGGTGGGC | |||
| GAPDH | 上游引物: GTTACCAGGGCTGCCTTCTCTTG | 245 | 60 |
| 下游引物: CCTTGACTGTCCCGTTGA ACTTG |
1.2.5 Western blot检测肝组织GRP78/Bip、GRP94和caspase-12蛋白的表达: 将100 mg肝组织放入研钵中加液氮粉碎, 先加入RIPA缓冲液(每克组织3 mL RIPA), 在4℃条件下匀浆(15 000 r/min, 1 min); 然后加入PMSF储存液(每克组织30 μL, 10 g/L PMSF), 冰浴30 min, 离心(15 000 r/min, 15min); 分离细胞裂液(上清液), Lowery比色法测定蛋白含量. 每个样品上样50 μg, 经SDS-PAGE电泳分离后, 电转膜仪转膜(100 mA, 40 min); 转膜完毕后加入Western封闭液, 封闭2 h, 分别加入GRP78/Bip、GRP94、caspase-12多克隆抗体(一抗), 4℃过夜; Western洗涤液洗膜15 min, 共3次; 加入辣根过氧化物酶(HRP)标记的二抗, 4℃反应1 h. 化学发光法试剂作用后, X胶片曝光, 经显影、定影处理后观察结果. 凝胶成像及分析系统扫描图像, 进行灰度分析, 以目的条带/β-actin条带灰度比值表示各样本表达强度.
统计学处理 实验数据用mean±SD表示, 两组间比较采用t检验, 多组间比较采用One-way ANOVA分析; Excel2000及SPSS12.0软件进行数据处理及分析.
造模12 wk时, 模型组大鼠血清AST、ALT水平较空白对照组比较明显升高(P<0.01), 而经过2 wk的治疗, 清肝活血方及其拆方组(清肝方和活血方)大鼠血清AST、ALT水平有明显下降(P<0.05或0.01, 表2).
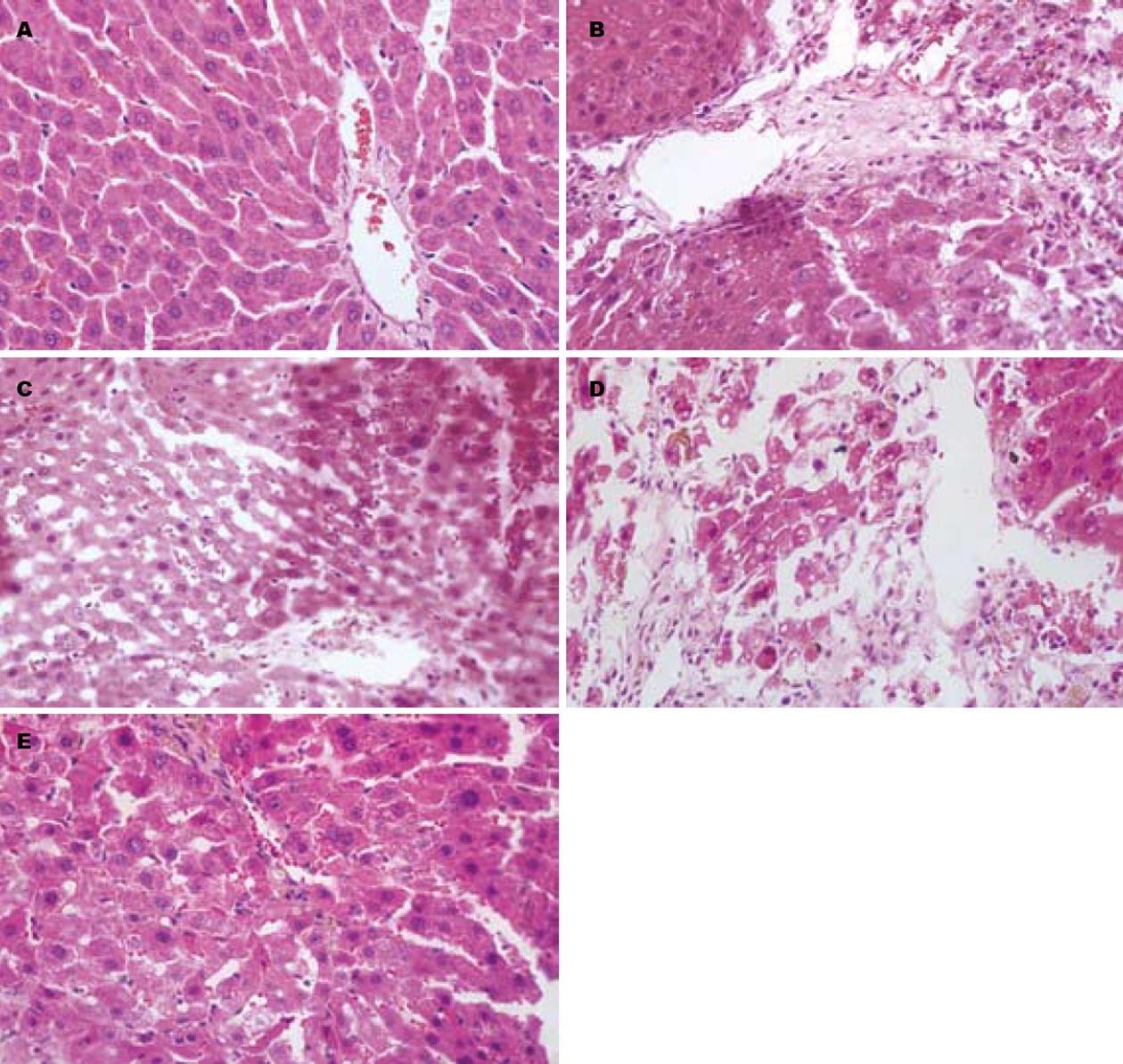
大体观察, 正常大鼠肝脏被膜光滑, 呈红褐色, 质地柔软; 模型组大鼠表现为肝脏表面粗糙, 体积明显增大, 呈土黄色, 质地较脆, 表面布有白色脂肪斑点; 清肝活血方及拆方组大多数动物肝脏颜色、质地明显改善. 光镜下观察, 正常大鼠肝小叶结构清晰, 肝细胞索以中央静脉为中心呈放射性排列, 肝窦正常; 模型组大鼠肝索界限不清, 肝细胞质出现不同程度的空泡变性; 肝细胞脂肪变性明显, 内含大小不等的脂滴; 肝小叶可见不同程度的点状或灶状坏死, 主要见于中央静脉周围带, 坏死区及肝窦内可见大量炎症细胞浸润, 个别坏死区可见纤维细胞增生; 清肝活血方及拆方组肝细胞脂肪变和炎症程度明显轻于模型组(图1).
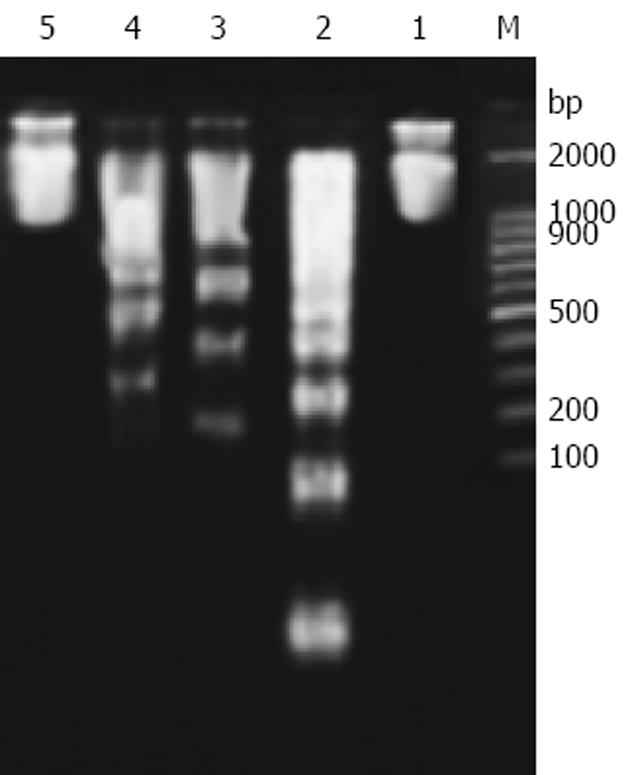
细胞凋亡的生化特征之一是凋亡细胞的DNA可断裂为180-200 bp的多条寡核小体片段, 在琼脂糖凝胶电泳上表现为梯形条带(DNA ladder). 空白对照组大鼠肝组织DNA完整无断裂, 呈现单一条带; 模型组大鼠肝组织出现明显的DNA梯度条带; 清肝活血方组呈现单一条带, 表明未发生细胞凋亡; 而清肝方和活血方组则不同程度抑制DNA梯度条带的发生(图2).
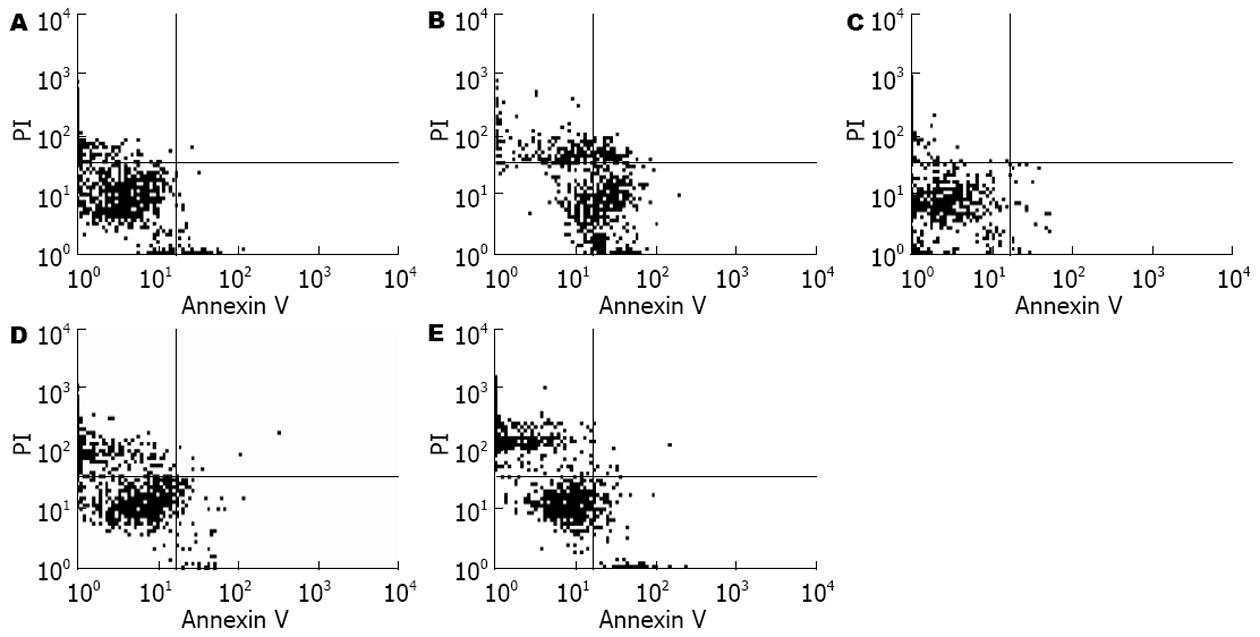
正常活细胞Annexin V及PI均低染(Annexin V- PI-), 分布在流式细胞分析图的左下区(LL); 早期凋亡细胞Annexin V高染而PI低染(Annexin V+ PI-), 分布在图的右下区(LR); 死亡细胞Annexin V低染而PI高染(Annexin V- PI+), 分布在图的左上区(UL); 晚期凋亡细胞Annexin V及PI均高染(Annexin V+ PI+), 分布在图的右上区(UR)(图3). 将早期凋亡细胞百分数(LR)和晚期凋亡细胞百分数(UR)之和称为总凋亡率. Annexin V/PI双标记法结果显示, 酒精性肝损伤模型组大鼠肝细胞早期凋亡率和总凋亡率较正常对照组显著增高(P<0.01), 而清肝活血方及拆方组大鼠肝细胞早期凋亡率和总凋亡率较模型组显著降低(P<0.01, 表3), 表明给药后对酒精性肝损伤大鼠肝细胞凋亡有明显的抑制作用.
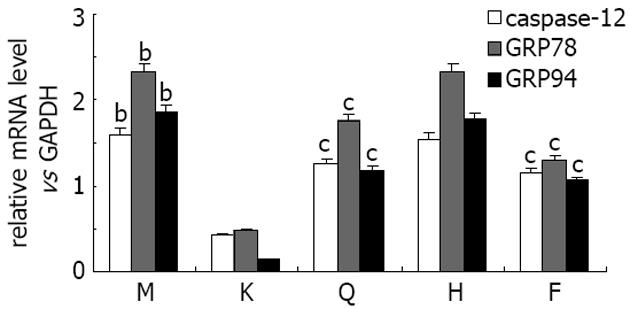
荧光定量PCR结果显示, 造模12 wk后, 模型组大鼠肝组织caspase-12、GRP78/Bip和GRP94 mRNA的相对表达量较正常大鼠显著升高(P<0.01), 分别是空白对照组的3.82、4.89和12.96倍; 清肝活血方和清肝方组大鼠肝组织中凋亡基因的相对表达量较模型组均显著降低(P<0.05), 其中清肝活血方组caspase-12、GRP78/Bip和GRP94 mRNA表达量分别是模型组的72.35%、56.11%和56.75%, 清肝方组分别为模型组的78.46%、75.95%和63.02%; 活血方组与模型组则无明显性差异(图4).
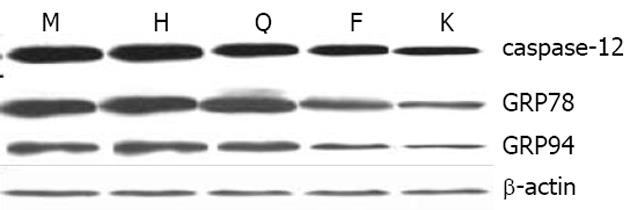
Western blot检测结果显示, 造模12 wk后, 模型组大鼠肝组织caspase-12、GRP78/Bip和GRP94蛋白表达量均明显高于正常大鼠(P<0.01), 分别达到空白对照组的4.31、4.93和9.28倍; 清肝活血方组和清肝方组大鼠肝组织中各蛋白表达量较模型组均显著降低(P<0.01), 其中清肝活血方组caspase-12、GRP78/Bip和GRP94蛋白表达量分别是模型组的48.81%、61.49%和46.15%, 清肝方组分别为模型组的63.09%、79.73%和58.46%; 活血方组与模型组则无明显性差异(图5).
近年的国外研究证实, 酗酒患者血浆同型半胱氨酸(homocysteine, HCY)水平明显升高, 乙醇能够减弱蛋氨酸合成酶活性, 从而引起含硫氨酸代谢紊乱导致高半胱氨酸血症[6]. 动物实验也表明, 在乙醇饲养的动物模型中, 乙醇通过高半胱氨酸介导ERS反应来影响肝细胞凋亡和脂肪合成相关因子的表达. HCY的增加, 同时与ERS应答基因(GRP78、GRP94、CHOP、SREBPs)表达增加以及凋亡或凋亡前因子(CRADD、caspase-12、caspase-7、ATM、BAD)的上调有关[7-10]. ERS发生时, GRP78/Bip、GRP94、GRP58、PDI、SERCA2b、钙网素(calreticulin)、CHOP等一系列内质网分子伴侣蛋白表达增加, 以稳定ER钙离子水平, 帮助正确折叠、修饰与转运ER内堆积的蛋白质, 或降解错误折叠的蛋白质, 从而抑制细胞凋亡, 保护细胞免受应激损害[10]. 其中GRP78/Bip和GRP94广泛存在于内质网上, 被认为是ERS的标志性蛋白. ERS实质上是触发了一个包括caspase-12、9、3特异级联反应. caspase-12是内质网特有、细胞凋亡的关键和特异蛋白酶. caspase-12活化是不依赖线粒体凋亡通路成分Apaf-1和细胞色素C来完成的[12-13].
清肝活血方是张仲景《伤寒论》之经方小柴胡汤的加减方. 临床研究证实, 该方能显著改善ALD患者症状、体征和肝功能, 有效逆转肝细胞轻度脂肪性改变, 降低4种肝纤维化标志物及血清细胞因子水平, 对ALD具有良好的综合治疗效果[14-16]. 前期研究工作发现, 清肝活血方能显著降低酒精性肝纤维化模型动物的肝细胞凋亡指数, 表现出较强的抗肝细胞凋亡作用, 并有一定的量效关系[17].
本研究应用乙醇-玉米油-吡唑混合物灌胃及小剂量CCl4注射的方法造模10 wk, 酒精性肝损伤大鼠血清ALT、AST水平明显升高; 组织病理亦显示大鼠肝细胞发生明显脂肪变性和炎症甚至纤维化, 表明大鼠酒精性肝损伤模型成功制备. 经过2 wk治疗后, 给药组大鼠肝脏生化指标和病理均发生明显改善. 两种凋亡检测方法显示, 12 wk模型大鼠肝细胞主要发生早期凋亡改变, 总凋亡率和早期凋亡率分别达到29%和26%, 并出现凋亡典型的生化学改变. 而给药组大鼠肝细胞总凋亡率和早期凋亡率则分别降低至8%和6%左右, 表明清肝活血方及拆方对酒精性肝损伤大鼠肝细胞凋亡有明显的抑制作用. 应用荧光定量PCR和Western blot进一步检测, 发现模型组大鼠肝组织caspase-12、GRP78/Bip和GRP94 mRNA和蛋白均高表达, 表明三种基因参与了酒精性肝损伤肝细胞ERS凋亡的发生; 给药组中仅清肝活血方和清肝方组大鼠肝组织caspase-12、GRP78/Bip和GRP94 mRNA和蛋白表达明显降低, 提示清肝活血方和清肝方可能通过下调ERS凋亡相关基因来抑制酒精性肝损伤模型肝细胞的凋亡. 另外活血方在改善各指标上均表现差于其他两方, 尤其对凋亡相关基因并无显著影响. 从组方的中药来分析, 提示君药柴胡和黄芩可能对抑制酒精性肝损伤肝细胞ERS凋亡发挥主要作用, 而调控ERS凋亡信号转导通路可能是"清肝法"治则的机制之一. 通过以上研究, 进一步揭示了清肝活血方的作用机制, 为中医药防治ALD提供可行的方法和新的理论依据.
内质网应激(ERS)介导的肝细胞凋亡是酒精性肝损伤发病机制之一, GRP78/Bip、GRP94、GRP58、CHOP等内质网分子伴侣蛋白及caspase-12、9、3等细胞凋亡特异性蛋白酶是ERS应答的相关基因, 他们的异常表达参与了肝细胞ERS凋亡的发生. 前期研究工作表明, 中药复方清肝活血方能显著降低酒精性肝损伤大鼠的肝细胞凋亡指数. 本文从ERS反应性凋亡通路的角度, 探讨清肝活血方及其拆方抗肝细胞凋亡的可能机制.
李军祥, 教授, 北京中医药大学附属东方医院消化内科; 杜群, 副研究员, 广州中医药大学脾胃研究所药理室.
ERS反应性凋亡通路是近年来提出的一条新的凋亡信号通路, 他涉及非折叠蛋白反应以及内质网内钙失衡, 许多疾病的发生都与ERS引起的损伤有关. 逐步揭示ERS介导细胞凋亡的发生、发展过程及药物对凋亡机制的干预, 从而寻求疾病新的治疗靶点是近年的研究热点和重点.
在D-氨基半乳糖联合脂多糖诱导的肝衰竭小鼠模型及体外诱导肝细胞ERS的研究中发现, 内质网应激时肝脏内质网caspase-12蛋白酶大量活化, 通过一系列级联反应, 最终导致细胞凋亡. 提示通过早期干预caspase-12的活化, 对ERS反应性凋亡相关的肝脏疾病可能具有保护作用.
本研究在建立大鼠慢性酒精性肝损伤模型的基础上, 研究清肝活血方及其拆方对ERS反应性凋亡通路中相关信号分子caspase-12、GRP78/Bip, GRP94的调控, 从而探讨该方抗肝细胞凋亡的作用靶点和强度, 深入揭示该方治疗酒精性肝损伤的机制, 并为全面综合研究中医药防治ALD提供可行的方法和新的理论依据.
临床多中心、随机、对照研究显示, 清肝活血方能显著改善ALD患者症状、体征和肝功能, 对ALD具有良好的综合治疗效果.
内质网应激(ERS)反应性凋亡通路: 当机体细胞受到缺氧、饥饿、钙代谢紊乱、自由基侵袭及药物等应激原的刺激时, 内质网腔内未折叠蛋白增多或钙失衡, 内质网应激反应信号向胞质和胞核传导, 从而使caspase-12活化, 诱导内质网分子伴侣产生增加, 继而激活非细胞色素C依赖的caspase-9, 引起级联反应导致凋亡. 他是与死亡受体和线粒体介导细胞凋亡不同的一条途径.
本研究设计合理, 方法可靠, 结果可信, 有较好的科学意义.
编辑: 李军亮 电编:吴鹏朕
| 2. | Xu YY, Lu Y, Fan KY, Shen ZH. Apoptosis induced by all-trans retinoic acid in N-acetylglucosaminyltransferase V repressed human hepatocarcinoma cells is mediated through endoplasmic reticulum stress. J Cell Biochem. 2007;100:773-782. [PubMed] [DOI] |
| 3. | Yeh TC, Chiang PC, Li TK, Hsu JL, Lin CJ, Wang SW, Peng CY, Guh JH. Genistein induces apoptosis in human hepatocellular carcinomas via interaction of endoplasmic reticulum stress and mitochondrial insult. Biochem Pharmacol. 2007;73:782-792. [PubMed] [DOI] |
| 6. | Blasco C, Caballería J, Deulofeu R, Lligoña A, Parés A, Lluis JM, Gual A, Rodés J. Prevalence and mechanisms of hyperhomocysteinemia in chronic alcoholics. Alcohol Clin Exp Res. 2005;29:1044-1048. [PubMed] [DOI] |
| 7. | Ron D. Hyperhomocysteinemia and function of the endoplasmic reticulum. J Clin Invest. 2001;107:1221-1222. [PubMed] [DOI] |
| 8. | Esfandiari F, Villanueva JA, Wong DH, French SW, Halsted CH. Chronic ethanol feeding and folate deficiency activate hepatic endoplasmic reticulum stress pathway in micropigs. Am J Physiol Gastrointest Liver Physiol. 2005;289:G54-G63. [PubMed] [DOI] |
| 9. | Song Z, Zhou Z, Deaciuc I, Chen T, McClain CJ. Inhibition of adiponectin production by homocysteine: a potential mechanism for alcoholic liver disease. Hepatology. 2008;47:867-879. [PubMed] [DOI] |
| 10. | Purohit V, Abdelmalek MF, Barve S, Benevenga NJ, Halsted CH, Kaplowitz N, Kharbanda KK, Liu QY, Lu SC, McClain CJ. Role of S-adenosylmethionine, folate, and betaine in the treatment of alcoholic liver disease: summary of a symposium. Am J Clin Nutr. 2007;86:14-24. [PubMed] |
| 11. | Grondin M, Marion M, Denizeau F, Averill-Bates DA. Tributyltin induces apoptotic signaling in hepatocytes through pathways involving the endoplasmic reticulum and mitochondria. Toxicol Appl Pharmacol. 2007;222:57-68. [PubMed] [DOI] |
| 13. | Nagy G, Kardon T, Wunderlich L, Szarka A, Kiss A, Schaff Z, Bánhegyi G, Mandl J. Acetaminophen induces ER dependent signaling in mouse liver. Arch Biochem Biophys. 2007;459:273-279. [PubMed] [DOI] |