修回日期: 2009-03-06
接受日期: 2009-03-09
在线出版日期: 2009-04-28
目的: 探讨E-选择素(E-selectin)基因第2号外显子G98T和第4号外显子A561C多态性及血清可溶性水平与慢性HBV感染临床结局之间的关系.
方法: 从外周血中提取基因组DNA, 采用聚合酶链反应-限制性片段长度多态性技术(PCR-RFLP)检测367例慢性HBV感染者(其中慢性HBV携带者97例, 慢性乙肝101例, 肝硬化121例, 肝癌48例)和281例健康对照者E-选择素基因G98T和A561C位点多态性, 同时采用酶联免疫吸附实验(ELISA)检测各组可溶性E-选择素(sE-选择素)水平.
结果: E-选择素A561C多态性中A/C+C/C基因型和C等位基因频率在肝硬化组与对照组相比差异有统计学意义(P = 0.006, 0.002). A/C+C/C基因型患肝硬化的风险是AA基因型的2.45倍(OR = 2.45, 95%CI: 1.28-4.72). E-选择素G98T多态性中各基因型频率和等位基因频率在各病例组与对照组相比差异无统计学意义, 但在肝硬化患者中, Child-pugh B+C级与A级相比较, G/T+T/T基因型频率差异有统计学意义(P = 0.034), G/T+T/T基因型发展到Child-pugh B或C的风险是GG型的3.07倍(OR = 3.07, 95%CI: 1.05-8.97). 慢性乙肝组和肝硬化组血清sE-选择素水平明显高于对照组(P<0.01); 在肝硬化组中, 血清sE-选择素水平从Child-pugh A级到C级明显降低(P<0.05); 在各组中, C等位基因携带者血清sE-选择素水平明显高于A等位基因携带者(P<0.05).
结论: E-选择素A561C基因多态性可能与慢性HBV感染后肝硬化的发生相关, 并参与调控血清可溶性E-选择素的表达; E-选择素G98T基因多态性与慢性HBV感染后的临床结局无相关性, 但可能与肝硬化的严重程度相关.
引文著录: 伍仕敏, 杨华芬, 章敏, 熊焰, 韩晓群, 殷继东, 周新, 蔡春林. E-选择素基因多态性及血清可溶性水平与慢性HBV感染临床结局的关系. 世界华人消化杂志 2009; 17(12): 1253-1259
Revised: March 6, 2009
Accepted: March 9, 2009
Published online: April 28, 2009
AIM: To investigate the association between A561C polymorphism in the exon 2 and the G98T polymorphism in the exon 4 of E-selectin gene and disease progression in a HBV-infected Chinese Han population, and also to determine the plasma soluble E-selectin levels in these people.
METHODS: Polymorphisms (Pst I for A561C and Hph I for G98T) of E-selectin gene were analyzed using polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP) in 367 HBV carriers and 281 healthy controls. The plasma soluble E-selectin levels were measured using specific enzyme-linked immunosorbent assay (ELISA).
RESULTS: There was significant difference in frequencies of A/C+C/C genotype and C allele in E-selectin A561C polymorphism between patients with liver cirrhosis (LC) and controls (P = 0.006 and P = 0.002). The relative risk of LC with A/C+C/C genotype was 2.45 times of those with A/A genotype (OR = 2.45, 95%CI: 1.28-4.72). There was no difference in genotype and allele distribution for E-selectin G98T polymorphism between each group and controls. But in patients with LC, the frequency of G/T+T/T genotype was of significant difference between Child' class A and class B plus C after the Child-Pugh classification (P = 0.034), the relative risk of Child-pugh B or C with G/T+T/T genotype was 3.07 times of those with G/G genotype (OR = 3.07, 95%CI: 1.05-8.97). Plasma levels of soluble E-selectin were significantly increased in HBV carriers with chronic hepatitis (CH) and LC compared with controls (P < 0.01). In the subgroup of LC, levels of soluble E-selectin were significantly decreased from Child' class A to class C (P < 0.05). In each group, people with C allele showed higher soluble E-selectin levels than those with A allele (P < 0.05).
CONCLUSION: E-selectin A561C polymorphism may be associated with liver cirrhosis in patients with chronic HBV infection and affect the plasma soluble levels, and the G98T polymorphism may be related to fibrotic severity.
- Citation: Wu SM, Yang HF, Zhang M, Xiong Y, Han XQ, Yin JD, Zhou X, Cai CL. A561C and G98T polymorphisms and plasma soluble levels of E-selectin in patients with chronic HBV infection. Shijie Huaren Xiaohua Zazhi 2009; 17(12): 1253-1259
- URL: https://www.wjgnet.com/1009-3079/full/v17/i12/1253.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i12.1253
慢性乙型肝炎病毒(hepatitis B virus, HBV)感染是严重危害人类健康的重要传染病之一. 机体感染HBV后临床结局除与免疫、病毒因素相关外, 也与被感染者的遗传背景密切相关[1-2]. 不同个体慢性HBV感染后, 可保持持续肝功能正常成为慢性HBV携带者(asymptomatic carrier, ASC), 也可发展为慢性乙型肝炎(chronic hepatitis B, CHB)、肝硬化(liver cirrhosis, LC), 甚至肝细胞癌(hepatocellular carcinoma, HCC). 因而, 从遗传易感性角度探讨HBV感染结局多样性一直是研究者关注的问题. 研究表明, 多种细胞因子的单核苷酸多态性在宿主对HBV的免疫应答中有重要作用, 影响着HBV感染后的临床结局[3-6]. 近年来, 细胞黏附分子在肝脏疾病中的作用越来越被大家所重视. 肝脏炎症过程中, 淋巴细胞与内皮细胞的黏附、渗出及与肝细胞的黏附是均由细胞黏附分子介导[7]. E-选择素(E-selectin, CD62E)是黏附分子选择素家族的主要成员之一, 为细胞表面糖蛋白, 仅存在于活化的血管内皮细胞表面. 在炎症过程中, E-选择素可通过招募Th1亚型淋巴细胞的黏附和聚集, 促使其产生前炎症因子, 从而加重炎症进程[8-9]. 与此同时, 炎症组织释放的白介素1(interleukin 1, IL-1)及肿瘤坏死因子α(tumor necrosis factor α, TNF-α)等细胞因子可活化血管内皮细胞, 从而反过来刺激E-选择素的合成. Wenzel et al[10-11]于1994和1996年首先报道E-选择素基因第4号和第2号外显子分别存在A/C、G/T点突变, 并发现其与动脉粥样硬化(atherosclerosis, AS)相关. 迄今为止, 已发现E-选择素基因多态性与多种炎症性疾病(如冠心病[12-15]、多发性硬化症[16]、缺血性脑血管疾病[17]、系统性红斑狼疮[18]等)的发生相关. 慢性HBV感染亦是一个慢性炎症性疾病过程, 有研究表明慢性肝脏疾病患者血清可溶性E-选择素(soluble E-selectin, sE-选择素)水平明显增高[19-20]. E-选择素作为体内的一种促炎性细胞因子, 其基因多态性及血清可溶性水平是否与慢性HBV感染后临床结局相关未见报道. 本研究采用聚合酶链反应-限制性片段长度多态性(polymerase chain reaction-restriction fragment length polymorphism, PCR-RFLP)方法, 研究E-选择素A561C、G98T基因型和等位基因频率在慢性HBV携带者、CHB、LC和HCC 4种不同HBV感染临床结局中分布频率的差异, 探讨E-选择素基因多态性作为机体遗传因素与慢性HBV感染临床结局之间的关系, 并检测各组血清sE-选择素水平变化.
2005-09/2007-06武汉市医疗救治中心(原武汉市传染病医院)和武汉大学中南医院门诊或住院患者, 共367例. (1)病例组: 慢性HBV携带者97例, 其中男63例, 女34例; 年龄17-67(平均35.8±13.2)岁; CHB患者101例, 其中男60例, 女41例; 年龄17-65(平均38.7±13.5)岁; LC患者121例, 其中男91例, 女30例; 年龄23-68(平均40.9±11.7)岁; HCC患者48例, 其中男39例, 女9例; 年龄25-71(平均46.1±15.4)岁. 所有病例选择均符合2005年中华医学会肝病与感染病学分会制定的《慢性乙型肝炎防治指南》[21]的诊断标准, 并排除其他肝炎病毒感染以及酒精性肝病、药物性肝病、脂肪肝、自身免疫性肝炎等, 排除混合(重叠)感染. 所有病例均除外心、脑、肾、肺等器官疾病及高血压、糖尿病等. HCC病例的选择符合2001年中国抗癌协会肝癌专业委员会修订的肝癌临床诊断标准. (2)健康对照组: 281名, 为病例收集期间来武汉市医疗救治中心和武汉大学中南医院的健康体检者, 其中男206例, 女75例; 年龄16-66(平均年龄39.6±14.6)岁, 排除肝脏、肾脏、内分泌和心脑血管疾病者.
1.2.1 引物设计及合成: PCR引物序列参照有关文献[5-6]设计, 由北京赛百盛基因技术有限公司合成. 用于扩增E选择素A561C位点多态性的引物序列如下: 上游引物: 5'-AGTAATAGTCCTCCTCATCATG-3'; 下游引物: 5'-ACCATCCAAGTGAAGAAAGAG-3'; 用于扩增E选择素G98T位点多态性的引物序列如下: 上游引物: 5'-TGCCCAAAATCTTAGGATGC-'3; 下游引物: 5'-AAGCCCAGGGAAGAACACAT-'3.
1.2.2 基因组DNA的制备: 抽取外周抗凝血3-5 mL, 用TaKaRa公司提供人基因组DNA提取试剂盒提取基因组DNA, 严格按说明书操作, 提取后的基因组DNA保存于-20℃.
1.2.3 E-选择素基因多态性检测: 以基因组DNA为模板, 严格按照TaKaRa PCR试剂盒说明书进行PCR反应. PCR扩增条件为: 95℃预变性5 min; 95℃ 45 s、58℃ 1 min、72℃ 1 min, 30次循环; 72℃延伸10 min. 扩增产物进行20 g/L琼脂糖凝胶电泳(含溴化乙锭0.5 mg/L)鉴定. 酶切反应: 取PCR扩增产物8 µL, 限制性内切酶PstⅠ或HphⅠ10 U, 加人1 µL RE Buffer(10×), 37℃酶切6 h. 酶切产物进行20 g/L琼脂糖凝胶电泳. 并将紫外灯下观察的特异性扩增结果与2个多态性位点PCR产物直接测序结果相对照, 最终确定各个样本的基因型.
1.2.4 血清sE-选择素水平测定: 采用ELISA法检测血清sE-选择素的水平, 试剂由奥地利Bender MedSystems公司提供, 严格按试剂说明操作, 在芬兰雷勃酶标仪450 nm波长处检测A值, 通过标准曲线得出标本血清sE-选择素含量. 该试剂盒检测灵敏度为0.4 μg/L, 实验中批内和批间变异低于15%.
统计学处理 基因型和等位基因频率采用直接计数法, 研究对象与Hardy-Weinberg平衡的符合程度、单个基因型及组间等位基因频率比较采用R×C列联表χ2检验, 并采用Bonferroni法校正. 判断因素与疾病间是否存在联系采用Woolf法, 以比值比(OR)及其95%CI表示相对风险度. 计量资料用以mean±SD表示, 用SPSS11.5统计软件, 以One-way ANOVA分析各组别之间的差异, 两组间比较采用q检验, P<0.05为有统计学意义.
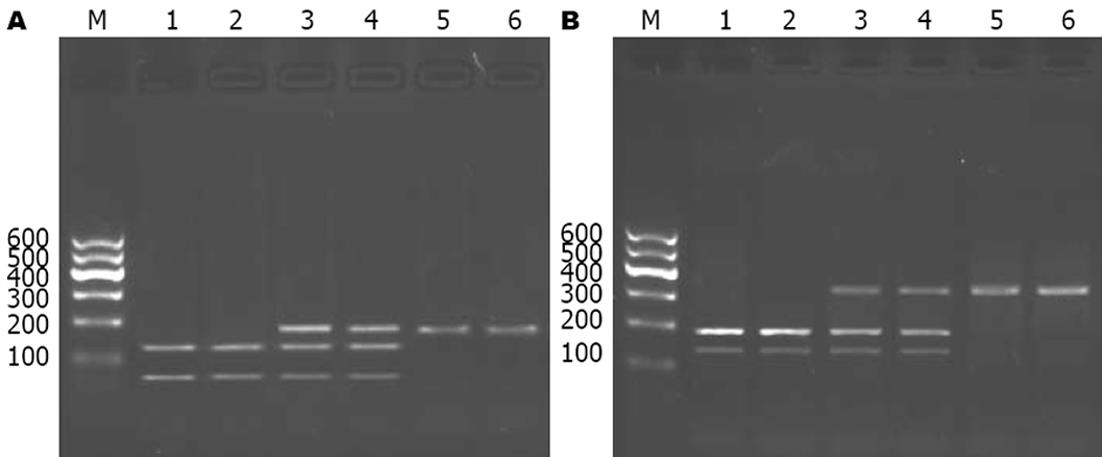
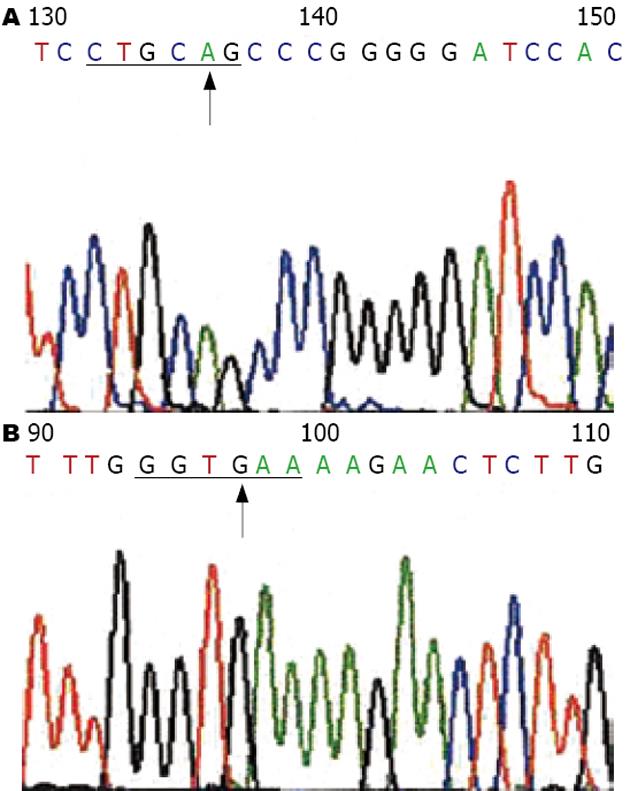
E-选择素A561C基因多态性, PCR扩增产物片段为186 bp, 根据限制性内切酶PstⅠ酶切片段, 可分为3种基因型: A/A型(123, 63 bp两条区带), A/C型(186, 123, 63 bp 三条区带), C/C型(186 bp一条区带)(图1A). E-选择素G98T基因多态性, PCR扩增产物片段为332 bp, 根据限制性内切酶HphⅠ酶切片段的情况, 也可分为3种基因型: G/G型(194, 138 bp两条区带), G/T型(332, 194, 138 bp三条区带), T/T型(332 bp一条区带)(图1B). 测序结果如图2.
E-选择素基因型在各组人群中的分布频率, 经Hardy-Weinberg平衡定律检验, 达到遗传平衡, 具有群体代表性. 经χ2检验及相关分析, E-选择素 A561C基因型频率和等位基因频率分布(表1)在慢性HBV携带者组、CHB组和HCC组与对照组相比差异无统计学意义; LC组与对照组相比, A/C+C/C基因型和C等位基因频率在两组中有统计学差异(P = 0.006和P = 0.002), A/C+C/C基因型患LC的风险是A/A基因型的2.45倍(OR = 2.45, 95%CI: 1.28-4.72), C等位基因在LC中出现的频率是A等位基因的3.38倍(OR = 3.38, 95%CI: 1.82-6.27).
| 基因型及等位基因 | ASC组(n = 97) | CH组(n = 101) | LC组(n = 121) | HCC组(n = 48) | 对照组(n = 281) |
| A561C | |||||
| A | 182(93.81) | 186(92.08) | 220(90.91) | 92(95.83) | 541(96.26) |
| C | 12(6.19) | 16(7.92) | 22(9.09)a | 4(4.17) | 21(3.74) |
| A/A | 85(87.63) | 86(85.15) | 101(83.47) | 44(91.67) | 260(92.53) |
| A/C+C/C | 12(12.37) | 14+1(14.85) | 18+2(16.53)b | 4(8.33) | 21(7.47) |
| G98T | |||||
| G | 183(94.33) | 187(92.57) | 223(92.15) | 91(94.79) | 534(95.02) |
| T | 11(5.67) | 15(7.43) | 19(7.85) | 5(5.21) | 28(4.98) |
| G/G | 86(88.66) | 87(86.14) | 104(85.95) | 43(89.58) | 255(90.75) |
| G/T+T/T | 11(11.34) | 13+1(13.86) | 15+2(14.05) | 5(10.42) | 24+2(9.25) |
E-选择素G98T基因型、等位基因频率在慢性HBV携带组、CHB组、LC组、HCC组和与对照组相比差异均无统计学意义. 但在LC患者中, Child-pugh A级与B+C级相比较, G/T+T/T基因型和T等位基因频率分布有统计学意义(P = 0.034和P = 0.009), G/T+T/T基因型发展到Child-pugh B或C的风险是GG型的3.07倍(OR = 3.07, 95%CI: 1.05-8.97), T等位基因在LC患者Child-pugh B+C级中出现的频率是G等位基因的3.53倍(OR = 3.53, 95%CI: 1.31-9.49)(表2).
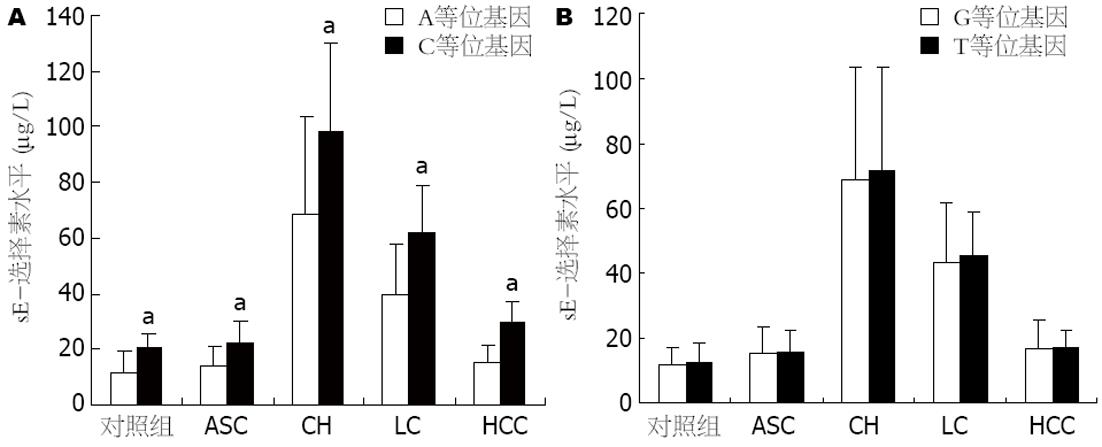
我们的研究发现, 慢性HBV携带者组(15.16±8.33 μg/L)、HCC组患者(16.69±8.27 μg/L)血清sE-选择素水平与对照组(13.96±7.50 μg/L)相比较, 差异无统计学意义; CHB组(68.94±34.09 μg/L)、LC组(43.39±18.00 μg/L)血清sE-选择素水平与对照组相比, 差异有统计学意义; 且两组之间相比, 也有统计学差异, CHB患者血清sE-选择素水平显著高于LC患者; 在LC组中, 血清sE-选择素水平在Child-pugh A(47.81±18.25 μg/L)、B(38.86±15.81 μg/L)和C(26.79±6.02 μg/L)级中差异有统计学意义(P<0.05), 从Child-pugh A级到C级明显下降. 在各组中, C等位基因携带者血清sE-选择素水平明显高于A等位基因携带者如图3A所示. 我们的研究还发现, G98T多态性与血清sE-选择素水平没有相关性(图3B).
机体感染HBV后的肝损伤主要由宿主对HBV的免疫应答所致, 肝纤维化亦是肝细胞损伤后炎性细胞的招募与聚集的结果. 研究表明, 基因突变、多态性等遗传因素能够影响慢性肝病的自然史, 目前已经发现多种细胞因子基因的多态性与HBV感染后肝脏损伤的严重性相关[3-6]. 而淋巴细胞黏附至内皮细胞是其迁徙至炎症组织的重要环节, 近年来研究表明E-选择素在机体炎症过程中发挥着重要作用[8-9]. E-选择素的编码基因位于第1号染色体长臂上, 长13 kb, 含有14个外显子和13个内含子, 其中第4号和第2号外显子分别存在A/C、G/T点突变. 截至目前为止, 已报道E-选择素基因多态性与多种炎症性疾病[5-11]相关, 但其是否与慢性HBV感染后的临床结局相关未见报道.
我们的研究表明, 在中国湖北地区汉族人群存在E-选择素A561C基因多态性, 可能与慢性HBV感染后LC的发生相关, C等位基因可能是LC的遗传危险因素之一. E-选择素A561C突变发生于4号外显子表皮生长因子样区(epidermal growth factor like domain, EGF样区)结构域, 导致其所编码分子的第128位由丝氨酸(Ser)变成精氨酸(Arg), 使E选择素受体结构发生改变, 从而影响白细胞的黏附和聚集[10-11]. 有证据显示[22]A561C突变的人脐静脉内皮细胞比野生型表现出更强的滚动及黏附至中性粒细胞和单个核细胞的能力. Rao et al[23]研究表明A561C多态性还在淋巴细胞招募中表现出一定程度的特异性. 因此, 在肝脏炎症和肝纤维化过程中A561C多态性可能通过促使白细胞和内皮细胞的黏附以及参与淋巴细胞的招募, 从而导致局部炎症加剧, 长期的慢性炎症最终导致肝纤维化的发生.
E-选择素G98T多态性发生在外显子2的5'端非编码区, 最早在德国人群中发现其与动脉粥样硬化相关[10]. 迄今为止, 有关E-选择素G98T多态性与相关疾病的研究并不多. 有报道在德国人群中G98T多态性与冠心病的严重程度相关. 最近的研究表明, 在多发性硬化症患者中T/T基因型携带者急性发作的危险程度明显高于其他基因型[16]. 我们的研究表明, G98T多态性与慢性HBV感染临床结局无明显相关性, 但在LC患者中T等位基因在Child-pugh B或C级中出现的频率明显高于Child-pugh A级, 而Child-pugh B、C级在临床上一般为失代偿期LC患者, 此类患者肝脏的炎症程度较Child-pugh A低但纤维化程度增加, 因而推测E-选择素G98T基因多态性可能与LC的严重程度相关.
血清sE-选择素水平变化通常反映细胞表型转换和蛋白水解酶裂解的变化, 是炎症活动的标志[13]. 本研究显示, 在CHB、LC患者中, 血清sE-选择素水平均明显高于健康对照组, 与Cervello et al[19]和Yan et al[20]研究一致, 表明高水平sE-选择素水平与肝脏炎症和纤维化程度密切相关. 我们的研究还发现, 在各组中C等位基因携带者血清sE-选择素水平明显高于A等位基因携带者, 表明E-选择素A561C基因多态性可能在此过程中起着重要作用. Mlekusch et al[24]研究也证实, 血清sE-选择素水平在A561C突变组明显高于野生型A561A. 因此, 在慢性HBV感染导致的肝脏炎症中A561C多态性可能通过促使白细胞和内皮细胞的黏附, 导致局部炎症加剧, 与此同时炎症组织释放IL-1及TNF-α等细胞因子, 反过来刺激sE-选择素表达增加. 此外, 我们观察到LC患者中sE-选择素水平进行性降低, 提示我们患者可能预示着患者的预后不良, 病情可能向失代偿性LC甚至HCC方向发展, 可作为动态监测慢性HBV感染临床结局的新指标.
慢性HBV感染作为一种由遗传、免疫和环境因素共同作用所致的复杂的感染性疾病, 其临床结局也具有多样性. 本研究的初步结果显示: E-选择素A561C基因多态性可能与慢性HBV感染后的LC的发生相关, 并且参与调控血清可溶性水平; E-选择素G98T基因多态性可能与LC的严重程度相关. 但是, 由于单核苷酸多态性受众多因素(如样本选择、样本数量、种族背景等等)影响, 因此还需要进一步进行的大样本量和应用不同种族的病例-对照研究予以明确, 以便为我们更深入地了解CHB的发病机制、寻找新的治疗方案提供依据.
机体感染HBV后临床结局除与免疫、病毒因素相关外, 也与被感染者的遗传背景密切相关. 多种细胞因子基因多态性在宿主对HBV的免疫应答中有重要作用.
孙殿兴, 主任医师, 白求恩国际和平医院肝病科; 王炳元, 教授, 中国医科大学附属第一医院消化内科
目前的研究显示E-选择素基因第2号外显子G98T和第4号外显子A561C存在多态性, 并发现其与多种炎症性疾病的发生相关, 但是否与慢性HBV感染后临床结局相关未见报道.
近期Hattori et al报道E-选择素基因多态性与缺血性脑血管疾病的发生显著相关.
本研究首次发现E-选择素基因多态性可能与慢性HBV感染后肝硬化的发生及严重程度相关, 并参与调控血清可溶性E-选择素的表达.
对HBV感染后临床结局与E-选择素的基因多态性及血清可溶性水平的相关性进行研究, 可以借此判断患者的预后, 为更深入地了解慢性乙型病毒性肝炎的发病机制、寻找新的治疗方案提供依据.
本研究选题较好, 内容有一定先进性, 具有较好的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Thio CL, Thomas DL, Carrington M. Chronic viral hepatitis and the human genome. Hepatology. 2000;31:819-827. [PubMed] [DOI] |
| 2. | Kao JH. Hepatitis B viral genotypes: clinical relevance and molecular characteristics. J Gastroenterol Hepatol. 2002;17:643-650. [PubMed] [DOI] |
| 3. | Jung MC, Pape GR. Immunology of hepatitis B infection. Lancet Infect Dis. 2002;2:43-50. [PubMed] [DOI] |
| 4. | Kim YJ, Lee HS, Yoon JH, Kim CY, Park MH, Kim LH, Park BL, Shin HD. Association of TNF-alpha promoter polymorphisms with the clearance of hepatitis B virus infection. Hum Mol Genet. 2003;12:2541-2546. [PubMed] [DOI] |
| 5. | Wang C, Tang J, Song W, Lobashevsky E, Wilson CM, Kaslow RA. HLA and cytokine gene polymorphisms are independently associated with responses to hepatitis B vaccination. Hepatology. 2004;39:978-988. [PubMed] [DOI] |
| 6. | Ben-Ari Z, Mor E, Papo O, Kfir B, Sulkes J, Tambur AR, Tur-Kaspa R, Klein T. Cytokine gene polymorphisms in patients infected with hepatitis B virus. Am J Gastroenterol. 2003;98:144-150. [PubMed] [DOI] |
| 7. | Bevilacqua MP, Nelson RM, Mannori G, Cecconi O. Endothelial-leukocyte adhesion molecules in human disease. Annu Rev Med. 1994;45:361-378. [PubMed] [DOI] |
| 8. | Phillips ML, Nudelman E, Gaeta FC, Perez M, Singhal AK, Hakomori S, Paulson JC. ELAM-1 mediates cell adhesion by recognition of a carbohydrate ligand, sialyl-Lex. Science. 1990;250:1130-1132. [PubMed] [DOI] |
| 9. | Springer TA. Traffic signals for lymphocyte recirculation and leukocyte emigration: the multistep paradigm. Cell. 1994;76:301-314. [PubMed] [DOI] |
| 10. | Wenzel K, Felix S, Kleber FX, Brachold R, Menke T, Schattke S, Schulte KL, Gläser C, Rohde K, Baumann G. E-selectin polymorphism and atherosclerosis: an association study. Hum Mol Genet. 1994;3:1935-1937. [PubMed] [DOI] |
| 11. | Wenzel K, Ernst M, Rohde K, Baumann G, Speer A. DNA polymorphisms in adhesion molecule genes--a new risk factor for early atherosclerosis. Hum Genet. 1996;97:15-20. [PubMed] [DOI] |
| 12. | Ellsworth DL, Bielak LF, Turner ST, Sheedy PF 2nd, Boerwinkle E, Peyser PA. Gender- and age-dependent relationships between the E-selectin S128R polymorphism and coronary artery calcification. J Mol Med. 2001;79:390-398. [PubMed] [DOI] |
| 13. | Zheng F, Chevalier JA, Zhang LQ, Virgil D, Ye SQ, Kwiterovich PO. An HphI polymorphism in the E-selectin gene is associated with premature coronary artery disease. Clin Genet. 2001;59:58-64. [PubMed] [DOI] |
| 14. | Rauchhaus M, Gross M, Schulz S, Francis DP, Greiser P, Norwig A, Weidhase L, Coats AJ, Dietz R, Anker SD. The E-selectin SER128ARG gene polymorphism and restenosis after successful coronary angioplasty. Int J Cardiol. 2002;83:249-257. [PubMed] [DOI] |
| 15. | Li Y, Wei YS, Wang M, Zhang PA, Jiang XJ, Huang CX. Association between the Ser128Arg variant of the E-selectin and risk of coronary artery disease in the central China. Int J Cardiol. 2005;103:33-36. [PubMed] [DOI] |
| 16. | Galimberti D, Fenoglio C, Clerici R, Comi C, De Riz M, Rottoli M, Piccio L, Ronzoni M, Venturelli E, Monaco F. E-selectin A561C and G98T polymorphisms influence susceptibility and course of multiple sclerosis. J Neuroimmunol. 2005;165:201-205. [PubMed] [DOI] |
| 17. | Hattori H, Sato H, Ito D, Tanahashi N, Murata M, Saito I, Watanabe K, Suzuki N. A561C polymorphism of E-selectin is associated with ischemic cerebrovascular disease in the Japanese population without diabetes mellitus and hypercholesterolemia. Brain Res. 2006;1108:221-223. [PubMed] [DOI] |
| 18. | El-Magadmi M, Alansari A, Teh LS, Ordi J, Gül A, Inanc M, Bruce I, Hajeer A. Association of the A561C E-selectin polymorphism with systemic lupus erythematosus in 2 independent populations. J Rheumatol. 2001;28:2650-2652. [PubMed] |
| 19. | Cervello M, Virruso L, Lipani G, Giannitrapani L, Soresi M, Carroccio A, Gambino R, Sanfililippo R, Marasà L, Montalto G. Serum concentration of E-selectin in patients with chronic hepatitis, liver cirrhosis and hepatocellular carcinoma. J Cancer Res Clin Oncol. 2000;126:345-351. [PubMed] [DOI] |
| 20. | Yan MX, Mao HT, Liu Q, Wang WQ, Li YQ. Elevated levels of serum soluble E-selectin in patients with chronic hepatitis B: Correlation with T lymphocyte subsets, NK cells and liver inflammation. Hepatol Res. 2006;35:111-117. [PubMed] [DOI] |
| 22. | Yoshida M, Takano Y, Sasaoka T, Izumi T, Kimura A. E-selectin polymorphism associated with myocardial infarction causes enhanced leukocyte-endothelial interactions under flow conditions. Arterioscler Thromb Vasc Biol. 2003;23:783-788. [PubMed] [DOI] |
| 23. | Rao RM, Haskard DO, Landis RC. Enhanced recruitment of Th2 and CLA-negative lymphocytes by the S128R polymorphism of E-selectin. J Immunol. 2002;169:5860-5865. [PubMed] |
| 24. | Mlekusch W, Exner M, Schillinger M, Sabeti S, Mannhalter C, Minar E, Wagner O. E-Selectin and restenosis after femoropopliteal angioplasty: prognostic impact of the Ser128Arg genotype and plasma levels. Thromb Haemost. 2004;91:171-179. [PubMed] |